

作者:
达多·穆克吉
来源:
《纽约客》
转自:药明康德(ID:
WuXiAppTecChina
)
随着基因检测和液体活检等技术的进步,我们可以比以前更早地检测肿瘤,但随着而来的问题是我们能否预测癌症是否真正具有危险性?最近,《纽约客》(The New Yorker)的专栏作家悉达多·穆克吉(Siddhartha Mukherjee)博士的最新文章“癌症入侵的方程式”可能有助于我们了解关于癌症的最新观点。通过跟许多肿瘤学研究专家进行交流,并且从一个生态入侵的故事中,穆克吉博士带我们认识了癌症“土壤”和“种子”的观点。穆克吉博士因为《众病之王:癌症传》获得普利策奖,他的另一部作品《基因:亲密的历史》被比尔·盖茨先生推荐为2016年最佳书籍。
怪异的湖面
2011年夏天,密歇根湖的水变得清澈透明。灯光斜照着湖面,像来自不明飞行物(U.F.O.)的探照灯;当你的视线穿透湖面,看见湖底的沉船一角,原本愉悦的感觉很快被恐慌所取代:一个自然界的湖泊看起来不应该像人造游泳池这般清澈见底!生物学家进一步调查后发现,通常湖泊里生长的上百万浮游生物在这个湖中几乎看不到,它们已经被一些贪婪的生物体吞噬。
罪魁祸首可能是某种软体动物。1980年代末,从里海和黑海驶来的货船倾倒的水里携带了起源于乌克兰河口盆地的物种——斑马纹贻贝,从此对北美五大湖区造成了外来生物污染。
起初,软体动物似乎是无伤大雅的客人。然后突然之间事情发生改变。1990年代中期,贻贝悬挂在沉船龙骨,涡轮机和螺旋桨上形成球茎和肿块,覆盖住码头,堵塞水管和卫生系统,并且冲刷岸边,使得在一些湖滩上你几乎是走在坚实的贝壳上。最终,水的清澈度开始增加,就像文中开头的第一幕,可怕怪异。

▲密歇根湖的湖岸线被斑马纹贻贝占领(图片来源:维基百科)
2012年底,密歇根湖南部的贻贝密度竟然达到每平方米一万个。而据估计,湖中有950万亿个贻贝,湖底部就像钙裂痕的地毯。2015年,贻贝的密度达到每平方米一万五千个,重量加起来比起湖中的所有鱼类都重。过往船只必须通过水清洗设备拆除和剥离贝壳,累积造成了数十亿美元的损失。 “ 不要移动贻贝!” 的雷达警告标志被放置在湖泊中,而入侵者——斑马纹贻贝的数目还在继续蔓延。
为什么贻贝会成为如此凶恶的入侵者?它们的一些侵略性是由生物学特征决定的。斑马贻贝是育种冠军,每个个体每年可以产生超过一亿个卵。然而,在乌克兰河口盆地,这些贻贝很少达到北美五大湖区贻贝密度的五分之一。它们很少侵入30米以下的深度,堵塞船舶设备,或形成钙质。简而言之,它们是相对温顺的物种,也许是由水质、其天然的捕食者和病原体、流域的浅层或我们未知的因素限制了这些贝类的繁殖。

▲斑马纹贻贝(图片来源:维基百科)
解开这个奇怪谜题需要从两个方面入手。一半的原因在于贻贝的内在生物学特征——基因,形态,营养偏好,生殖习性。另一半涉及生物学与环境之间的相互作用。一个生态学本科生都能理解的概念是:生物体的“入侵”永远是一个相对的概念。亚洲鲤鱼是美国水域的另一个强大侵略者,但它们在亚洲并不具有侵害性。日本的蓼科杂草,现在殖民了英国的许多珍贵花园,但它们在日本几乎不被称为杂草。
有时候,一个环境中的侵略者是另一个环境的良民。温柔只是有条件的温和,当条件改变时,它们可能会突然占领地球。
贻贝,蓼科杂草和癌症
六月份的一个晚上,当我走在芝加哥的密歇根湖岸边时,我想到了贻贝,蓼科杂草和癌症。当时上万名专家抵达芝加哥,准备出席美国临床肿瘤学会年会(ASCO),这是世界级的癌症大会。这个会议侧重于讨论癌细胞的固有特性,以及对抗癌细胞的治疗方式。然而,这可能只是癌症认知的一部分。
我们想知道正在对付什么“软体动物”,但我们也需要知道这是在哪个“湖泊”。
ASCO会议前几周,我在哥伦比亚大学医院(Columbia University’s hospital)遇到了一名乳腺癌女性患者。来自布鲁克林的超市收银员安娜·古泽洛女士(Anna Guzello)几个月前就注意到了左乳房的小肿块。之后,乳房X光检查显示出浑浊的,蜘蛛样的肿块,组织活检证实是恶性肿瘤。
因为考虑到肿块的大小和位置,简单的肿瘤切除术不能防止复发,古泽洛女士接受了全面的乳房切除术,并计划进行乳房重建手术。五月的一个下午,她拜访了哥伦比亚大学乳腺肿瘤学家凯瑟琳·克鲁医生(Katherine Crew),讨论接下来的治疗步骤。
克鲁医生告诉她:“首先,好消息。身体里没有明显的癌细胞。”

▲Katherine Crew教授(图片来源:哥伦比亚大学)
外科医生已经去除肿瘤,这是个好事。腋窝淋巴结(一个癌症经常转移的部位)也没有癌症的迹象。在肿瘤学上,古泽洛女士被归类到NED(no evidence of disease):“没有疾病的证据”。
但这只是一个毫无意义的短语:“证据”指的是我们的知识状态,而不是疾病的状态。
乳腺癌细胞有可能离开了古泽洛女士的乳腺并且定居在她的大脑,脊髓或骨骼中,在那里它们可能处于扫描和测试不可见状态。接受完全乳房切除术和“没有疾病证据”的患者可能在切除原发性癌性肿块几个月,甚至几十年后发生乳腺癌转移性复发。癌症患者通常会死于这些转移,而不是其原发性肿瘤(除了可以侵袭颅骨的脑癌,以及血液癌)。
“所以我们要继续用药物治疗,以减少转移的可能性,就是减少乳腺之外的地方会有癌细胞生长,”克鲁医生告诉古泽洛女士。她解释说,这些药物分为三大类:杀伤细胞的化疗;靶向治疗,如赫赛汀,特异性追踪癌细胞中含有异常基因的产物;以及雌激素阻断药,通常要服用5到10年。
古泽洛女士摸了摸头发,嘴唇紧闭。激素药听起来很好,但是她对杀伤细胞的化疗感到胆怯。
古泽洛女士说:“如果我没有发生转移,那么我就是在无畏地冒险。” 这些风险包括:脱发,腹泻,感染,可能性很小的持续麻木(会让她的手感觉像戴着皮手套一样,对冷敏感)。化疗意味着她需要到医院输液,每周一次,持续近半年。她家里还有一个严重残疾的母亲需要照顾,休假日也不多。
有没有办法确定她发生转移的可能性?
“那样我就可以更真实地评估治疗风险和收益,”古泽洛女士说。

▲Daniel Hayes教授(图片来源:密歇根大学)
这个问题已经在肿瘤学领域回响了数十年。直到现在,我们仍然不太擅长预测某个患者的癌症是否会转移。密歇根大学(University of Michigan)乳腺肿瘤学家丹尼尔·海斯博士(Daniel Hayes)在芝加哥的ASCO会议上告诉我,
癌症转移似乎像是随机的暴力行为。
“因为我们不能确定乳腺癌患者是否会有转移,所以我们倾向于全部化疗,好像每个患者都有潜在的转移。”化疗的毒性很大,化疗的患者中只有部分人能从中获益,但是我们不知道是哪一部分。所以,我们别无选择,只能过度治疗。对于像古泽洛女士这样的女人来说,
决策的难度不在于“为什么是我”,而是“是否会是我”。
“种子和土壤”
一直以来,科学家认为癌症的转移依赖于肿瘤栖息地。
1889年,一名名叫史蒂芬·佩吉特(Stephen Paget)的英国医生开始了解癌症的“生长及其次生长状况”。他的父亲James Paget是现代病理学创始人之一,叔叔是剑桥的医学教授。在佩吉特时代,癌症被认为是从其原发部位扩散而成的恶性疾病,像滴在纸上的墨迹。外科医生对这种癌症从中央不断扩大的“离心理论”深信不疑,因此医学界的主流观点是通过外科手术彻底消除癌症(这个理论后来构成了外科医生William Halsted推崇的乳房根治术的基础。)

▲James Paget医生是现代病理学创始人之一(图片来源:维基百科)
但是当佩吉特医生收集了死于乳腺癌的735名妇女的病例档案时,他发现了一种奇特的癌症转移模式。转移似乎不是以离心扩散模式,而是离散地出现在肿瘤解剖部位远处。而且传播的模式也并非随机:
癌症对某些器官有着奇怪和强烈的偏好。
在300多个转移灶中,佩吉特医生发现241个在肝脏,17个在脾脏中,70个在肺部。
为什么肝脏是转移高发部位,而血液供应,大小和肝脏接近的脾脏却不容易发生转移?随着佩吉特医生的深入探索,他发现癌细胞甚至对同一器官中的特定部位也有偏好。骨骼是乳腺癌转移的常见部位,但并不是所有骨骼都是同样敏感的。“谁看过手骨或脚骨被二次癌症攻击的?”
佩吉特医生创造了“种子和土壤”一说来形容这一现象。“种子”是癌细胞,“土壤”是癌细胞繁殖的局部生态系统(器官)。佩吉特医生的专注研究人体的癌症转移模式。一个器官是否会发生癌细胞转移似乎取决于器官的性质或位置——局部生态系统。然而,“种子和土壤”模式的逻辑最终引出了全局生态学的问题:
为什么一个人的身体容易受到影响,而另一个人却不会?
佩吉特医生提出的观点——癌症转移是癌细胞与其环境之间病理关系的结果,由于没有确凿的证据而被弃置了一个多世纪。直到1970年代,癌症转移领域开创性的研究者以赛亚·费德勒博士(Isaiah J. Fidler)在美国国家癌症研究所(National Cancer Institute)工作时,开始研究组织与肿瘤之间的“对话”。费德勒博士提出,肿瘤是由数以百万计的细胞的非均质混合物组成,
只有一部分细胞离开原发肿瘤,与另一个器官的“土壤”形成联盟,并引起转移。

▲Isaiah J. Fidler博士(图片来源:德州大学健康科学中心)
在同一时期,先在加州大学伯克利分校(University of California, Berkeley),然后在劳伦斯伯克利国家实验室(Lawrence Berkeley National Laboratory)工作的米娜·比塞尔博士(Mina Bissell)开始研究肿瘤形成(或没有形成)的微环境,找到能够促进或阻止各种器官癌症生长的因素。她发现,
环境至关重要。
癌症本位论仍占主导
然而,肿瘤学整体上仍然由简单的模型主导。当我还是个医学生时,曾经背诵过骨转移癌症(乳腺癌,肺癌,甲状腺癌,肾癌,前列腺癌)的名单,当时我脑中出现了转移瘤如何形成的画面。癌症通过血管“传播”,“攻击”器官,并开始发芽和蓬勃生长。1990年代后期,我在在癌症病房轮转实习时,那里的医生强化了我这个想法。一名外科医生曾在手术室对另一名外科医生说道:“这个肿瘤侵袭了大脑。” (相比之下,谁会说感冒侵袭了你)。这种说法包含主语,动词,宾语:
癌症是侵略者、转移者。患者和他们的器官是受害者,被动的旁观者。
这种语言模式反映了癌症本体论。即使研究范式转移,这种思维仍然存在。麻省理工学院(M.I.T.)肿瘤生物学家罗伯特·温伯格博士(Robert Weinberg)说:“癌症核心上是一种遗传疾病”。因此,几十年来,生物学家努力寻找使癌细胞异常生长,代谢,再生的基因突变。1980年代末期,以温伯格博士为首的许多癌症生物学家致力于发现癌症转移基因——met基因(药明康德团队注:指代metastasis)的作用。乳腺癌细胞有可能获得一个突变,然后离开乳腺,到大脑里定居吗?

▲Robert Weinberg博士(图片来源:MIT)
尽管经过十多年的研究,met基因仍未找到。“我们从未找到任何东西,”温伯格博士告诉我。有时在与原发性肿瘤不同的癌症转移灶中检测到突变,但突变不是转移的单一驱动因素。
从1990年代末期开始,癌症遗传学家尝试了另一种思路。他们认为癌细胞中的突变不是孤立发生作用的,它们可以开启和关闭其他几十种甚至数百种基因。
激活和抑制的这些基因可能会产生巨大的差异
——就像同一个键盘可以发出截然不同的声音,毛毛虫和蝴蝶有相同的基因组但是长得完全不一样,你的肝细胞与脑细胞也有相同的基因组但是它们功能不同。
这种从单个突变转变为寻找基因调控模式——“基因表达标记”的方法,被证明是有效的。这种模式也被开发成预测性检测项目,快速进入临床。
在乳腺癌中,这种基因检测已被广泛使用,如MammaPrint和Oncotype DX,帮助医生识别某些转移性低风险的患者,并可以安全地避免化疗。丹尼尔·海斯医生说:
“我们已经能够在一些乳腺癌亚型中避免三分之一以上的患者过度化疗”。
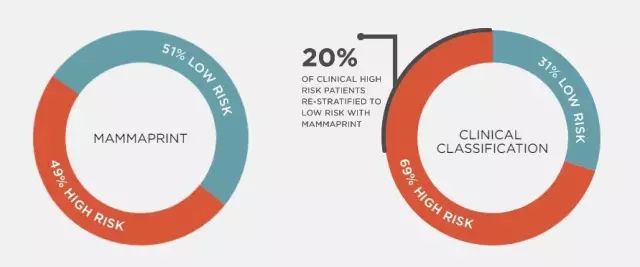
▲MammaPrint是一种预测乳腺癌复发率的基因检测项目,数据显示20%的患者通过该检测重新定义为低风险,从而避免过度化疗(图片来源:agendia)
海斯博士认为基因检测能使患者受益,例如高表达生长因子受体蛋白(HER2)阳性的乳腺癌患者建议服用靶向治疗药物赫赛汀,雌激素受体(ER)阳性的患者建议服用抗雌激素药物。但是,尽管我们在使用遗传标记物作为指标靶向肿瘤细胞方面取得了不少进展,但我们预测癌症转移的努力进展缓慢。
“是否会是我”这个问题依然困扰着整个肿瘤学领域。
肿瘤学家哈罗德·伯斯坦博士(Harold Burstein)称,化疗的“不确定性盒子”仍然顽固地关闭。
肿瘤随时都在释放细胞
2001年,纽约纪念斯隆-凯特琳癌症中心(Memorial Sloan Kettering Cancer Center)的癌症生物学家琼·马萨圭博士(Joan Massagué)看到了一篇论文,彻底改变了他对转移的想法。他花了几年时间研究细胞生物学,阐明了乳腺细胞迁移到骨骼而不是大脑的基因调控机制。然后在一本晦涩的杂志上一篇30年前发表的文章里,他找到了一个关键证据。这篇文章中写道,美国国立卫生研究院(National Institutes of Health)的研究人员将乳腺癌细胞植入雌性大鼠的卵巢,细胞生长形成豆粒肿瘤。然后,研究人员每隔几个小时从静脉中抽出血液,计算肿瘤脱落的癌细胞数目。

▲Joan Massagué博士(图片来源:纪念斯隆凯特琳癌症中心)
结果令调查人员感到困惑。他们发现,大约每24小时,每毫升血液里有两万个癌细胞。按照大约三百万个癌细胞1克来估算,在一天之内,肿瘤的重量减少了近十分之一。后来科学家采用更复杂的方法和动物肿瘤进行了更多研究,证实肿瘤不断地向外释放细胞!(虽然局部的人体肿瘤释放率较难研究,但现有研究结果已经证实了这个一般现象)
“我们认为转移是一个持续的现象,”马萨圭博士说:“我们需要找到允许细胞脱离肿瘤并进入血液和淋巴结的物质。如果原发性肿瘤持续地分泌细胞,并且每个细胞都能够形成转移,那么患者的身体里应该存在无数可见的转移性肿瘤。如果是这样,古泽洛女士女士的乳腺肿瘤会转移到大脑,骨骼和肝脏中。可是为什么她的身体的其他地方没有明显的疾病证据呢?
真正的难题不是为什么某些癌症患者会发生转移,而是为什么不是所有癌症患者都发生转移。
马萨圭博士说:“转移不足的唯一合理解释是细胞大量死亡或细胞休眠浪潮限制了转移。肿瘤脱落的细胞要么被(免疫系统)杀死,要么停止分裂进入休眠。当肿瘤细胞进入循环系统时,它们会立即发生大规模灭亡。只有少数癌细胞能够到达目标器官,如大脑或骨骼。”在那里,它们面临着在陌生和敌对环境中生存的难题。马萨圭博士推断,那几个幸存的细胞必须处于休眠状态。“只有当休眠的癌细胞重新激活并开始分裂后,才会发生临床上可见的转移——用CT扫描或核磁共振检测的转移病灶。”
恶性,不仅是指癌细胞的扩散,也包括停留和繁殖。

韩国的甲状腺癌早期筛查
2012年春天,马萨圭博士等人正在寻找休眠癌细胞,但达特茅斯学院(Dartmouth College)流行病学家吉尔伯特·韦尔奇博士(Gilbert Welch)则专注于另一个不同的问题:癌症早期发现。早期检测旨在捕获和消除癌症,避免转移,但是一些癌症筛查项目的死亡率统计研究数据并没有显示出筛查的益处。

▲Gilbert Welch博士(图片来源:达特茅斯学院)
韦尔奇博士告诉我一个流行病的故事。在大约15年前,韩国开始进行甲状腺癌筛查。首尔的初级保健办公室配备了小型超声波设备,试图发现最早的癌症征兆。当发现一个可疑的结节时,就会进行活检。如果病理报告为阳性,就采取甲状腺手术切除。
甲状腺癌的官方发病率——特别是称为甲状腺乳头状癌的亚型——在韩国范围内开始飙升。2014年,甲状腺癌发病率达到1993年的15倍,成为该国最常见的癌症。用一位研究员的话,好像一场“甲状腺海啸”突然袭来。数十亿韩元花费在治疗上,成千上万的甲状腺被手术切除。
然而人们死于甲状腺癌的比例却保持不变。
究竟发生了什么?这不是医学上的错误:在显微镜下观察到有问题的结节的确符合甲状腺癌的标准。然而,病理学家发现的这些甲状腺癌几乎没有引起疾病的倾向。患者没有被误诊但被过度诊断;也就是说,
这些切除的是可能永远不会产生临床症状的肿瘤。
许多不同肿瘤类型的研究都佐证了这个观点。1985年,芬兰的病理学家对101名死于不相关的事故(车祸或心脏病发作)的人进行尸体解剖,以确定他们是否有甲状腺乳头状癌。令人惊讶的是,三分之一的腺体中都有甲状腺癌。另一个乳腺癌的类似研究比较了尸体解剖中可检测的乳腺癌与终生乳腺癌死亡风险的关联,结果表明过激的早期检测可能造成乳腺癌过度诊断频率激增,导致不必要的干预措施。调查了前列腺癌筛查结果后,韦尔奇博士计算出,30到100位男性都经历了不必要的治疗,通常是外科手术或放射治疗。
海斯医生告诉我:“通过乳腺X线照相术早期发现乳腺癌可以拯救妇女的生命,虽然益处很小”。但同样重要的是我们要如何处理检测到的肿瘤:我们可以分辨出哪些肿瘤需要用化疗或其他干预措施进行系统治疗吗?海斯医生继续说道:
“我们想要实现的不仅仅是早期检测,而是早期预测”。
对于韦尔奇博士来说,诊断为甲状腺癌或前列腺癌的病例飙升,但是对总体死亡率没有影响,这是一个警告:一知半解是一件危险的事情。癌症筛查运动扩大了疾病发现率,但是却不能告诉我们在某种特定情况下是否需要治疗。早期检测帮助我们判断“何时”和“什么”,但没有告诉我们“是否”。还有一个神秘的元素是,为什么一些癌症扩散会致死,但仍有许多癌症是温和的?
2012年3月的一天,韦尔奇博士飞往华盛顿参加了一个关于癌症转移的会议。一张幻灯片引起了他的注意,它描绘了密歇根湖的贻贝侵略。演讲者肯尼斯·皮塔博士(Kenneth Pienta)是密歇根大学(University of Michigan)的肿瘤学家,他听说过贻贝危机,并且发现这与癌症很相似。研究人员不再将侵袭性视为癌症内在本质,而是癌症与环境之间的病理关系。
“癌细胞和宿主细胞形成了一个生态系统。最初,癌细胞是新环境的入侵物种。
最终,癌细胞与宿主细胞之间的相互作用创造了一个新的环境。不仅要问癌症对你做了什么,也要关心你对癌症做了什么”。

▲Kenneth Pienta博士(图片来源:密歇根大学)
皮塔博士继承了佩吉特医生和费德勒博士的传统,更加重视癌症发生的“土壤”。一名原发性乳腺癌的患者其实陷入的是一场沉默的战争。几代肿瘤学家的研究试图找到这场拉锯战的一个可能结果:当患者失利,她就死于转移。但是当癌症失利时会发生什么?也许癌细胞曾试图入侵新的部位,但由于免疫系统和其他生理挑战而在途中被消灭;也许最终有那么几个细胞经过远征后幸存,到达新器官,它们像种子落在盐滩上。
韩国的甲状腺癌筛查的故事,让流行病学家韦尔奇博士陷入了迷惑。我们必须警惕猖獗的斑马贻贝和濒危的紫猫爪贻贝之间的差异——但是北美区五大湖与狄更斯湖之间的区别呢?有证据表明,大多数患有前列腺癌的男性将终生都不会发生转移。是什么使其他人更容易受癌症伤害?韦尔奇博士知道,通常的方法是在癌细胞中寻找标记物,以找到基因激活的模式,其中某些模式会导致癌症的危险性。这些寻找癌细胞的特征的方法显而易见是解决问题的关键。
但是,皮塔博士认为这种做法太狭窄了。
对抗癌症的部分答案可能在于癌症与其宿主之间的“种子与土壤”的生态关系。
两个澳大利亚黑色素瘤患者的故事
1992年,一位50多岁的澳大利亚高中老师被诊断患有黑素瘤,他左腋到身体都出现黑色条纹。诊断后的几周,肿瘤的边界开始发生变化。一边变灰,另一边缩小。“他出现一个经典的自发性消退,通常是癌变病变是被免疫系统控制的标准,”患者的儿子大卫·亚当斯先生(David Adams)告诉我。手术切除原发性黑色素瘤后,一直没有发生转移。但他父亲有一个50多岁的朋友就没有那么幸运:他的原发性黑色素瘤被发现时,大脑里已经出现可见的转移灶。

▲David Adams博士(图片来源:桑格研究所)
亚当斯博士在悉尼学习遗传和生理学,后来加入剑桥的桑格研究所(Sanger Institute),领导一个研究黑色素瘤生物学的小组。他没有忘记他父亲的案例,这是驱使他从事科研的原因。是什么使黑素瘤在一个人体内消退,但是在另一个人体内进攻?
偶然地,亚当斯博士在关于肾脏捐献的医学文献报道中得知一个黑色素瘤病例。一个患者——简称他为DG——被诊断患有黑色素瘤,并且经过手术成功切除。几年后,被认为是完全健康的DG向朋友捐献了一个肾。朋友服用了常规的免疫抑制剂,以防止肾脏抑制排斥。然而,几个星期后,接受者的肾脏中几百个黑色素瘤开始发芽。这些奇怪的黑素瘤来自DG的细胞。捐献的肾脏必须马上被切除。但是这时候,捐献者仍然保持健康,他的体内并没有黑色素瘤的迹象。
亚当斯博士认识到,原始宿主环境在限制转移性增生方面发挥了至关重要的作用。捐献者的黑素瘤细胞在他的肾脏中处于休眠状态,类似于马萨圭博士在小鼠中发现的休眠现象。
当休眠的细胞到达免疫抑制的受体中时,“土壤”改变,癌症开始生长。
亚当斯博士告诉我:“捐献者的免疫反应肯定限制了转移性癌症的发展” 。
2013年,亚当斯博士开始计划一个雄心勃勃的实验来确定癌症抑制宿主因素。他打算利用一个含有数百种遗传改变的小鼠样本库,将相同的癌细胞植入这些样本,研究哪些样本会允许癌症转移,哪些会抑制转移?
这是一个巧妙的颠覆经典的实验策略。几十年来,生物学家一直在改变癌细胞的基因,并将细胞注射到几个标准化的小鼠中。“不同癌症进入同一样本”实验允许癌症生物学家观察癌症基因的变化如何影响其生长,代谢和转移。但宿主基因组的变异会有什么影响?亚当斯博士的“同样的癌症进入不同样本”实验将注意力从“种子”转移到“土壤”。
鸡翅膀的实验,以及三个小鼠实验
1980年代,比塞尔博士曾经做过的一个迷人的实验。当在鸡的翅膀里注射致癌病毒,那里会生成肿瘤。如果注射一个翅膀,并且弄伤另一个翅膀,则受伤翅膀也会生长肿瘤。但是,如果向小鸡胚胎注射致癌病毒,就不会发生肿瘤。比赛尔说:“那时候,人们只是把癌症看作致癌基因(oncogene)驱动的反应。但是现在看来,
致癌基因也需要通过局部环境开启或关闭”。
虽然种子很重要,土壤的特征也可能影响它是否会发芽。
在纽约和波士顿,马萨圭博士和温伯格博士等研究人员也在调查“宿主因素”。温伯格博士和他的同事们研究了一组老鼠,它们的肺部已喷洒数千个休眠的癌细胞。
一些小鼠被暴露于炎症刺激,它们体内的癌细胞苏醒并变得具有侵袭性。
马萨圭博士和他的学生进行了一项特别的实验,他们在携带休眠癌细胞的小鼠中去除各种免疫细胞。某些免疫细胞类型属于“获得性免疫”系统,其中包含T细胞和B细胞,这两种免疫细胞能够识别并且记忆新的病原体,并在它们下一次出现时将其捕获。获得性免疫是疫苗的原理基础,这也是为什么人们很少会两次得水痘。
但是在马萨圭博士的试验中,最令人吃惊的效果发生在另一种类型的免疫细胞——自然杀伤细胞(NK细胞)上。这些细胞属于我们的“天然免疫”系统 ——它们的能力不是学习并识别任何新的病原体,而是被预先编程好随时消灭病态或异常的宿主细胞。马萨圭博士的团队认为,NK细胞是癌症转移的关键控制者。
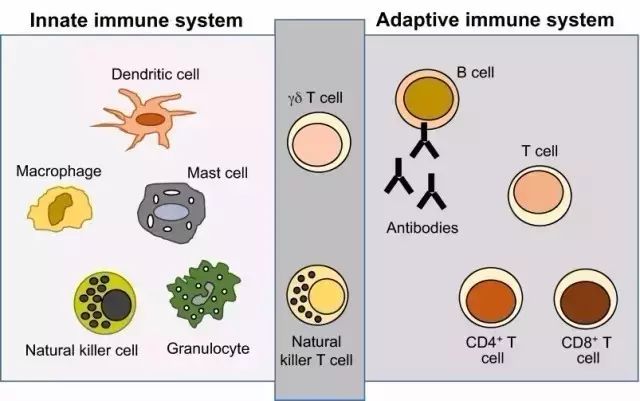
▲天然免疫(左)和获得性免疫(右)系统的细胞类型(图片来源:dmm.biologists.org)
与马萨圭博士团队关注的细胞类型不同,亚当斯博士感兴趣的是宿主基因可能影响癌症转移。2013年初,亚当斯博士实验室的博士后,恰好也是他妻子的路易斯·范德韦恩博士(Louise van der Weyden)把一种小鼠黑色素瘤细胞(一种咖啡黑色浆液)的悬浮液注射到数十几只小鼠品系中。几个星期后,她计算了每只小鼠肺部可见的转移灶数量,拿到数据的第一时间冲进亚当斯博士的办公室。
亚当斯博士回忆说,
即使在这么小的研究队列中(十几只小鼠),结果的差异也是显而易见的。
一些小鼠发生了数百个转移,形成一连串黑色斑点。转移最严重的小鼠的肺部明显变黑。然而,有些老鼠几乎没有转移。亚当斯博士说:“这证明了同一种癌症在不同的宿主环境中可以发挥如此不同的效果。”
两年后,范德韦恩博士累积接种了810只黑色素瘤小鼠,并分别检测了癌症转移病理特征。结果发现,有15种小鼠显示出对癌症转移的中度或高度抗性。这15个小鼠品系中的12个含有影响免疫调节的基因变异,再次表明基因突变在癌症传播和侵袭能力中的有力作用。其中有一只小鼠表现尤为突出。暴露于研究中使用的癌细胞剂量时,正常小鼠大约发生250个转移病灶。然而,这种抗性小鼠平均只有15到20个转移灶。其中有几只老鼠一点都没有转移,暴露两个月后,它们的肺部看起来完好如初。
为了确定这种抗转移特性是否只限于黑色素瘤(一种公认能引起免疫反应的癌症类型),亚当斯博士和范德韦恩博士测试了另外三种类型的癌症:肺癌,乳腺癌和结肠癌。在所有这些癌症中,这种抗性小鼠都缺乏癌症转移。进一步研究发现,该小鼠中称为Spns2的基因发生变异,通过一系列级联反应,增加了肺部免疫细胞,
特别是NK细胞的浓度——这恰好是马萨圭博士实验室发现的具有最强的限制癌症转移能力的免疫细胞类型!
亚当斯博士的父亲的黑色素瘤从他50多岁确诊后一直没有复发,他最后死于前列腺癌。亚当斯博士说:“几年前,我可能会考虑这是黑色素瘤与前列腺癌本身转移潜力方面的差异。它们是‘坏’癌症与‘好’癌症的代表。但现在我会更多的思考:为什么我父亲的体内更容易发生前列腺癌转移,而不是黑素瘤转移?”















