
高中知识搜索小程序
1
.
氨气的实验室制法
(
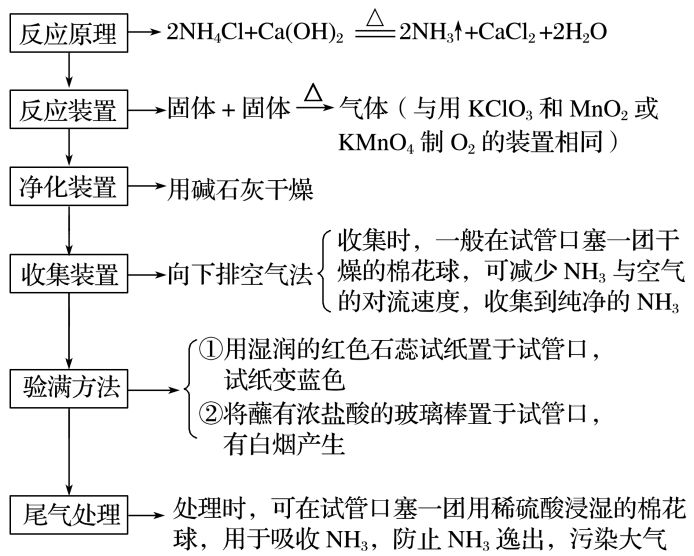
1)用铵盐和碱制取
①
实验装置
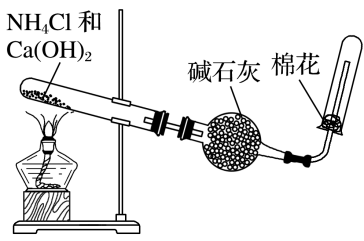
②
实验分析
(
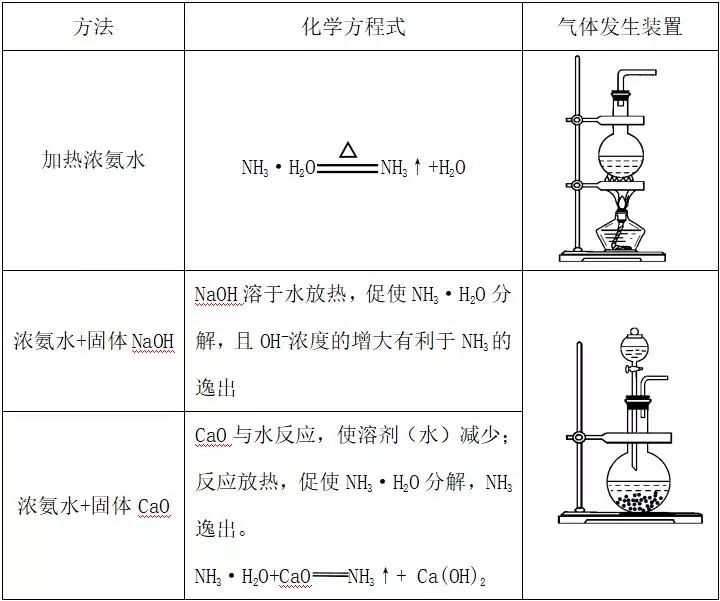
2)用浓氨水制取
2.喷泉实验
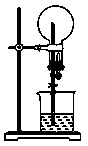
中学教材中喷泉实验装置如上图所示。实验操作是:打开橡皮管上的夹子,挤压滴管的胶头,则烧杯中的水由玻璃管进入烧瓶,形成喷泉。
(
1)喷泉实验的原理
因为烧瓶内气体易溶于水或易与水反应,使瓶内压强减小,形成压强差,大气压将烧杯中的水压入烧瓶而形成喷泉。
(
2)能形成喷泉的条件
从原理上讲,气体要易溶于水或易与水反应,以形成足够大的压强差;从实验条件上讲,烧瓶内气体要充满,气体和仪器均要干燥,装置的气密性要好。
(
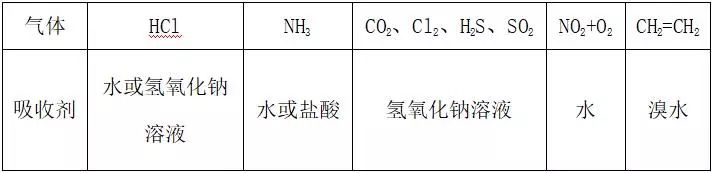
3)形成喷泉的气体与液体组合
①
极易溶于水的气体
(NH
3
、
HCl等)与水可形成喷泉;
②
酸性气体与
NaOH溶液组合能形成喷泉。
(
4)喷泉实验成功的关键
①
盛气体的烧瓶必须干燥;
②
气体要充满烧瓶;
③
装置不能漏气
(实验前应先检查装置的气密性);
④
所用气体能大量溶于所用液体或气体与液体能快速反应。
(
5)常见的喷泉实验装置
喷泉实验的本质是形成压强差而引发液体上喷,为此可设计多种不同的装置和采用不同的操作
(如使气体溶于水、热敷、生成气体、发生气体体积减小的反应等)来产生喷泉。
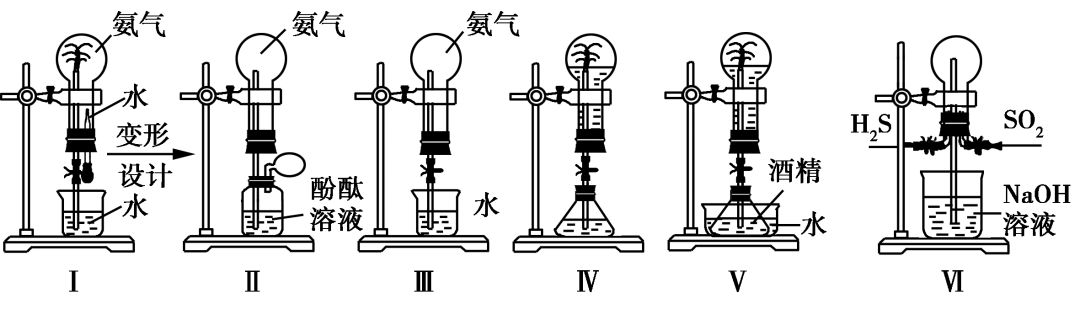
装置
Ⅰ
:打开止水夹,挤压胶头滴管的胶头,使少量水进入烧瓶,导致大量的
NH
3
溶解。烧瓶内形成负压而产生喷泉。
装置
Ⅱ
:挤压气球,即可使少量的溶液沿导管进入烧瓶,导致大量的
NH
3
溶解,烧瓶内形成负压而产生喷
泉。
装置
Ⅲ
:去掉了胶头滴管。打开止水夹,用手
(或热毛巾等)捂热烧瓶,氨气受热膨胀,使氨气通过导管与水接触,即产生喷泉。(或用浸冰水的毛巾“冷敷”烧瓶,使水进入烧瓶,烧瓶内氨气溶于水)
装置
Ⅳ
:在锥形瓶中加入能产生气体的物质,使锥形瓶内气体的压强明显增大,将液体压入烧瓶而产生喷泉。
装置
Ⅴ
:在水槽中加入使水温度升高的物质,致使锥形瓶内酒精因升温而挥发,锥形瓶内气体压强增大而产生
喷泉。
装置
Ⅵ
:向烧瓶中通入
H
2
S(或SO
2
),然后通入SO
2
(或H
2
S),有淡黄色粉末状物质生成,瓶内壁附有水珠,NaOH溶液喷到烧瓶内。
(
6)喷泉实验所形成的溶液的物质的量浓度的计算前提:气体充满,溶质不扩散。气体体积换算为标准状况,设烧瓶体积为
V
L。
①
“NH
3
+H
2
O”和“HCl+H
2
O”型:
V
(气体)=
V
(溶液),则:
c
=
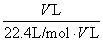 =1/22.4 mol·L
−1
。
=1/22.4 mol·L
−1
。
②
“NO
2
+H
2
O”型:3NO
2
+H
2
O
2HNO
3
+NO,溶液只占烧瓶容积的2/3,
n
(HNO
3
)=
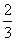 n
(NO
2
),
V
(溶液)=
n
(NO
2
),
V
(溶液)=
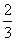 V
L,
V
L,
则:
c
(HNO
3
)=
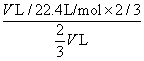 =1/22.4 mol·L
−1
。
=1/22.4 mol·L
−1
。
③
“NO
2
+O
2
+H
2
O”型:依4NO
2
+O
2
+2H
2
O
4HNO
3
,若
V
(NO
2
)
∶
V
(O
2
)≤4(恰好反应或O
2
过量
),则
c
(HNO
3
)=1/22.4 mol·L-1×4/5=1/28 mol·L
-1
;若
V
(NO
2
)
∶
V
(O
2
)>4(剩余NO),则
c
(HNO
3
)介于1/28 mol·L
-1
和
1/22.4 mol·L
-1
之间。

气体验满和检验操作
①
氧气验满:用带火星的木条平放在集气瓶口,木条复燃,说明收集的氧气已满。
②
可燃性气体
(如氢气)的验纯方法:用排水法收集一小试管的气体,用大拇指摁住管口移近火焰,放开手指,若听到尖锐的爆鸣声,则气体不纯;若听到轻微的“噗”的一声,则气体纯净。
③
二氧化碳验满:将燃着的木条平放在集气瓶口,若火焰熄灭,则气体已满。
④
氨气验满:用湿润的红色石蕊试纸放在集气瓶口,若试纸变蓝说明气体已满。
⑤
氯气验满:用湿润的淀粉
碘化钾试纸放在集气瓶口,若试纸变蓝说明气体已满。





