 关注小药说药,一起成长!
关注小药说药,一起成长!
急性髓系白血病(
AML
)和骨髓增生异常综合征(
MDS
)仍然是一种未得到满足的临床需求。根据修订的国际预后评分量表(
IPSS-R
),高风险的MDS和具有不利特征的AML的预后仍然令人沮丧,这些不利特征包括年龄、既往髓系疾病、不良遗传风险和并发基因突变。事实上,具有极高IPSS-R风险的MDS患者的中位总生存期(
OS
)仅为0.8年,而年轻患者的新发AML患者的五年生存率为40%,大于70岁患者的5年生存率不到5%,这突显了亟需新的治疗策略的迫切性。
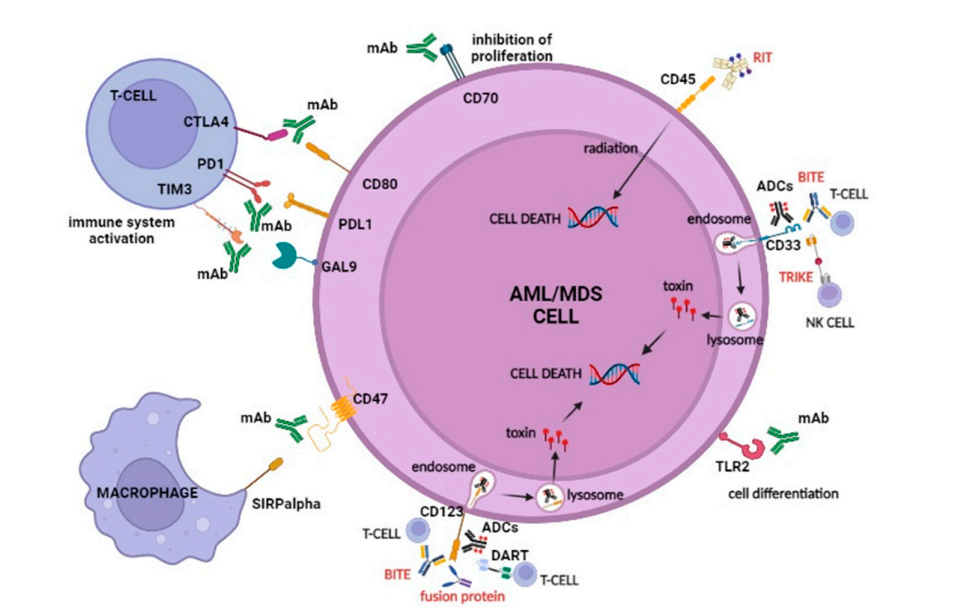
免疫反应的改变在AML/MDS发病机制中起着重要作用,这为免疫治疗提供了新的选择。当前,在免疫系统调节因子中,CD47、免疫检查点和toll样受体2(
TLR2
)是AML和MDS的主要靶点。其他几种表面分子(
即CD33、CD123、CD45和CD70
)的多种抗体药物形式,包括裸抗、双特异性T细胞结合器、三特异性抗体以及ADC正在研究中,作为单一疗法或与其它药物联合使用。它们代表着AML和高风险MDS治疗的未来。
免疫系统的失调可能通过多种途径影响AML和MDS的发病机制。MDS的骨髓微环境以适应性和先天性免疫效应细胞的扰动为特征,一些细胞亚型,如1型先天性淋巴细胞(
ILC1
)减少以及其他细胞类型,如髓源性抑制细胞(
MDSC
)增加。MDSCs增强了caspase-1的危险相关分子模式刺激,其通过分泌颗粒酶B和IL-10以及通过促进toll样受体(
TLR
)、CD33和CXCR2的信号传导来促进细胞死亡。
在AML中也观察到ILC1的功能障碍。AML细胞通过多种机制改变免疫微环境,包括免疫检查点上调和人类白细胞抗原(
HLA
)I类和II类下调,从而逃避免疫监控。总之,这些证据表明,先天性和适应性免疫应答的改变在AML和MDS的发病机制中起着重要作用,这也为我们提供了潜在的免疫治疗新靶点。
免疫系统调节剂正在成为血液系统恶性肿瘤免疫治疗的主要靶点,包括
CD47
、免疫检查点和
TLR2
。
此外,
AML
和
MDS
细胞的其他表面分子目前正被用作单抗的治疗靶点,包括
CD33
、
CD123
、
CD45
和
CD70
。
CD47
CD-47是一种跨膜蛋白,其与信号调节蛋白α(
SIRPα
)的相互作用决定了对巨噬细胞介导的吞噬的抑制调节。抗CD47单抗阻断这种相互作用,从而促进巨噬细胞对肿瘤细胞的杀伤和肿瘤特异性细胞毒性T细胞的交叉启动,进而激活适应性免疫反应。
CTLA-4
CTLA-4(
CD152
),是属于免疫球蛋白超家族的T细胞受体(
TCR
)的共同受体。它在CD4+和CD8+T淋巴细胞上表达,具有抑制性免疫调节作用。CTLA-4配体是在抗原呈递细胞(
APC
)上表达的CD80(
B7-1
)和CD86(
B7-2
)。CTLA-4与其配体的结合阻断了与TCR相关的ζ链的磷酸化,并向淋巴细胞传递抑制信号。因此,阻断CTLA-4的活性增加了免疫系统识别和破坏肿瘤细胞的能力。
PD-1/PD-L1
PD-1(
CD279
),是属于Ig超家族的共抑制分子,在活化的T细胞、B细胞和髓系细胞上表达。PD-1与在肿瘤细胞和MDSC表面表达的配体PD-L1(
CD274
)的结合导致TCR介导的信号传导减弱。该途径同时调控诱导的T-reg细胞的发育、维持和功能。
TIM-3
TIM3是一种在CD4+T细胞和CD8+T细胞上表达的共抑制受体,通过与配体galectin-9相互作用,作为这些淋巴细胞群的负调节因子,触发细胞死亡。TIM-3在免疫和白血病干细胞(
LSC
)上表达,但在正常造血干细胞(
HSC
)上不表达;它与galectin-9的相互作用促进了LSC的自我更新,使其成为MDS/AML的一个有前景的靶点。
TLR-2
TLR2,也称为CD282,是Toll样受体家族的成员,在各种细胞表面表达,包括HSC和造血祖细胞(
HSPC
),并在病原体识别和先天免疫激活中发挥基本作用。TLR2的过表达导致IL-8分子途径的上调,而在MDS患者中,IL-8的分子途径常常失调。
CD33
CD33是一种唾液酸结合Ig样凝集素(
Siglec
),作为跨膜蛋白在恶性AML母细胞和MDS的MDSC表面表达,但在HSC上不表达。这些特征使CD33成为免疫治疗的理想靶点。
CD123
CD123是髓系多能干祖细胞上表达的IL-3受体(
IL-3Rα
)的α链。其与IL-3的相互作用通过JAK-2诱导细胞内酪氨酸磷酸化,促进髓系细胞的增殖和分化。IL-3Rα在AML母细胞上表达,与正常HSC相比,在白血病细胞中过表达,使其成为一个有前景的治疗靶点。
CD45
蛋白酪氨酸磷酸酶受体C型,也称为CD45,是一种跨膜蛋白,存在于几乎所有分化的造血细胞亚型。CD45是一种信号分子,调节多种细胞进程,包括细胞生长、有丝分裂细胞周期和细胞分化。CD45在AML母细胞上广泛表达,并已成为放射免疫治疗的靶点,作为异基因造血干细胞移植(
HSCT
)前调节方案的一部分,通过向白血病细胞传递细胞毒性有效载荷发挥其作用。
CD70
尽管CD70主要是一种淋巴系标志物,但它也在髓系白血病细胞中表达,在正常骨髓细胞中缺乏或低水平表达。AML干细胞中CD70及其配体CD27之间的相互作用诱导分子信号途径的激活,包括Wnt、JAK/STAT、Hedgehog和TGF-β信号,并促进细胞分裂。
目前几种单克隆抗体药物正在一线、复发/难治性(
R/R
)的AML环境中进行临床试验,这些单克隆抗体包括靶向免疫调节分子(
CD47和免疫检查点
)和其他膜抗原(
CD33、CD123、CD45和CD70
)的抗体。
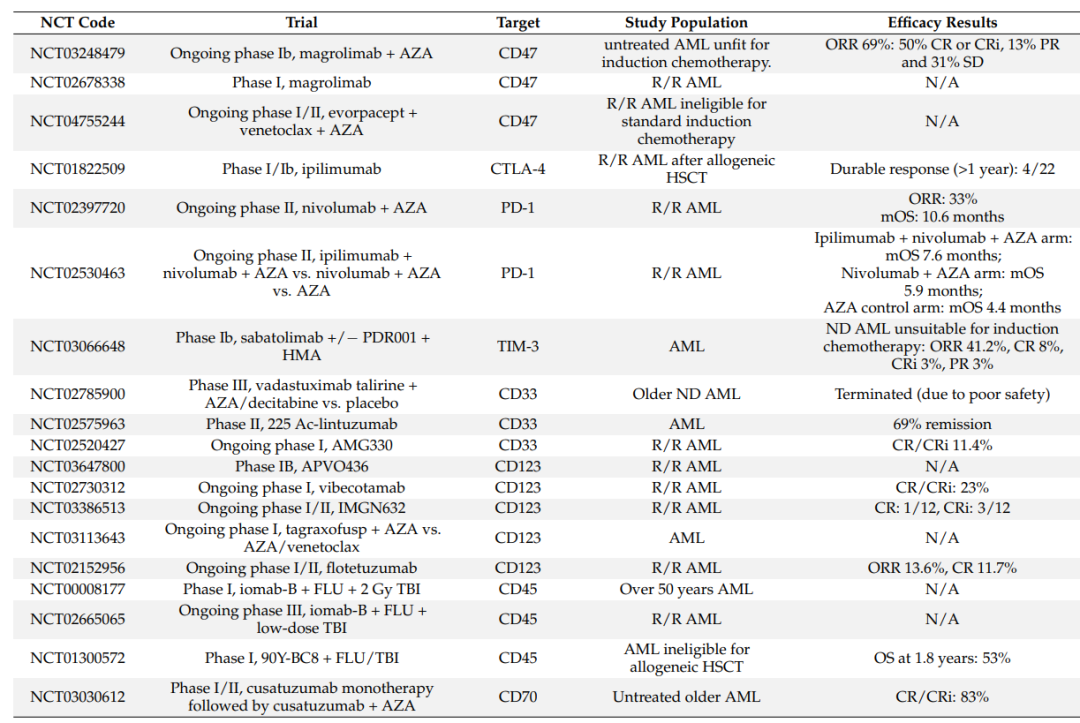
CD47
目前,靶向CD47 的magrolimab正在进行的Ib期临床试验(
NCT03248479
),包括25名不适合大剂量诱导化疗的未经治疗的AML患者。magrolimab和HMA-氮胞苷(
AZA
)的联合治疗总有效率(
ORR
)为69%,其中50%为完全缓解(
CR
)或血液学未完全恢复(
CRi
)的完全缓解。治疗相关不良事件包括贫血(
37%
)、中性粒细胞减少(
26%
)和血小板减少(
26%
)。
除了magrolimab外,其他抗CD47靶向药物也在研究中。Evorpacept(
ALX148
)是一种融合蛋白,由靶向CD47经修饰的SIRPαD1结构域组成,与IgG1 Fc片段融合。该分子目前正在进行I/II期临床试验(
NCT04755244
),与BCL2抑制剂venetoclax和AZA联合用于未治疗或不符合标准诱导化疗条件的R/R AML。
免疫检查点
目前正在研究几种免疫检查点抑制剂单独或与标准疗法联合应用于AML。I期研究的数据表明,这些单抗用作单一疗法时疗效有限,与HMAs联合使用时可能产生协同效应。一项I/IB期研究(
NCT01822509
)测试了ipilimumab在异基因HSCT后R/R
AML患者中的疗效。22例患者中有4例观察到持续响应(
>1年
)。值得注意的是,21%的患者具有免疫介导的毒性作用。
Sabatolimab(
MBG453
)是一种针对TIM-3的新型抗体,正在进行一项Ib期试验(
NCT03066648
)。在34例新诊断的不适合标准化疗或HSCT的AML患者中,ORR为41.2%,其中包括8个CR、3个CRi和3个PR。常见的≥3的治疗相关不良事件包括血小板减少症(
45.8%
)、中性粒细胞减少症(
50%
)、发热性中性粒细胞减少症(
29.2%
)、贫血(
27.1%
)和肺炎(
10.4%
)。总的来说,本研究表明TIM-3可能是一个新的有前景的治疗靶点。
CD33
2000年,FDA批准了gemtuzumab ozogamicin(
GO
),一种针对CD33的ADC,用于不适合化疗的CD33+复发AML。然而,2010年,GO因不可接受的毒性而退出,包括重大出血事件、感染和/或急性呼吸窘迫综合征。随后,ALFA-0701 III期多中心随机试验表明,如果GO以分次剂量给药,则具有足够的耐受性。因此,2017年,FDA批准了用于AML治疗的GO分级剂量。
此外,其它的靶向CD33的 ADC药物也在评估中。例如,vadastuximab-Taririne(
VT,SGN-CD33A
)正在一期试验中进行研究,以评估该药物与HMAs联合治疗先前未治疗AML的安全性和活性。
CD123
Vibecotamab(
XmAb14045
)是一种CD123XCD3的BiTEs,正在R/R
AML患者中进行一项I期研究(
NCT02730312
),结果显示其具有抗白血病活性,CR/CRi比率为23%,CRS是最常见≥3的AE。
IMGN632是一种靶向CD123的ADC,正在/R AML患者中进行I/II期研究(
NCT03386513
)。已有结果显示33%的患者有客观反应,包括1例CR和3例Cri,没有任何与治疗相关的不良事件或死亡。
靶向CD123的不同策略还包括tagraxofusp(
SL-401
),tagraxofusp是一种融合蛋白,由IL-3与截短的白喉毒素连接,使蛋白合成失活。在一项一期试验(
NCT03113643
)中评估了tagraxofusp与AZA或AZA/venetoclax联合治疗AML的疗效,初步结果显示有良好的反应(
5/9 CR,3/9 CRi
)。
CD45
Iomab-B是一种与131I偶联的抗CD45抗体,在一项I期临床试验(
NCT00008177
)中,研究了在R/R AML患者中与氟达拉滨(
FLU
)的低强度调节(
RIC
)方案和全身照射(
TBI
)方案的联合应用。这项研究表明,Iomab-B可以安全地与RIC方案联合使用,以实现老年HR AML患者的完全缓解,目前正在三期SIERRA试验(
NCT02665065
)中进行测试。
CD70
cusatuzumab(
ARGX-110
)是一种抗CD70单抗。基于临床前结果,一项I/II期试验(
NCT03030612
)评估了单剂量cusatuzumab联合AZA在未治疗的AML老年患者中的疗效。AZA诱导LSC上的CD70表达,因此与cusatuzumab联合使用时有利于体外杀伤。10名患者(
83%
)实现CR/Cri,4名患者通过流式细胞术实现MRD阴性,未报告剂量限制毒性。
目前正在对以前未治疗的R/R、HR和低风险(
LR
)MDS进行各种基于免疫疗法的临床试验。
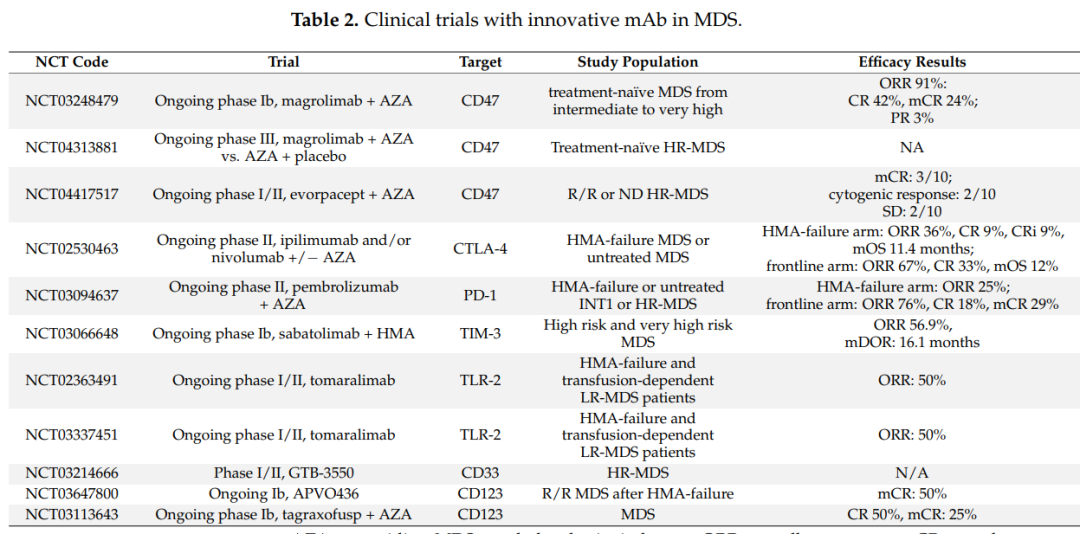
CD47
Magrolimab是治疗MDS最具创新性的药物之一。一项正在进行的Ib期研究(
NCT03248479
)报告了Magrolimab与阿扎联合治疗MDS患者的令人鼓舞的结果。总体ORR为91%,其中包括42%的CR、24%骨髓CR(其中一半还伴有血液学改善)、21%的血液学改善和3%PR。
免疫检查点
正在进行的II期研究(
NCT02530463
)分析了使用ipilimumab和/或nivolumab治疗MDS的疗效。结果显示,在HMA失败队列,ORR为36%(
9%CR,9%CR/Cri,18%HI














