作者 l MT
编辑 l 细胞房间
前言
现在常用的基因病毒载体有慢病毒载体,腺病毒载体,腺相关病毒载体(AAV,Adeno-associated virus),逆转录病毒载体,疱疹病毒载体,伪狂犬病毒载体,杆状病毒载体等。相比较其他病毒载,AAV因其以下有点成为最有选。首先是安全性高:不插入宿主基因组、不改变基因组结构、免疫原性低。同时宿主范围广、表达时程长、在体感染特异性好。再看其结构,由直径为26mm的20面体的蛋白衣壳及4.7kb的DNA组成,便于用常规的重组DNA技术进行操作。下面简单介绍AAV的结构,侵染过程、改造方法及目前临床在研产品。
1. 先从AAV的历史说起
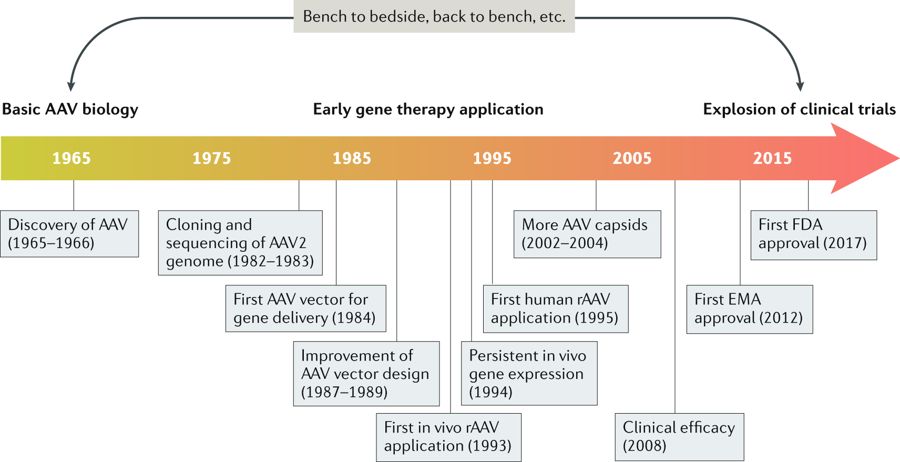
Adeno-associated virus(腺相关病毒)是在1960s年代,研究Adenovirus的科学家出于纯粹的科研好奇发现的,当初并没有想到可以作为DNA插入、替换甚至修饰的递送载体。随后的15-20年科学家对AAV2的基因组进行测序及深入研究。1984年,重组AAV(rAAV)被用于作为基因的递送载体。1955年AAV首次人体试验是治疗囊性纤维化(cystic fibrosis)患者,随后的AAV亚型被广泛研究,至2008年具有高效转染AAV在leber先天性黑朦症(Leber congenital amaurosis)。2012年首个获批的rAAV( recombinant AAV)产品Glybera(通用名alipogene tiparvovec)在欧洲上市,用于治疗脂蛋白脂肪酶缺乏症(LPLD),这是一种发病率为1/1000000的罕见病,相对应产品的不菲售价为121万美元。美国FDA没有批准上市且相应医保报销也成了问题,几年惨淡的销售使UniQure公司在2017年4月20日宣布其在10月份Glybera(AAV1)的销售许可证到期之前不再重新申请销售许可。时隔5年,FDA于2017年批准了第一个rAAV 产品 Luxturna(AAV2),用于治疗视网膜失调症,每针注射费用为42.5万美元(按双眼算共85万美元),2018年中下旬统计的销售数据为1600万美元。而且Spark公司CEO采取了于yescarda类似的赔付机制及允许分期付款的策略促进销售,按1000-2000名患者的市场估算,Luxturna具有Billion Dollar drug的潜质。
2. AAV的结构及侵染过程
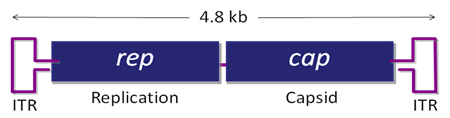
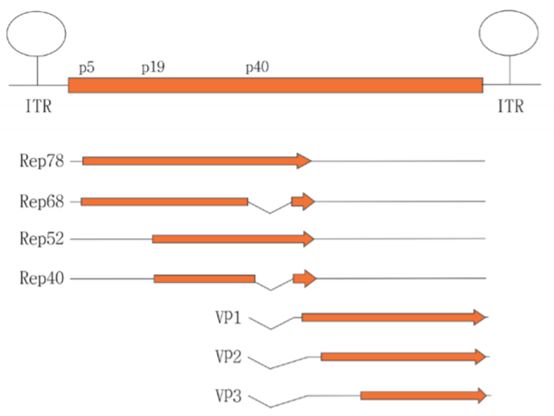
衣壳由三个亚基组成,VP1,VP2和VP3按1:1:10比例组成。基因组信息包括两端的倒转末端重复序列ITR,rep基因编码Rep78,Rep68,Rep52和Rep40,复制病毒的遗传物质的复制,cap基因编码AAP蛋白复制病毒的组装。
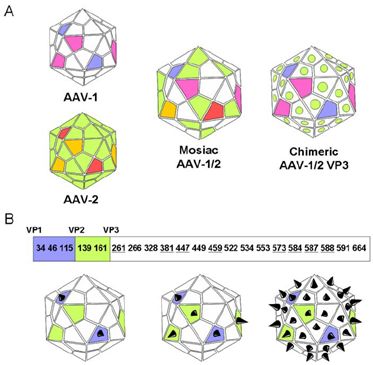
腺相关病毒(AAV)被宿主细胞表面的糖基化受体识别,通过clathrin介导的内吞进入细胞内,在pH较低的late endosome中,VP1/VP2的构象发生改变从而逃逸,部分被proteasome降解,部分在细胞核膜孔脱壳进入细胞核,AAV的遗传物质在细胞核内完成复制和转录。重组AAV类分为:单链AAV(ssAAV)和双链AAV(scAAV)。 ssAAVs包装为正有义(+)或反义(-)基因组。通过宿主细胞DNA聚合酶ssAAV的单链转化为双链DNA进行转录。scAAV本身即是双链,可以立即进行转录。存在于rAAV基因组中的病毒反向末端重复序列(ITR),可以驱动分子间或分子内重组,形成可以持续存在的环化游离基因的核心。
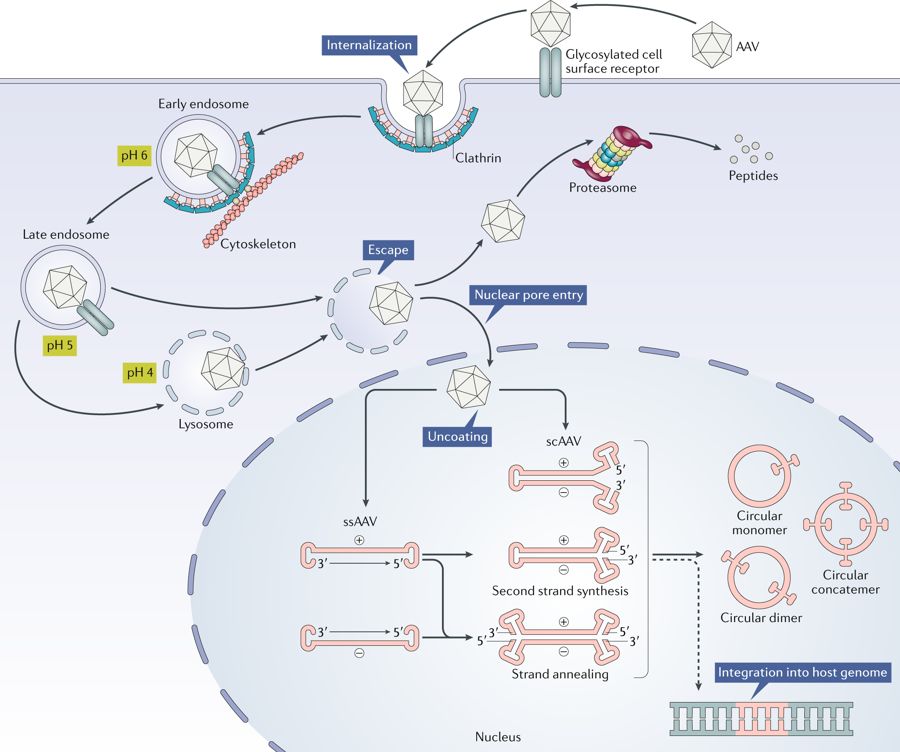
2.1 AAV的制备
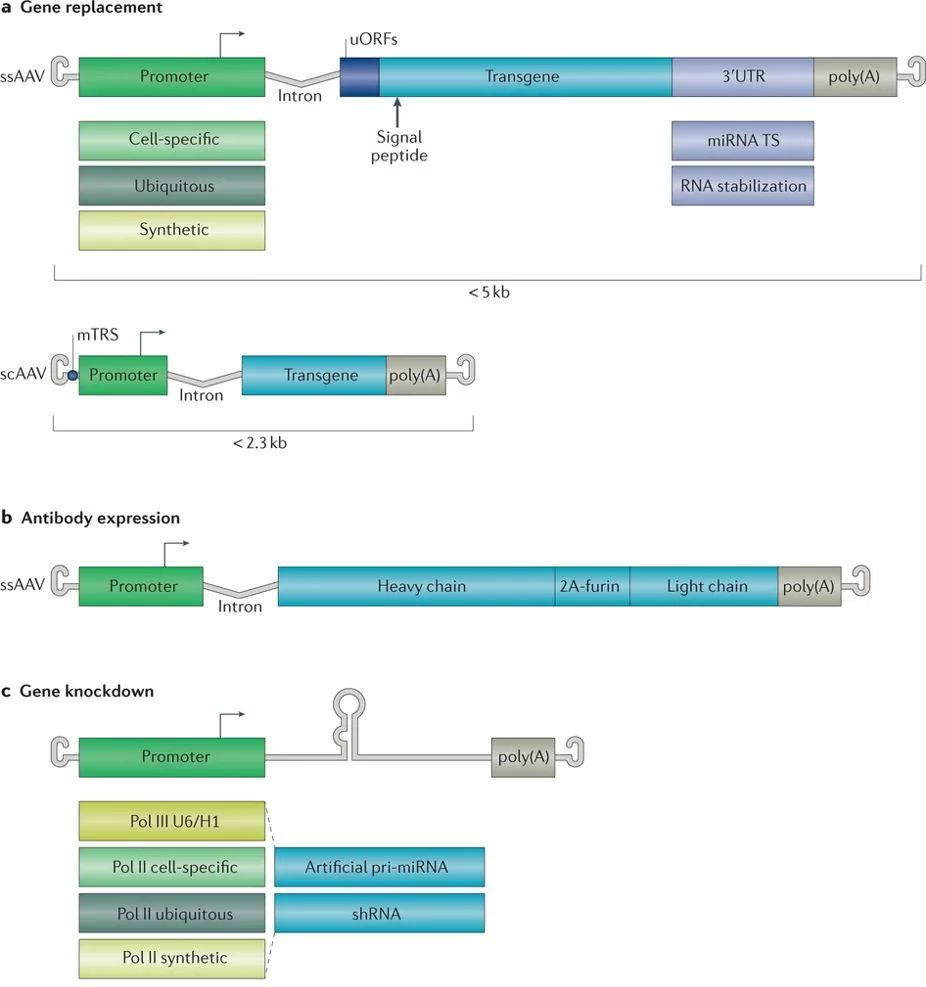
病毒而作为载体,可以携带shRNA做基因沉默(减少靶蛋白表达)、全长DNA做基因增加(针对缺乏正确蛋白)、ZFN或Cas的基因及配套元件做基因编辑。
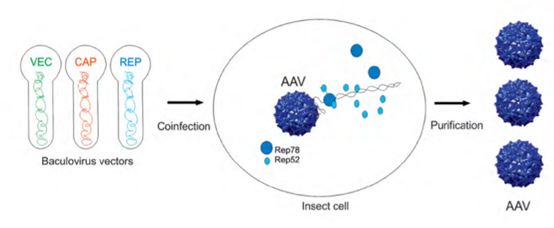
AAV的通常采用经典的三质粒共转染法(Helper-free AAV包装系统)。下图为Uniqure公司的rAAV制备流程,首先构建并纯化获得三个细菌质粒VEC,CAP和REP,其中VEC携带插入的基因,CAP和REP为构建AAV组成部分。将三个质粒共转染合适的细胞株,就能在细胞裂解液中得到携带目的基因的rAAV。这种制备方法需要制备大量高质量的载体质粒,rAAV的产量在很大程度上取决于转染的效率。
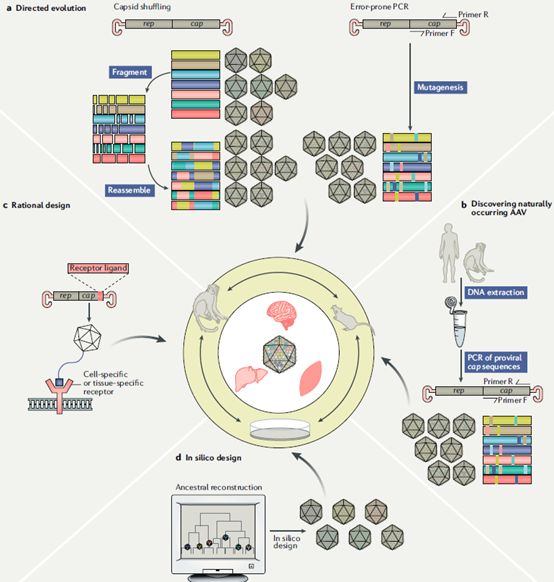
3. AAV的改造方法
3.1. 对于AAV特异性的改造方法目前有四种:
3.1.1. Natural discovery 从自然界中寻找天然的AAV
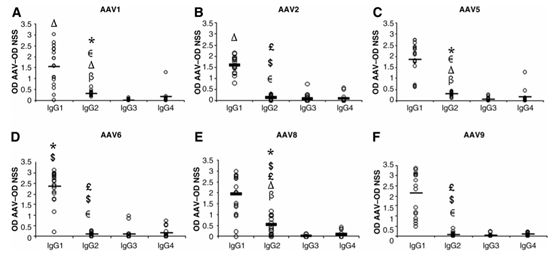
目前被广泛使用的AAV2是在被污染的细胞中发现的,而其他亚型的AAV几乎都是自然界中筛选出来的,如AAV1、AAV2、AAV3、AAV5、AAV6、AAV7、AAV8和AAV9都可以在人体中发现。这就有两个值得注意的点:1,有组织或细胞特异性的AAV,如可以穿过血脑屏障(BBB)AAV9是目前做中枢神经类疾病(CNS)的首选载体,从CD34+外周血干细胞中分离人源分型F亚型衣壳(Clade F)的AAV。2,40%-80%的AAV在体内都可以找到对应的抗体,AAV1、2、5、6、8、9对IgG不同亚型的反应相似,而在志愿者血清数据统计发现血清中存在AAV5抗体的人数最少。
3.1.2. Rational design 对AAV进行部分改造
对衣壳蛋白进行基因工程的改造,主要有两个方法,一是在衣壳蛋白上加一段多肽可以跟细胞膜表面的一些受体结合从而提高组织特异性,二是利用单链抗体片段( single chain variable fragment,scFv)或 DARPin(Design edankyrin repeat proteins,锚蛋白重复蛋白)来改造,难点会在于如何不影响三种衣壳蛋白的组装且正确的分布在衣壳外部。两个基于AAV2的改造变体,AAVi2.8可以减少对肝脏细胞的靶向而增加骨骼和心肌细胞的靶向,第一个用于临床试验的AAV2.5靶向肌肉组织。
3.1.3. Directed evolution 确定方向的进化筛选AAV
最原始的方法就是压力筛选法,给一定的环境压力让AAV产生相应的变体得到富集。进一步的版本是随机突变(error-prone PCR)产生文库用于筛选。使用多轮选择来富集衣壳,然后用基于条形码(测序)筛选富集的衣壳。但这种方法筛选的变体AAV最终还是需要用动物模型去验证,要求模型能够很好模拟AAV对人体细胞的侵染能力,比如FRG小鼠模型。
3.1.4.
In silico
discovery
随着生物信息学和计算机算力的提高,体外模拟突变体造成的蛋白二级、三级折叠至四级组装以寻找新型AAV变体。
3.2,提高AAV蛋白质的表达量
3.2.1. 强启动子,加入CMV,chicken β-actin promoter加CMV enhancer;
3.2.2. 加入促进基因表达的内含子和转录后调控因子(WPRE);
3.2.3. 使用翻译效率更好的密码子Kozak系统;
3.3.4. 增加小RNA的表达,使用U6 small nuclear RNApromoter和H1 promoter等。但是一味的追求蛋白质和RNA的高表达对于宿主细胞来说也会是一种毒性。
3.4. AAV的携载长度
AAV的携载量一般只能带不超过4.7kb外源基因,这还包括了promoter的长度。不适合大片段基因的导入。比如DMD(杜氏肌营养不良症)涉及的DMD编码区为11.5kb,超过了AAV的携载量,这里就需要在理解蛋白结构的基础上选择重要的片段做成micro-gene therapy。另外一种用的比较多的是将全长片段分成两半,各由一个AAV携带,进入宿主细胞之后,携带的两个基因再通过可变剪切进行拼接从而翻译为完整的蛋白质。
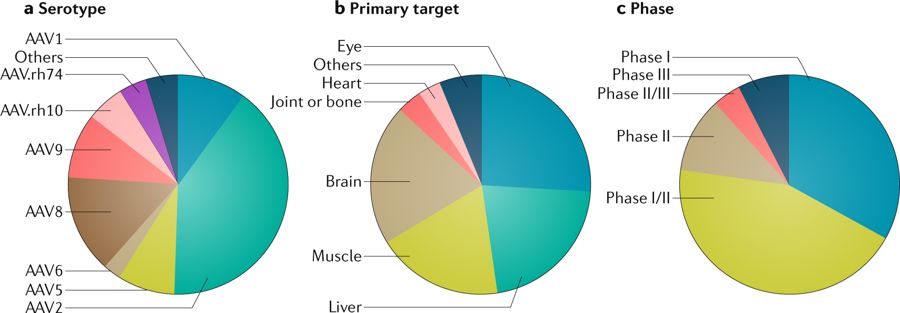
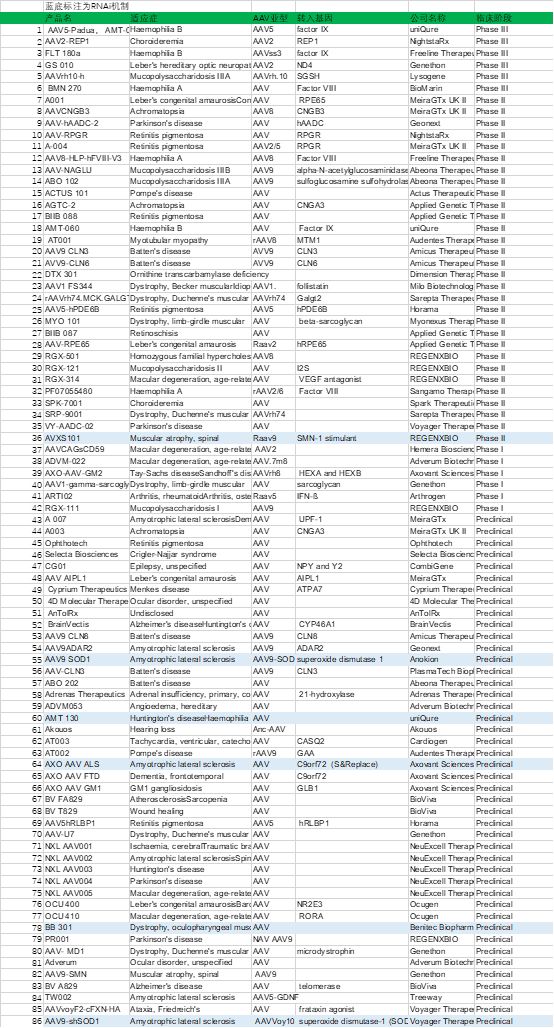
4. 在研临床AAV项目
除了以上AAV的研发改造外,进入临床需要考虑的还有大规模标准化生产成本、载体控制和质检标准和免疫屏障等因素。不仅是对科研界、药企,甚至是药物审评机构也会是一个挑战。
参考文献
1. Wang D, Tai P W L, Gao G. Adeno-associated virus vector as a platform for gene therapy delivery[J]. Nature Reviews Drug Discovery, 2019: 1.
2. Deverman B E, Ravina B M, Bankiewicz K S, et al. Gene therapy for neurological disorders: progress and prospects[J]. Nature Reviews Drug Discovery, 2018, 17(9): 641.
3. Gray S J, Kalburgi S N, McCown T J, et al. Global CNS gene delivery and evasion of anti-AAV-neutralizing antibodies by intrathecal AAV administration in non-human primates[J]. Gene therapy, 2013, 20(4): 450.
欢迎加入小编团队成为小编一员
请加小编微信号:wuwenjun7237
如有技术解读、行业洞见愿意分享
欢迎投稿到小编邮箱:
[email protected]















