2018年2月16日,美国FDA正式批准阿斯利康公司的抗PD-L1单抗Imfinzi(durvalumab)用于不可手术切除的III期NSCLC放化疗后未进展的患者。值得一提的是,Imfinzi是近二十年首款获批用于降低III期不可切除NSCLC疾病进展风险的疗法,也是唯一获批治疗该人群的免疫检查点抑制剂,标志着免疫治疗从晚期肺癌患者向更早期患者迈进。
美国FDA药物评估和研究中心血液学和肿瘤学产品办公室代理主任兼FDA肿瘤卓越中心主任Richard Pazdur博士评论道:“目前对于不可手术切除的III期NSCLC,标准的治疗方案是放化疗,虽然有一小部分患者可以通过放化疗得到治愈,但大多数患者最终会出现疾病进展。Imfinzi获批用于接受了放化疗后尚未进展的III期NSCLC,可以帮助患者显著延长疾病无进展时间(PFS 16.8月),降低疾病进展风险。
肺癌是美国目前死亡率最高的肿瘤。据美国国立癌症中心统计,2017年新发肺癌患者222,500例,死亡患者155,870例。NSCLC是最常见的肺癌类型,约占所有肺癌患者的85-90%。在NSCLC中,约1/3患者诊断时是III期,其中绝大多数是无法手术切除的III期。Imfinzi作用于PD-1/PD-L1信号通路,通过阻断免疫抑制信号的传递,恢复T细胞的抗肿瘤活性,增强内源性抗肿瘤免疫效应。2017年,Imfinzi已获得FDA加速批准用于局部晚期或转移性尿路上皮癌。
本次FDA批准阿斯利康公司的Imfinzi用于不可切除的III期NSCLC是基于一项III期临床研究PACIFIC。PACIFIC是一个随机、双盲、安慰剂对照的III期研究,入组713例不可手术切除的III期NSCLC同步放化疗后未进展的患者,随机分组进行Imfinzi或安慰剂治疗。在2017年ESMO大会上,PACIFIC研究结果作为LBA重磅公布,与安慰剂组相比,Imfinzi显著延长PFS超过11个月(16.8个月 vs 5.6个月;HR=0.52;95%CI:0.42-0.65)。Imfinzi是第一个在III期NSCLC患者带来PFS显著获益的免疫检查点抑制剂。目前,总生存数据尚未成熟,研究者将继续随访入组患者,向FDA提交总生存数据。基于PACIFIC研究良好数据,Imfinzi在治疗III期不可手术切除NSCLC肺癌方面曾获得FDA突破性疗法认定和优先审评资格。
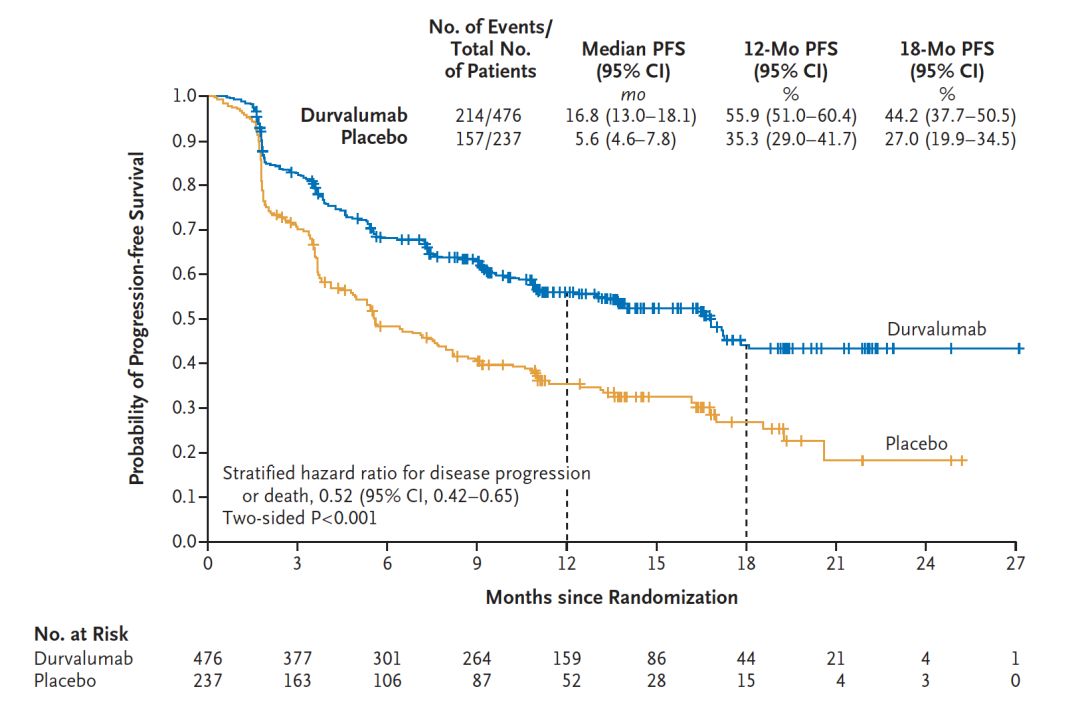
图:PACIFIC研究主要终点:两组PFS对比
在PACIFIC研究中, Imfinzi用于III期不可手术切除的NSCLC最常见的不良反应包括咳嗽,疲劳,肺炎/放射性肺炎,上呼吸道感染,气促和皮疹,3级以上肺炎发生率为3.4%(安慰剂组为2.6%) , 安全性和患者生活质量良好。
1.https://www.fda.gov/NewsEvents/Newsroom/PressAnnouncements/ucm597217.htm
2.ESMO 2017 Abstract Book. PACIFIC: A double-blind, placebo-controlled Phase III study of durvalumab after chemoradiation therapy (CRT) in patients with Stage III, locally advanced, unresectable NSCLC.
3.WCLC 2017 Abstract Book. Patient-Reported Outcomes With Durvalumab After Chemoradiation in Locally Advanced,Unresectable NSCLC:Data From PACIFIC.
4. Antonia SJ.,et al. Durvalumab after chemoradiotherapy in stage III non-small-cell lung cancer. N Engl J Med. 2017; 377(20):1919-1929.
版权属肿瘤资讯所有。欢迎个人转发分享,其他任何媒体、网站如需转载或引用本网版权所有内容,须获得授权,且在醒目位置处注明“转自:良医汇-肿瘤医生APP”。28个肿瘤相关临床试验招募患者
点击下方图片即可查看详情















