

摘 要:
传统中药矿物药三氧化二砷具有显著的治疗作用,已被美国食品药品监督管理局(
FDA
)批准用于治疗急性早幼粒细胞白血病,近年来还发现其具有良好的治疗实体瘤的效果。其抗肿瘤机制主要包括促进细胞凋亡、抑制
Hedgehog
信号通路、逆转耐药性以及抑制血管生成等。然而三氧化二砷的体内靶向性较差、肾脏清除速率快、以及高剂量对正常组织的不良反应,限制了其对实体瘤的治疗应用与临床转化。新型药物递送系统在传统纳米制剂的基础上,提高了药物在肿瘤部位的聚集、控制释放以及诊断等能力,在精准治疗、提高生物利用度和降低毒副作用等方面具有重要意义。对三氧化二砷的抗肿瘤机制及抗肿瘤新型药物递送系统的研究进展进行总结和分析,以期为三氧化二砷抗肿瘤的深入研究和临床应用提供思路。
三氧化二砷分子式为
As
2
O
3
,是传统中药矿物药砒霜的主要成分,从明代《本草纲目》中记载用于“蚀痈疽败肉”,到
20
世纪
70
年代开始被研究用于急性早幼粒细胞白血病(
acutepromyelocytic leukemia
,
APL
)的治疗,并于
2000
年被美国食品药品监督管理局(
FDA
)批准为治疗
APL
的一线药
收稿日期:
2020-06-04
基金项目:
国家自然科学基金资助项目(
81903557
);国家自然科学基金资助项目(
82074024
);江苏省自然科学基金资助项目(
BK20190802
);江苏省高等学校自然科学研究项目(
19KJB350003
);江苏省科协青年科技人才托举工程资助项目;南京中医药大学自然科学基金青年项目(
NZY81903557
)
作者简介:
黄剑宇,硕士,从事中药新剂型与新技术。
E-mail: [email protected]
*
通信作者
王若宁,博士,讲师,从事中药新剂型与新技术。
Tel: 15852937869 E-mail:[email protected]
狄留庆,教授,博士生导师,从事中药新剂型与新技术。
Tel: (025)85811230 E-mail:diliuqing@ njucm.edu.cn
物沿用至今。随着三氧化二砷在
APL
治疗中的应用,研究也发现三氧化二砷在治疗乳腺癌、肝癌和神经胶质瘤等实体瘤方面也具有良好的活性
[1-3]
,通过促进肿瘤细胞的凋亡、抑制
Hedgehog
(
Hh
)信号通路以及抑制血管新生等多种机制抑制实体瘤的生长,并且有正在进行的三氧化二砷用于治疗多种实体瘤的临床试验
[4-5]
。
由于三氧化二砷为水溶性无机盐,在体内的靶向性较低,广泛分布于血液及各种脏器组织
[6]
;肾脏清除快速,使得其半衰期较短
[7]
,因而往往需要使用更高剂量的三氧化二砷来达到治疗效果。然而
高剂量使用三氧化二砷随之带来的严重的心脏毒性
[8]
以及生物分布差异导致对正常组织的严重不良反应,限制了三氧化二砷的治疗应用。
药物递送系统可以采用多学科的手段使药物具备主动或被动靶向的能力,将药物有效递送至目标部位;根据肿瘤部位的微环境特征设计特异性响应释放的递送系统,可减少药物因非特异性细胞及生物分布或体内快速代谢引起的药效减弱,从而实现增强药物的药效、改善靶向性、生物识别功能以及代谢动力学特征,减轻药物降解及不良反应的目的。通过构建功能性的药物递送系统能够改善三氧化二砷靶向性低、半衰期短以及全身不良反应的问题。本文综述了三氧化二砷的抗肿瘤机制以及应用于实体瘤的药物递送系统的研究,以期为三氧化二砷的深入研究和应用提供参考。
1
抗肿瘤作用机制
1.1
促进细胞凋亡
细胞凋亡是机体内一种有序的细胞自我消亡的生理机制,以消除损伤、衰老与突变的细胞,在维持机体自身的稳态平衡中发挥重要作用。细胞凋亡的异常减少是肿瘤发生的重要原因
[9]
。研究发现,三氧化二砷具有显著的促进肿瘤细胞凋亡的作用,主要通过调节
Bcl-2
族蛋白中促凋亡蛋白与抑凋亡蛋白的比例和增强半胱氨酸天冬氨酸蛋白水解酶
Caspase
家族的活性两种方式来实现
[1,10-15]
。
Sadaf
等
[1]
发现三氧化二砷诱导肝癌
Hep3B
细胞的凋亡,利用蛋白免疫印迹实验证明三氧化二砷对抗凋亡蛋白
Bcl-xL
表达水平有时间相关性和剂量相关性的下调作用。
Sun
等
[10]
对大鼠脑胶质瘤
C6
和
9L
细胞进行三氧化二砷处理,发现
5 μmol/L
三氧化二砷即有显著促进细胞凋亡的作用,这一作用与细胞中时间相关性活性氧(
ROS
)的产生有关。此外研究还发现三氧化二砷抑制了抗凋亡因子
Bcl-2
的表达,并上调了凋亡因子
Bax
的表达,从而改变
Bax/Bcl-2
的比例,有利于肿瘤细胞的凋亡。
Xia
等
[11]
发现三氧化二砷可能是缺口受体
Notch-1
的抑制剂,抑制了
3
种乳腺癌细胞
MDA-MB-231
、
MCF-7
和
SKBR-3
中
Notch-1
的表达,从而导致乳腺癌细胞的生长抑制并诱导凋亡。进一步的研究发现
Notch-1
的失活导致
2
种下游基因
Bcl-2
和
NF-κB
的表达下降,进而抑制了乳腺癌细胞的侵袭。
Eguchi
等
[12]
则研究发现三氧化二砷可以通过激活氨基末端激酶
JNK1
与
JNK2
磷酸化,以及激活
caspase-3
并调控
JNK1
的细胞外信号调节激酶
ERK1/2
两种方式导致人间皮瘤
NCI-H2052
细胞凋亡。进一步研究发现,三氧化二砷诱导的
ERK1/2
磷酸化取决于
JNK1
蛋白的存在,而不取决于
JNK2
蛋白和磷酸化的
JNK1/2
,说明三氧化二砷主要通过
JNK1/2
激活诱导人恶性胸膜间皮瘤
NCI-H2052
细胞凋亡,而
JNK1/2
失活时,
ERK1/2
参与三氧化二
砷诱导的人间皮瘤细胞凋亡。
Survivin
蛋白可与
Zn
2
+
离子配位形成锌指结构,直接作用于细胞凋亡效应分子
caspases
[13]
。
Chiu
等
[14]
对三氧化二砷研究发现其可通过抑制
PI3K/Akt
和激活
MAPK
信号通路下调
survivin
,诱导脑胶质瘤
U118
细胞的体外自噬及凋亡,并抑制体内肿瘤生长和肿瘤组织中
survivin
的表达。
Wang
等
[15]
研究发现三氧化二砷可以抑制胶质瘤
U87
细胞的增殖,通过下调凋亡相关因子
Fas
、
FasL
和
Bax
及凋亡相关蛋白
p53
,增强
caspase-3
和
caspase-9
的表达诱导胶质瘤细胞的凋亡。
1.2
抑制
Hh
信号通路
Hh
信号通路在胚胎发育过程中起重要作用,在正常人体组织中无活性或低活性。其异常激活已被证明与
Hh
通路中蛋白
Ptch-1
的失活、
smooth
或
GLI
的激活相关
[16]
,进而导致一些如肺癌
[17]
、横纹肌肉
瘤
[18]
、骨肉瘤、胶质瘤
[19]
和乳腺癌等实体瘤的发生
[20]
。
三氧化二砷与巯基的高度结合特性,使其具备与
Hh
信号通路上的锌指形结构蛋白
GLI
特异性结合的能力,阻断
Hh
信号通路,进而抑制肿瘤的活性。
有学者等通过免疫印记检测相关蛋白表达发现,三氧化二砷对于
Hh
通路的核心蛋白
GLI2
蛋白的表达具有显著抑制作用。通过
PCR
检测发现,三氧化二砷处理人类慢性粒细胞白血病
K562
细胞后,一方面
GLI1
与
GLI2
的
mRNA
扩增均受到显著的抑制作用,抑制作用呈现浓度相关性;另一方面
Hh
通路的抑制因子
Ptch
的
mRNA
表达的水平随之增高,显示三氧化二砷还可能通过上调抑制因子
Ptch
从而抑制
Hh/GLI
通路
[21]
。
Meister
等
[22]
使用三氧化二砷处理横纹肌肉瘤
RMS
细胞,发现三氧化二砷对
RMS
细胞有显著的抑制生存期的作用,通过降低
Hh
通路上
GLI1
、
GLI2
、
Ptch
、
GAS1
靶基因的表达,从而抑制
GLI1
转录活性,进而抑制
Hh/GLI
和
Hh/Ptch
通路。
Beauchamp
等
[23]
发现,三氧化二砷直接与
GLI1
蛋白结合,抑制其转录活性,从而降低内源性
GLI
靶基因的表达。与此结果一致的是,三氧化二砷还在体内抑制了依赖于
GLI
上调的尤文氏肉瘤异种移植模型的肿瘤生长,在激活
Hh
通路信号的情况下提高了与临床相关的自发性成神经管细胞瘤小鼠的存活率。最终结果证明三氧化二砷是一种在体外和体内均能作用于
GLI1
水平的
Hh
通路抑制剂。
1.3
逆转肿瘤耐药性
肿瘤在接受某些化疗药物治疗后对该药物本身或其他未接触过的药物易产生耐药性,使细胞凋亡敏感性降低、细胞存活信号通路的异常活化、药物外排泵
ABC
转运蛋白促进药物外排等,是导致肿瘤化疗失败的主要原因。
在复发性肝癌的治疗过程中,耐药性肝癌
MDR-HCC
细胞应对高氧化应激条件采用适应性
14-3-3η/NF-κB
反馈环使其存活,导致化疗效果减弱。
Qiu
等
[24]
研究发现,三氧化二砷可作为
NF-κB
的抑制剂,抑制
14-3-3η mRNA
的转录水平。此外,三氧化二砷还被证实可以直接结合
14-3-3η
,并以泛素化相关性的方式增强
14-3-3η
蛋白的降解,阻断
14-3-3η/NF-κB
反馈环,从而逆转
MDR-HCC
细胞的耐药性。
Ghanbari
等
[25]
研究探讨了
GLI
抑制剂福司可林、
GANT-61
和三氧化二砷对胰腺癌
PANC-1
细胞上皮
-
间充质转化(
epithelial-to-mesenchymal transition
,
EMT
)耐药的抑制作用。通过定量
RT-PCR
检测
EMT
因子
mRNA
表达水平,评估
GLI
抑制剂的效果。结果显示,福司可林对
PANC-1
细胞的耐药性影响不大,
GANT-61
能降低该细胞系对
ETB
的耐药,而三氧化二砷更为有效。
Feng
等
[26]
研究发现,三氧化二砷与阿霉素(
doxorubicin
,
DOX
)联合治疗能明显抑制耐
DOX
的骨肉瘤
MG63/dox
细胞的增殖,诱导
G
2
/M
期细胞周期阻滞,增加
MG63/dox
细胞凋亡。进一步的研究发现,三氧化二砷通过下调
MG63/dox
细胞中
stathmin
的表达,显著逆转了
MG63/dox
对
DOX
的耐药性。
1.4
其他抗肿瘤机制
肿瘤细胞的快速增殖使得肿瘤部位的血管异常生成,以满足肿瘤细胞所需的大量营养物质与氧气的输送,抑制肿瘤部位新生血管的生成,也可以在一定程度上实现“饿死肿瘤”的目的。
Jiang
等
[27]
研究表明三氧化二砷通过对肝癌
MHCC97H
和
MHCC97L
细胞中
microRNA-491
介导的
TGF-b/ SMAD3/NF-kB
信号通路的抑制作用减弱了血管生成能力。发现三氧化二砷通过
DNA
脱甲基作用改善
miR-491
的表达,从而降低
SMAD3
的表达与功能,致使
NF-kB/IL-6/STAT-3
信号转导失活,进而抑制
VEGF
分泌以减少新生血管的生成。
Jiang
等
[28]
研究发现,三氧化二砷抑制了
VEGF
的表达与分泌,并减弱了乳腺癌
TNBC
细胞的血管生成能力。进一步研究发现三氧化二砷通过抑制
zeste
同源物
EZH2
增强子与
p65
的相互作用,下调
NF-κB
的活性,从而抑制
TNBC
的血管生成。
2
药物递送系统研究
2.1
被动靶向的递送系统
被动靶向的药物递送系统是指根据增强渗透性和保留(
enhanced permeability and retention effect, EPR
)效应而设计的载体,使药物被动富集于肿瘤部位。聚乙二醇(
polyethyleneglycol
,
PEG
)具有亲水特性,可以吸附大量的水分子,在纳米粒的表面形成一层水分子的空间位阻,减少体内巨噬细胞对纳米粒的吞噬,从而延长递送系统在血液循环系统中的时间。利用
PEG
修饰的聚乳酸乙醇酸共聚物(
PEG-PLGA
)制备的“隐形纳米粒”
As
2
O
3
-PEG-PLGA
,与
As
2
O
3
注射剂相比,分布相半衰期和消除相半衰期分别提升
3.86
、
3.09
倍,具有缓释及延长半衰期的作用
[29]
。
2.2
主动靶向的递送系统
主动靶向的药物递送系统主要是利用肿瘤部位一些特异性或高表达的生物标记物进行靶向,从而被指定的细胞所识别摄取。递药系统表面修饰特定的配体,如蛋白、抗体、多肽或化学小分子等,这些配体能够与细胞膜表面高表达的如转铁蛋白受体、叶酸受体、葡萄糖转运体等受体或抗原等特异性结合,触发细胞内吞,从而实现将药物递送系统靶向递送至特定细胞的目的
[30]
。已有学者研究通过抗体、多肽以及适配体等靶头修饰,从而实现三氧化二砷的肿瘤主动靶向递送,见图
1
。
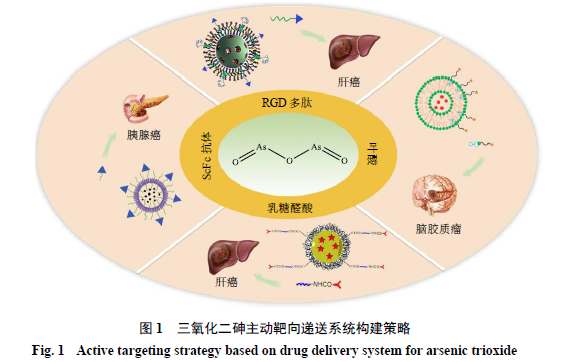
2.2.1
糖蛋白受体介导的递送系统
在跨膜糖蛋
白家族中,
CD44
是透明质酸的主要细胞表面受体,其中变异体
6
(
CD44v6
)被报道主要在胰腺癌细胞中过度表达,直接参与肿瘤的发生、转移和进展
[31]
,是介导抗
CD44v
修饰靶向传递的理想抗原。
Qian
等
[32]
通过双重乳液溶剂蒸发法将三氧化二砷负载于
mal-PEG-PLGA
微囊中,后将
scFvCD44v6
抗体结合修饰于
PLGA
微囊表面,形成
scFv-As-NPs
,可在体外与过表达
CD44v6
的胰腺癌细胞
PANC-1
特异性结合,显示出比非靶向的三氧化二砷更高的细胞活性抑制能力。体内实验表明
scFv-As-NPs
可增强体内胰腺癌肿瘤模型的肿瘤蓄积,并显著降低三氧化二砷对正常器官的毒性。
Song
等
[33]
利用含有一个半乳糖单位的乳糖醛酸(
lactobionic acid
,
LA
)特异性靶向识别肝细胞的亚洲糖蛋白受体(
asialoglycoprotein receptor
,
ASGPR
),使用双重乳液溶剂蒸发法将三氧化二砷包载于
PLGA
内,通过氨基和羧基的化学共价偶联将
LA
和
PEG
修饰到
NPs
上制备了
PEG
和
LA
表面修饰的
As
2
O
3
@PLGA-PEG/LA-NPs
。经
PEG
和
LA
表面改性后,
As
2
O
3
@PLGA-PEG/LA-NPs
的生物相容性得到改善,修饰后三氧化二砷的体内外抗肝癌疗效有所提高。
2.2.2
多肽介导的递送系统
精氨酸
-
甘氨酸
-
天冬氨酸(
RGD
)是显示在许多细胞外基质上的细胞黏附序列,可与肿瘤细胞新生血管和神经母细胞瘤、黑色素瘤、肺癌、乳腺癌等多种肿瘤内皮细胞上高表达的
αvβ3
整合素受体结合,参与抑制肿瘤迁移、肿瘤血管生成,以及实现肿瘤识别
[34]
。
Fei
等
[35]
将三氧化二砷负载于表面具有氨基的修饰有二甲基十八烷基氯化硅烷的中空介孔二氧化硅(
NH
2
- CHMSN
)中,再以薄膜水化法制备得
RGD
修饰的复合脂质体
RGD-LP-CHMSN-
三氧化二砷。经
CHMSN
负载后,三氧化二砷的控释能力得到显著提升,
RGD
的修饰使得三氧化二砷在体内肝脏肿瘤中特异性分布,提高了体内外抗肿瘤作用。有研究利用第
5
代聚酰胺
-
胺树状大分子(
PAMAM dendrimers
)内部空腔及表面携带的正电荷氨基与三氧化二砷在水溶液中的亚砷酸离子形式反应结合,实现负载三氧化二砷的目的。通过马来酰胺键将
RGDyC
与
PAMAM
结合,后再以
PEG
3000
进行修饰获得
RGDyC-mPEG-PAMAM
。研究结果显示,经
RGDyC
和
PEG
共修饰后的
PAMAM
不仅具有较小的粒径
[
(
21.6
±
6.81
)
nm]
,还可以负载三氧化二砷体外跨越血脑屏障,增加肿瘤细胞对其摄取
[36]
。
2.2.3
叶酸介导的递送系统
叶酸受体(
folate receptor
,
FR
)是一种广泛过表达于肿瘤细胞膜表面的糖蛋白,且在正常器官中几乎不表达。天然配体叶酸(
folic acid
,
Fa
)具有无毒、相对分子质量小、易于修饰、生物相容性好、价廉易得等优点,可与
FR
特异性识别结合,后通过内吞作用进入细胞
[37]
。将
Fa
上的羟基与药物或药物载体结合形成
Fa
复合物后,细胞膜表面的
FR
仍对其具有高度的亲和性。利用
Fa
结合修饰的递药系统在与肿瘤细胞表面的
FR
识别结合后,细胞膜内陷将其形成细胞内小泡内吞入胞,在内涵体的酸性环境(
pH4.5
~
5.5
)中解离脱落
Fa
,将药物释放于细胞质内,实现靶向杀伤肿瘤细胞的目的
[38]
。
Chen
等
[39]
通过薄膜水化法制备脂质体负载
Ni
(
HAsO
3
)固体纳米颗粒,并利用
PEG
3350
修饰的二硬脂酰基磷脂酰乙醇胺(
1,2-distearoyl-sn-glycero-3-phosphoethanolamine
,
DPSE
)
DPSE-PEG
3350
缀合
Fa
修饰获得脂质体
f-Lip
(
Ni
,
As
),发现叶酸靶向的砷脂质体具有高效的肿瘤细胞摄取及抗肿瘤活性,其中共包埋的过渡金属
Ni
2
+
有利于三氧化二砷在脂质体中的稳定,并能利用细胞摄取过程中
pH
变化触发三氧化二砷的释放。
2.3
物理化学靶向的递送系统
基于纳米技术的靶向给药已在临床前动物模型中显示出良好的效果。然而,依赖于
EPR
效应以及配体识别设计的递送系统在临床应用时仍存在问题,这可能是配体
-
受体相互作用的随机性以及控制靶向纳米载体释放药物存在一定困难的结果
[40-41]
。因而,根据肿瘤部位的微环境进行药物递送系统的设计以模拟生物响应性,实现药物的按需响应释放,有利于肿瘤的精准治疗,这类递送系统可响应于特定的物理或化学条件而释放药物,故也被称为物理化学靶向的递送系统。已有的关于三氧化二砷的物理化学靶向递送系统研究主要依赖肿瘤微环境响应的化学内源性刺激(
pH
、氧化还原梯度变化或无机磷浓度差异)和外源性物理刺激(磁响应和温度响应)实现。
2.3.1
肿瘤微环境响应型递送系统
肿瘤微环境是肿瘤在发生发展过程中形成的一种利于肿瘤的生态环境,表现出与正常组织显著不同的生物学特征:缺氧、酸中毒、高间质压、特异性酶或受体的高表达等
[42]
,这些特异性的肿瘤微环境为肿瘤的精确治疗提供了更多的机会。
(
1
)
pH
响应的递送系统:
与正常组织的
pH
值(
7.2
~
7.4
)相比,实体瘤的
pH
值为
5.7
~
7.8
,而在亚细胞水平,如晚期内涵体和溶酶体则呈现更强的酸性环境,其
pH
值则为
4.5
~
5.5
[43]
。这主要是由于肿瘤的快速生长、新生血管生成导致肿瘤内营养和氧气匮乏,使得代谢向糖酵解转移,从而导致肿瘤间质中产生酸性代谢物
[44]
。利用这些不同组织间
pH
差异构建
pH
敏感的药物递送系统,可以有效的实现酸性肿瘤微环境的响应靶向与释放。
Ettlinger
等
[45]
合成了锌基金属有机骨架
ZIF‐8
,通过合成后的配体交换将三氧化二砷引入中性结构,并以氨基官能化的
PEG
修饰表面制备了
PEG‐NH
2
@As@ ZIF-8
。
ZIF-8 NPs
显示出每
1 mg
载体
74 μg As
的高负载量,纳米载体在酸性条件下分解的特性使得在正常组织和血液的
pH
下释放少量的
As
,在肿瘤组织酸性
pH
下释放完全。
Zhang
等
[46]
通过反相微乳法开发了一种低
pH
插入肽(
pH-low peptide
,
pHLP
)修饰的递药系统
MnAs@SiO
2
-pHLIP
,借助
pHLIP
的包被,递药系统可靶向酸性肿瘤微环境。体外实验表明
MnAs@SiO
2
-pHLIP
对多种癌细胞系具有很强的靶向性和细胞毒性,体内实验进一步表明,
pHLIP
还可以显著延长三氧化二砷的循环时间,在酸性环境中实现三氧化二砷的可控释放,此外还可以通过
MRI
激活
Mn
2
+
的
T1
信号的强化,实现实时监测。与三氧化二砷相比,
MnAs@SiO
2
-pHLIP NPs
在体内外实验中均表现出更高的肿瘤靶向性和抗肿瘤疗效,对正常组织的毒性更小。
Zhao
等
[47]
利用金属元素
Mn
2
+
与
HAsO
3
2
-
反应成盐沉淀的特性,使用离子梯度加载法成功将
Mn
2
+
和三氧化二砷的水合形式(
HAsO
3
2
-
)形成
Mn-As
络合物沉淀,共同负
载进合成的纳米中空介孔
SiO
2
中,制备了
MnAsOx@
SiO
2
。制备的
MnAsOx@SiO
2
还具有在低
pH
(
pH 5.4
)条件下缓慢释放的特点,具有顺磁性
T1
造影剂
Mn
2
+
的加入使得
MnAsOx@SiO
2
具有磁共振成像的能力,可准确诊断肿瘤的位置,实时监测三氧化二砷药物的传递和释放,并提供有效的体内抗肝癌的治疗。
(
2
)
氧化还原响应的递送系统:肿瘤组织中普遍存在的乏氧环境使得肿瘤细胞内部的还原型谷胱甘肽(
GSH
)浓度(
2
~
10 mmol/L
)较高,约是正常细胞内
GSH
浓度的
4
倍,更远高于细胞外生理环境中的
GSH
浓度(
2
~
10 μmol/L
)
[48]
。纳米载体中的
As-S
键或二硫键具有还原敏感性,在进入肿瘤细胞后可被高浓度的
GSH
还原为巯基断裂,促使载体结构变化释放负载药物,从而实现肿瘤的选择性响应释放。
Zhang
等
[49]
合成了一种巯基结合于疏水性嵌段的共聚物
PEO-b-P(CCLC6-SH)
,利用
As
3
+
对巯基具高亲和力的特点,将三价砷的氧化物氧化苯胂(
phenylarsineoxide
,
PAO
)与共聚物中巯基结合包封于共聚物内。该共聚物在
As-S
键的作用下将
As
的包封能力提高了
15
倍,具有良好的结构稳定性,并且可以在肿瘤的高浓度
GSH
条件下响应释放药物,与未包封的
PAO
具有相当的体外杀伤人乳腺癌
MDA-MB-435
细胞的活性。一种负载三氧化二砷的氧化还原响应性递药系统
MSN-SS-PEG@As
2
O
3
,以
MSN
为载体,通过二硫键修饰表面后再经酰化反应连接
PEG
,最后通过静电吸附作用负载三氧化二砷。体外释放研究发现
MSN-SS- PEG@As
2
O
3
在含有
10 mmol/L GSH
的释放介质中三氧化二砷累积释放量达到
81%
,远高于不含
GSH
介质中的释放量,具有
GSH
响应性释放特性。体外毒性实验显示
MSN-SS-PEG@As
2
O
3
的半数抑制浓度(
IC
50
)值为(
7.64
±
0.35
)
μmol/L
,显著低于三氧化二砷(
P
<
0.01
),增强了体外抗肿瘤效果
[50]
。
(
3
)
无机磷触发的递送系统:镧系离子与三价砷结合产生沉淀的能力比过渡金属离子更高,另一方面,对于镧系元素钆离子
Gd
2
+
,其磷酸盐与相应的砷酸磷酸化合物相比更加稳定
[Ksp GdAsO
4
(
10
~
21.7
)>
Ksp GdPO
4
(
10
~
25
)
]
,这也是大多数镧系矿物以磷酸盐的形式存在的原因。无机磷酸盐(
inorganicphosphates
,
Pi
)不仅存在于天然矿物中,还富集于内源的血浆(
1.12
~
1.45 mmol/L
)以及细胞质(
10
~
75 mmol/L
)中,主要以磷酸二氢盐和磷酸一氢盐的形式存在
[51]
。
Chen
等
[52]
利用
[GdAsO
x
(
s
)+
Pi
(
aq
)
-
GdPO
4
(
s
)+
H
3
AsO
3














