事件
2018年11月11日,基石药业披露赴港上市招股书。

【海通医药】赴港上市生物科技企业系列解读
1.
歌礼生物吹响赴港上市号角(附招股书摘要)
2.
赴港上市第二家花落华领(附招股书摘要)
3.
赴港上市新军又添盟科医药、信达生物(附招股书摘要)
4.
方达医药(泰格医药子公司)赴港上市招股书摘要
5.
Stealth、AOBiome两家美国企业加入赴港上市队伍
6.
康希诺生物赴港上市招股书摘要
7.
维亚生物赴港上市招股书解读
8.
过会!百济神州赴港第二上市几成定局(附招股书解读)
9.
君实生物赴港上市招股书解读
10.亚盛药业赴港上市招股书解读
11.迈博药业赴港上市招股书摘要
12.翰森制药赴港上市招股书摘要
附:赴港上市各公司招股书下载链接(持续更新中,请保持关注)
http://t.cn/RrQc4Bl(注:相关网址需要复制至浏览器打开)
基石药业赴港上市招股书摘要
一、公司简介
基石药业
成立于2015年,
是一家处于临床阶段的生物技术公司,专注于开发及商业化创新肿瘤免疫治疗及分子靶向药物,以满足癌症治疗的殷切医疗需求。公司目前已建立强大肿瘤科管线,具有单一及联合疗法的重大潜力及协同效益。
二、股权结构
公司的前3大股东分别是WuXi Ventures、正则原石及其联属人士、Graceful Beauty Limited,分别持有39.31%、18.30%、19.72%的股份。具体股权结构如下图所示:
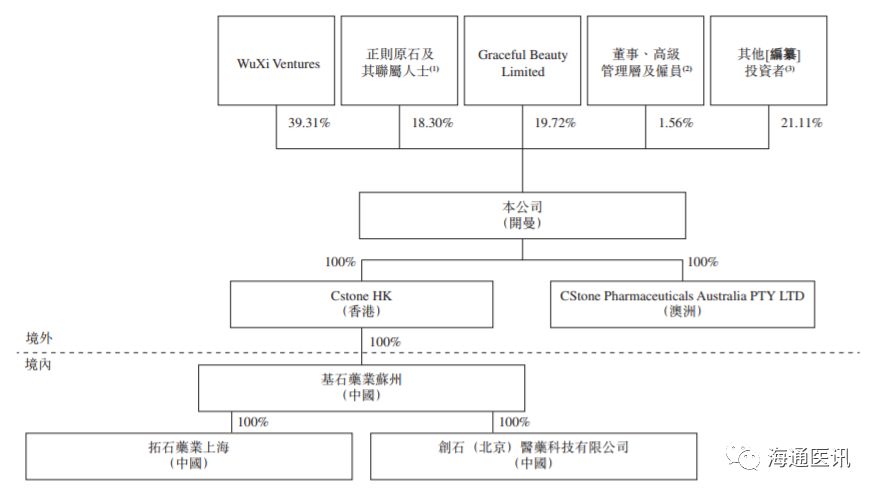
本文资料来源:公司港股招股书,海通证券研究所
三、高管背景介绍
江宁军博士,首席执行官、执行董事兼董事会主席。
曾
担任赛诺菲中国亚太区研发负责人,领导该区域的研发扩张,负责开发及落实区域研发策略。
江宁军
在赛诺菲的任职期间,共监督
79
项临床试验,获得
30
项新药物批准,其突出业绩之一是通过领导一项约
21000
名患者的大规模临床试验,顺利将重磅药物
Lovenox
进行全球注册。加入赛诺菲前,
江宁军
担任
Eli Lilly
的临床研究医生,并领导一项疑似败血症的全球
II
期试验。
江宁军
为美国委员会认证医生(内科)。
杨建新博士,首席医学官。
杨建新
于2014年返回中国后获选中国国家“千人计划”的“杰出专家”并入选北京海外人才聚集工程,在肿瘤药物的生物医学研究及临床开发方面拥有逾
21
年的全球经验。加入本公司之前,
杨建新
曾担任
BeiGene Inc.
的高级副总裁兼临床开发主管,带领其团队为
BeiGene
四款分别以
PD-1
、
BTK
、
PARP
及
BRAF
为靶点的抗癌药物取得关键安全性及概念验证功效数据。
叶霖先生,首席财务官,于投资银行及跨国生物制药公司拥有逾20年工作经验。
叶
曾在香港担任高盛的董事总经理,领导该公司在中国及亚洲医疗市场的研究工作。在此之前,
叶霖
曾担任花旗集团(美国)的区域医疗研究团队的负责人,此外还曾在
Amgen
进行药物发现研究。
袁斌博士,首席商务官。
在全球业务发展及营销策略方面拥有丰富的经验,为多个全球肿瘤品牌作出重大贡献。曾担任默沙东的执行董事兼肿瘤
BD&L
全球负责人,在
Keytruda
临床组合合作伙伴关系及多宗肿瘤免疫治疗交易中发挥重要作用。在此之前,
袁斌在
诺华制药公司担任全球肿瘤学商业化职位,最后担任的职位为执行董事兼生命周期战略负责人。
王辛中博士,首席科学官。
在生物医药行业肿瘤免疫治疗及基因治疗研究方面拥有
20
多年经验。曾
在
默沙东麻萨诸塞州波士顿的
MSD
研究实验室担任肿瘤免疫治疗研究主任。在此之前,
王辛中
担任
AstraZeneca/MedImmune LLC
的
BioSuperiors
部门的副主任和科学家。
李景荣博士,产品开发与生产高级副总
。
曾任先声药业执行董事,其后出任百家汇生物(先声药业的附属公司)总经理,监督其营运和管理。此外,李景荣还曾担任
Roche Molecular Systems Inc.
科学家及
BioSpecifics Technologies Corp.
的全职资深科学家。
四、公司发展历程
主要里程碑:




本文资料来源:公司港股招股书,海通证券研究所
五、产品管线
公司已建立以肿瘤学为重点的产品管线,其策略重点为肿瘤免疫治疗联合疗法。
公司希望凭借
14
项资产,包括三种处于临床阶段的肿瘤免疫治疗骨干候选药物(
PD-L1
、
PD-1
及
CTLA-4
抗体),发展出所有中国生物制药公司中最大的肿瘤科联合疗法组合之一。为配合免疫治疗骨干候选药物,公司自
Agios
及
Blueprint
获得在大中华地区开发及商业化四种分子靶向化合物的独家许可。依据美国临床试验所取得的数据,所有四种化合物
(Ivosidenib (CS3010)
、
Avapritinib (CS3007)
、
CS3008
(
FGFR4
抑制剂) 及
CS3009
(
RET
抑制剂
)
的主要适应症均已取得概念性验证。美国
FDA
于2018年7月批准
Ivosidenib
用于治疗
IDH1m
复发或难治性
AML
,属全球同类首款药物。
Avapritinib
为全球同类首款候选药物,而
CS3008
及
CS3009也
具潜力成为全球同类首款药物。
在研管线
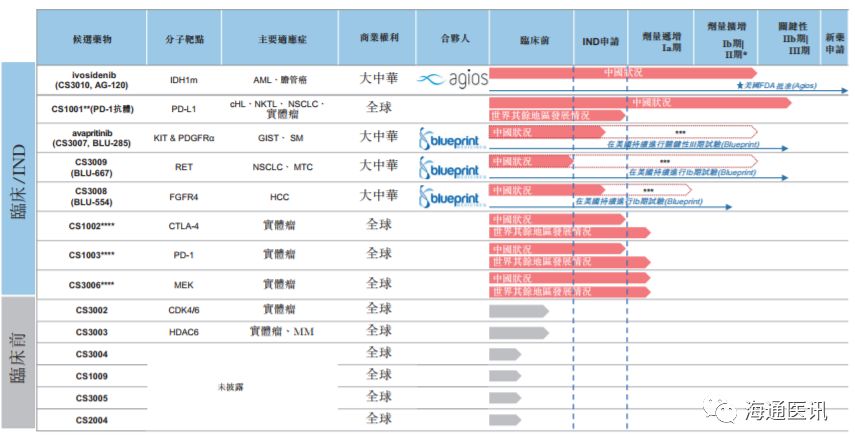
本文资料来源:公司港股招股书,海通证券研究所
公司的三种肿瘤免疫联合疗法骨干候选药物如下:
CS1001(PD-L1抗体)
是全长、 全人源
IgG4PD-L1
单克隆抗体, 是公司的核心候选产品。为最大化市场占有率,公司正在中国战略性地开发用于大型适应症的
CS1001
。为此,公司已在第
III
阶段非小细胞肺癌患者中(作为单一疗法)启动
III
期试验。公司计划分别于2018年底前、2019年上半年及2019年上半年在中国启动
CS1001 (PD-L1
抗体)联合标准护理疗法用于治疗
IV
期非小细胞肺癌、胃癌及
HCC
患者的
III
期试验。根据弗若斯特沙利文报告,2017年,中国该等大型适应症的总发病率达到
1.2
百万例。公司相信
CS1001
将成为中国首批针对该等大型适应症的获批
PD-1
及
PD-L1
抗体之一。
CS1003(PD-1抗体)
是人源化
IgG4PD-1
单克隆抗体,对人源及鼠源
PD-1
具有交叉反应,能够让公司临床前动物研究快捷地评估联合疗法,并对临床试验的安全及效用状况作出更好预测。公司正在开发
CS1003
作为罕见及敏感肿瘤类型的单一疗法以快速进军市场,并计划开发
CS1003
与
CS1002
(
CTLA-4
抗体)或
CS3006
(
MEK
抑制剂)的联合疗法,在中国及全球治疗多种实体瘤。
CS1002(CTLA-4抗体)
是全人源
CTLA-4
单克隆抗体。
CS1002
的氨基酸序列与
ipilimumab
(商品名
Yervoy®)
相同。
Ipilimumab
尚未获批在中国上市,公司计划根据中国药监局规定以新药途径(
2
类生物药)开发
CS1002
。临床前测试表明,
CS1002
对
CTLA-4
具有较高亲和力,预期在临床活性及安全性方面与
Yervoy®
产品相媲美。公司计划开发
CS1002
与
CS1003
(
PD-1
抗体)联合治疗多种实体瘤。
公司目前有四种处于或接近关键性试验的后期候选药物
Ivosidenib (CS3010)
、
Avapritinib (CS3007)
、
CS3008
(
FGFR4
抑制剂) 及
CS3009
(
RET
抑制剂
)
。具体情况如下:
Ivosidenib (CS3010, AG-120)
是一种研究性同类首款、口服、选择性、有效的突变异柠檬酸脱氢酶-
1(IDH1)
抑制剂,用于治疗携带易感
IDH1
突变的癌症。
Ivosidenib(CS3010)
于2018年7月获美国
FDA
批准用于治疗由美国
FDA
批准伴随诊断的测试检测的带有
IDH1
突变的复发性或难治性
AML
成人患者,是全球同类产品最先获批的药物。公司计划开发
ivosidenib(CS3010)
作为单一疗法或联合
CS1001 (PD-L1
抗体
)
或
CS1003 (PD-1
抗体
)
治疗
AML
、胆管癌及其他潜在适应症患者。
Avapritinib (CS3007, BLU-285)
是一种口服、有效及高选择性抑制剂, 可靶向同源激酶
KIT
及
PDGFR
α突变,用于治疗癌症,包括胃肠道间质瘤
(GIST)
及系统性肥大细胞增多症
(SM)
。
Avapritinib (CS3007)
专门设计用于结合及抑制该等激酶的活性构象,可有效抑制将激酶转变为其活性构象的一级及二级突变。作为同类首款、经概念验证的候选药物,
avapritinib (CS3007)
在2017年6月取得美国
FDA
的突破性疗法认定,用于治疗携带
PDGFR
α
D842V
突变的不可切除或转移性
GIST
患者。
Avapritinib (CS3007)
目前正由
Blueprint
在晚期
GIST
及晚期
SM
患者的
I
期临床试验的剂量扩大部份进行评估。根据现有数据,公司认为
avapritinib
有潜力成为某些
GIST
和晚期
SM
患者的有效治疗方案。公司计划在中国开发
avapritinib
用于治疗
GIST
和
SM
患者。
CS3009 (BLU-667)
是一种口服、有效及高选择性抑制剂,旨在靶向
RET
融合及突变,用于治疗癌症,包括非小细胞肺癌
(NSCLC)
及甲状腺髓样癌
(MTC)
。
CS3009
(
RET
抑制剂)目前正由
Blueprint
在
RET
改变的非小细胞肺癌、
MTC
及其他晚期实体瘤患者的
I
期临床试验的剂量扩大部份进行评估。目前发布的临床数据表明
CS3009














