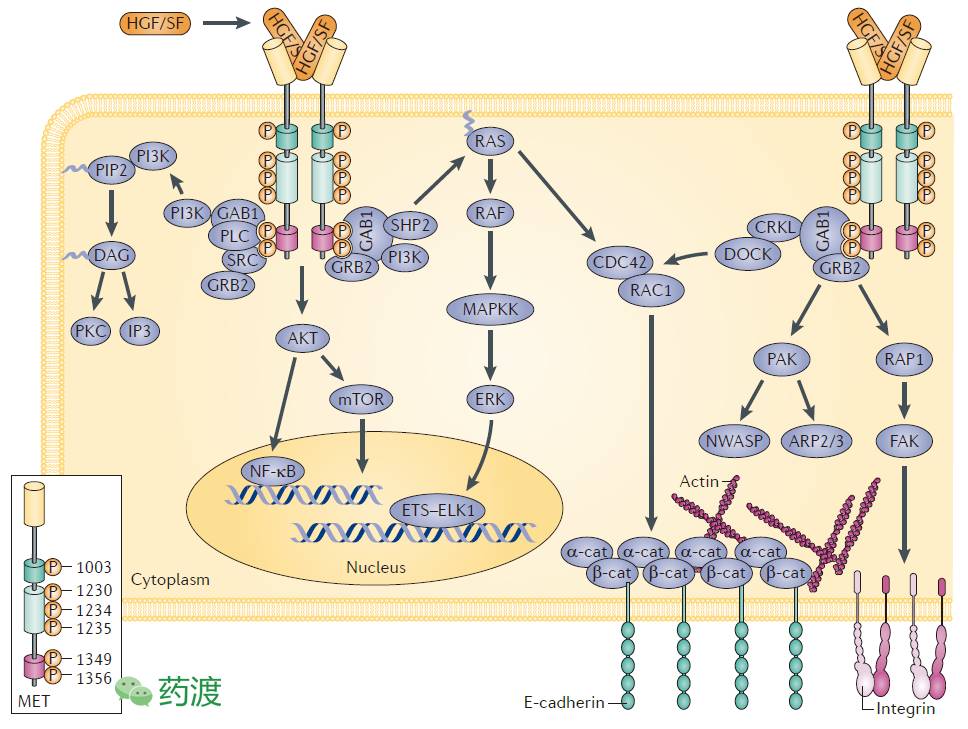
图1. Signalling pathways activated by HGF/SF and MET
受体酪氨酸激酶cMET及其唯一的已知配体HGF (hepatocyte growth factor)在细胞的增殖、存活、侵袭、组织发育及器官再生等过程中扮演重要作用(图1)。cMET最初在体内翻译成一条单链前体蛋白,随后经过翻译后修饰而成为由二硫键连接的三维结构。成熟的cMET分子由一条分子量为50kDa的胞外α链及140kDa的跨膜β链组成(图2)。HGF最初分泌为非活性前体形式,经过丝氨酸蛋白酶切割过程而成熟。活性HGF配体包含有N端结构域及Kringle结构域的α链及类似丝氨酸蛋白酶结构域的β链组成。HGF分子的N端结构域及K1区域同cMET高亲和度结合,并诱导HGF β链上产生一个新的结合位点。由此,HGF同cMET形成一个紧密复合体,并启动信号转导过程。活性复合体的形成,会导致受体的多聚化、内吞、胞内激酶结构域中多个酪氨酸残基的磷酸化,从而激活多条信号级联通路,并与肿瘤的发展、侵袭及转移密切相关。
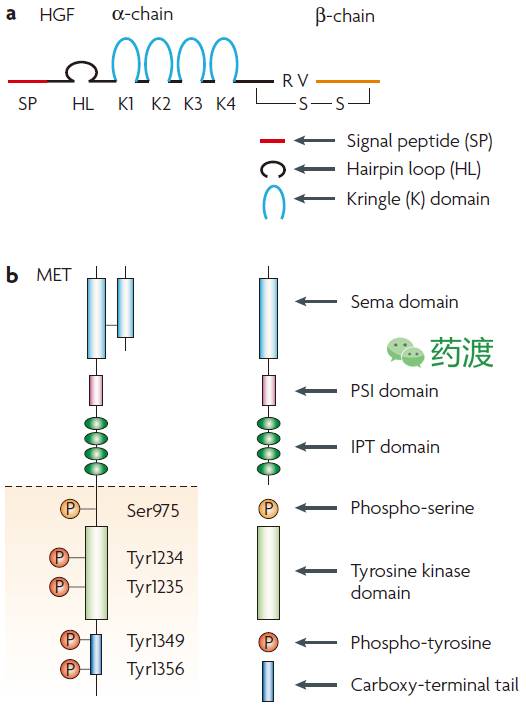
图2. Schematic structure of HGF and MET
尽管HGF-cMET信号通路存在着严格的调控,但在多种类型的恶性肿瘤中均检测到了该信号通路的异常调节。cMET的异常激活可通过非HGF依赖性机制发生,如MET基因的突变、基因扩增及转录水平上调等。cMET的过表达发生于多种类型的实体瘤中,包括脑肿瘤、乳腺癌、大肠癌、胃癌、头颈癌、肺癌、肝癌、皮肤癌、前列腺癌与软组织癌等。cMET还可通过与EGFR的相互作用而被激活。鉴于cMET过表达的肺癌对EGFR酪氨酸激酶抑制剂的抗性,以及cMET与EGFR抑制剂间的协同效应,同时靶向于两者应该是一项很有前景的治疗策略。
肿瘤及血浆HGF水平的升高还发生于某些特定类型的患者中,如浸润性乳腺癌、神经胶质瘤、多发性骨髓瘤、肉瘤等。多项体内研究表明,HGF-cMET信号通路的激活会诱发肿瘤的侵袭及转移,因此多项靶向于该通路的治疗药物也在研发过程中。例如,现有多种单克隆抗体药物处于不同临床研究阶段,通过封闭HGF对cMET的结合,或者直接靶向于细胞表面的cMET分子而抑制HGF-cMET信号通路轴。由于抗体类药物具有非常出色的靶向特异性及可预见的药物学特征,因而相比于小分子化学药具有更好的安全性。小分子抑制剂类药物中,副作用及剂量限制性毒性非常常见,而在单克隆抗体类药物中,剂量限制性毒性罕有报道。目前多种不同作用机制的靶向于HGF-cMET信号通路轴的单克隆抗体正处于临床试验阶段中,用于测试对实体瘤患者的疗效,如表1所示。
表1. Antibodies targeting the HGF–cMET axisin development
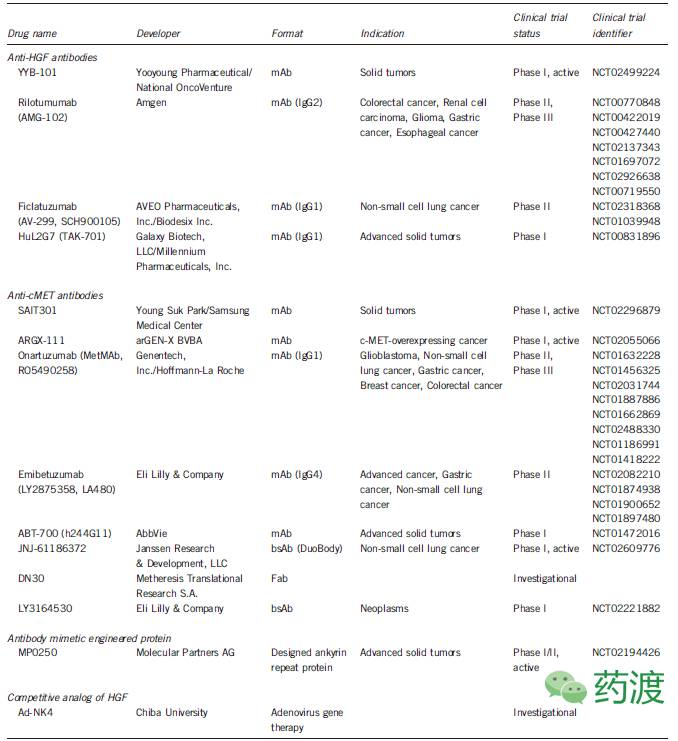
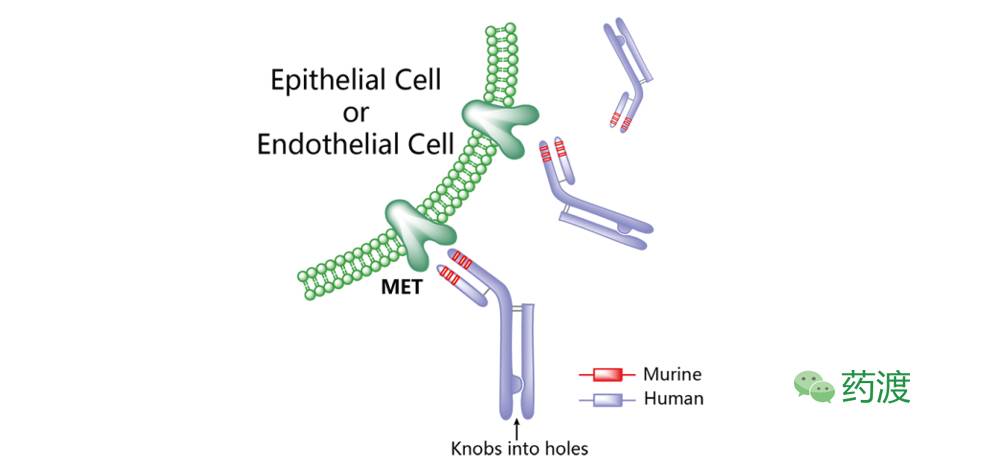
图3. Onartuzumab
Onartuzumab (MetMAb)
由基因泰克(Roche子公司)研发,于2011年由Roche授权于日本中外制药株式会社用于NSCLC的研发。Onartuzumab是一种靶向于肝细胞生长因子受体cMET的单价抗体(独臂抗体),曾开展过治疗胃癌和转移性非小细胞肺癌(NSCLC)的Ⅲ期临床试验、治疗转移性结直肠癌和成胶质细胞瘤的Ⅱ期临床研究,以及治疗肝癌的Ⅰ期临床研究。2013年,Onartuzumab被美国FDA认证为治疗肝癌的孤儿药。该抗体可封闭HGF α链同cMET的高亲和力结合,而不作用于β链。由于在各项临床研究中疗效不佳,该药的多项临床试验项目已被终止。
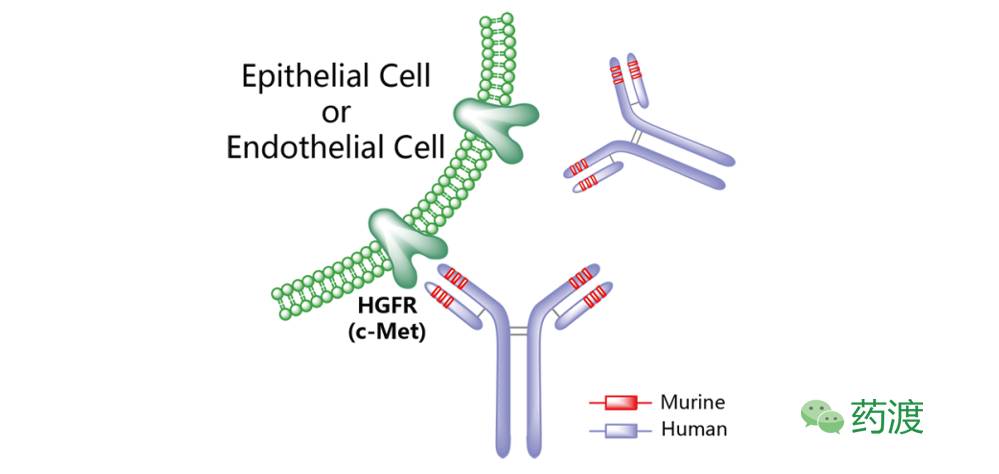
图4. Emibetuzumab
Emibetuzumab (LY2875358)
礼来(Lily)公司开发的一种靶向于肝细胞生长因子受体的单克隆抗体,目前处于临床Ⅱ期研究阶段,用于治疗非小细胞肺癌和胃癌。Emibetuzumab是一种二价人源化cMET IgG4单克隆抗体,可以阻断HGF同cMET的结合,并促进后者的内吞及降解,这一点与Onartuzumab不同。在小鼠移植瘤模型中,Emibetuzumab对HGF依赖性及非依赖性的肿瘤生长均表现出抑制活力。目前有两项Ⅱ期临床试验正在进行中,分别是针对携带有EGFR突变的NSCLC患者(NCT01897480)及同VEGFR2单克隆抗体Ramucirumab联合使用策略(NCT02082210)。
LY3164530
通过融合EGFR抗体单链可变片段(人源化Cetuximab序列)至Emibetuzumab重链的N末端而成的双特异性抗体类药物。LY3164530可结合cMET及EGFR并促进其内吞,而不具有激活活性。在NSCLC移植瘤模型中,该药物相比于Emibetuzumab与Cetuximab联合用药方案表现出更好的抗肿瘤疗效。目前一项编码为NCT02221882的Ⅰ期临床试验正在进行中。
JNJ-61186372
靶向EGFR/cMET的双特异性抗体,为IgG1的异二聚体,两区段分别靶向于EGFR及cMET。结合cMET的IgG1分子在CH3结构域存在K490R突变,而结合EGFR的IgG1分子在CH3结构域存在F405L突变。JNJ-61186372通过下调EGFR及cMET量,以及提高抗体依赖性细胞介导的细胞毒作用实现对肿瘤细胞生长的抑制活性。目前该药物针对携带有EGFR突变的NSCLC患者的Ⅰ期临床试验(NCT02609776)正在进行患者招募过程中。
SAIT301
人源化单克隆抗体,可促进cMET的降解。SAIT301可通过下调EGR-1的表达量而抑制鼻咽癌细胞的侵袭和转移。目前编号为NCT02296879的Ⅰ期临床试验正在招募cMET阳性的实体瘤患者。
ABT-700 (h224G11)
早期名为h224G11,是一种人源化的二价单克隆抗体,可抑制cMET的二聚化及HGF诱导的激活效应。目前编号为NCT01472016的Ⅰ期临床试验正在进行中,用以研究ABT-700单独用药或者同多西他赛、5-氟尿嘧啶、亚叶酸、伊立替康和西妥昔单抗(FOLFIRI /西妥昔单抗)或厄洛替尼等联合用药对携带有MET基因扩增或cMET过表达的晚期实体瘤患者的疗效。
ARGX-111
一种无岩藻糖基的IgG1抗体,具有更强的组织穿透能力及更高的抗体依赖性细胞毒性。ARGX-111可抑制配体依赖性cMET的活化,且在cMET过表达的人类肿瘤细胞系,以及来源于患者的慢性淋巴细胞白血病与急性髓性白血病细胞中均表现出细胞毒性。在原位移植小鼠模型中,ARGX-111可降低循环肿瘤细胞数量,并抑制肿瘤细胞的转移。目前该药正开展针对过表达cMET的晚期肿瘤患者的Ⅰ期临床试验(NCT02055066)。
DN30
是一类单价嵌合Fab,可诱导cMET的蛋白性切割,从而导致受体的胞内部分迅速进入蛋白酶体降解过程。体外实验表明,DN30 Fab可抑制HGF依赖性及非依赖性的肿瘤细胞增殖,并在人胃癌、肺癌与胶质母细胞瘤临床前模型中延缓肿瘤细胞的生长。受限于较小的分子量,DN30 Fab往往很快通过肾脏途径被清除。目前研究人员正采用PEG修饰及基因输送的方式试图克服这一缺陷。
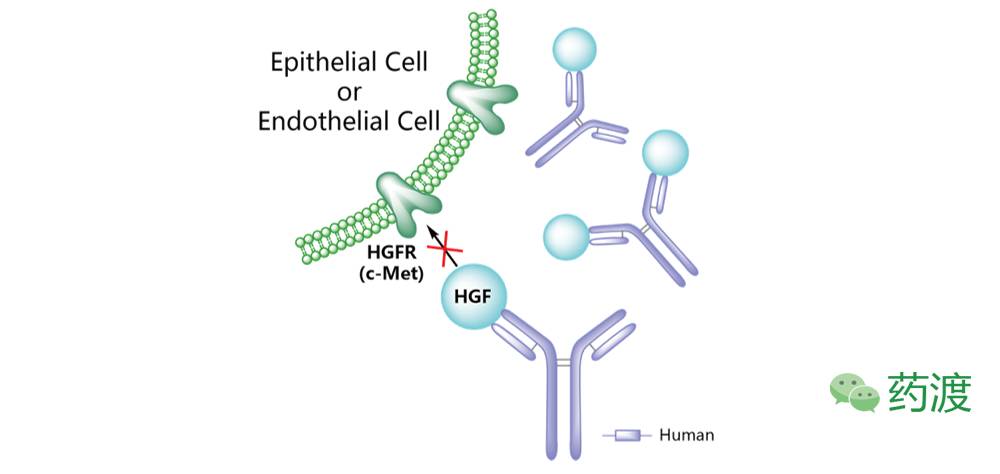
图5. Rilotumumab
Rilotumumab (AMG-102)
最初由安进(Amgen)开发,之后安斯泰来(Astellas)获得了该药的共同研发授权。Rilotumumab是一种全人源IgG2k型的单克隆抗体,靶向于干细胞生长因子(HGF),是第一种进入Ⅲ期临床试验阶段的HGF抑制剂类药物。该药物曾进行过治疗胃癌的Ⅲ期临床试验,治疗结直肠癌、胶质瘤、前列腺癌、肾癌和小细胞肺癌的Ⅱ期临床试验,以及治疗其他类型实体瘤的Ⅰ期临床研究。受限于疗效及安全性因素,目前针对该药物的临床试验项目均已终止。
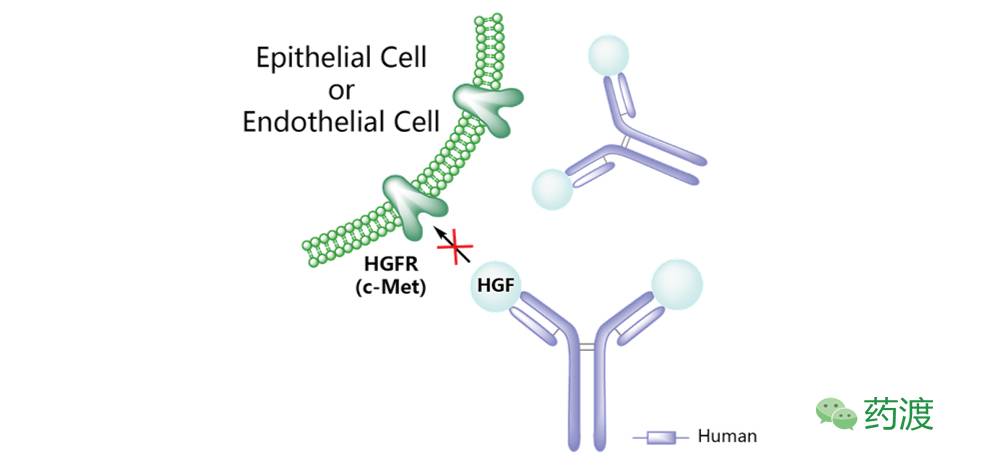
图6. Ficlatuzumab
Ficlatuzumab (AV-299)
一类人源化的HGF抗体。在应用Ficlatuzumab进行的Ⅰ期临床研究中,实体瘤患者表现出良好的耐受性。最常观察到的毒副反应为外周水肿、疲劳和恶心。针对该药开展的两项Ⅱ期临床试验目前均处于终止状态。
HuL2G7 (TAK-701)
Galaxy Biotech原研,是一种人源化抗体药物,可以克服EGFR突变的人类NSCLC细胞系中的Gefitinib药物抗性。晚期实体瘤患者中开展的Ⅰ期临床试验表明,HuL2G7没有特定的剂量限制性毒性,但副作用包括咳嗽、腹痛、便秘和疲劳等。目前尚无进一步的临床试验信息。
YYB-101
Yooyoung原研,人源化兔抗HGF抗体。YYB-101结合于HGF的α链,也是与cMET高亲和力结合位点。体外实验中该药物可以抑制cMET的活化,并在一些小鼠抑制模型中表现出抑制肿瘤生长活性。目前该药物针对晚期实体瘤患者的Ⅰ期临床研究(NCT02499224)正在进行中。
MP0250
由Molecular Partners研发,目前处于临床二期阶段,用于治疗实体瘤和血液系统恶性肿瘤。MP0250是一种人工设计的锚蛋白重复序列蛋白,可以中和HGF及VEGF。MP0250可以结合于人血清白蛋白,因而血浆中半衰期可达12天。在多发性骨髓瘤的原位移植小鼠模型中,无论是单独治疗还是同Bortezomib联用,MP0250均能抑制骨髓瘤细胞的迁移、侵袭及骨破坏作用。基于临床前及Ⅰ期临床研究结果,一项Ⅱ期临床试验项目正在规划中,用以在标准治疗方案失败的多发性骨髓瘤患者中评估MP0250同Bortezomib及Dexamethasone联用的治疗效果。
NK4
合成多肽,含有HGF分子的N端结构域以及四个Kringle结构域,但是缺失分子C末端的16个氨基酸残基。该类似物可以结合于cMET分子而不激活信号通路的传导,从而在不同肿瘤动物模型中发挥抑制肿瘤细胞生长、转移及新生血管生成的效应。在临床前研究中,腺病毒表达NK4基因在多种类型的肿瘤,包括间皮瘤和胰腺癌中显示了良好的抗肿瘤作用。采用NK4表达的腺病毒载体对间皮瘤患者进行治疗的Ⅰ期临床研究正在进行中。
HGF突变体
通过在HGF前体切割位点引入点突变(Arg494Gln),可以产生不可切割性的HGF前体分子。后者在体外实验体系中可以抑制HGF介导的cMET激活;而在小鼠体内局部或系统性表达该分子也可抑制肿瘤细胞生长,并阻止其转移过程。在HGF分子的口袋区域引入突变(D672N, V495G, V495A, G498I及G498V)也可抑制cMET的激活,该位于N段区域的活性口袋位于HGF β链上,可稳定同cMET的相互作用。体外试验表明,突变的HGF蛋白可以抑制cMET的磷酸化及肿瘤细胞的迁移。
HGF-cMET信号通路是一类很有希望的肿瘤治疗靶点,许多靶向于HGF或cMET的抗体及基因工程类蛋白药物已在临床试验中表现出良好的安全性。然而迄今为止,尚未有任何一种候选药物表现出显著的临床疗效。因此,在未来所要开展的临床试验中,选取更好的患者筛选的生物标志物,以及不同的临床适应症将至关重要。
参考文献:
1. Drug development of MET inhibitors: targeting oncogene addiction and expedience. Nature Reviews Drug Discovery 7, 504-516 (2008) |doi:10.1038/nrd2530
2. MET: a promising anticancer therapeutic target. Nature Reviews Clinical Oncology 9, 314-326 (2012) | doi:10.1038/nrclinonc.2012.71
3. Progress of antibody-based inhibitors of the HGF–cMET axis in cancer therapy. Experimental & Molecular Medicine (2017) 49, e307;doi:10.1038/emm.2017.17
4. Targeting the oncogenic Met receptor by antibodies and gene therapy. Oncogene (2014), 1–7
5. 抗体类药物示意图来源于药渡网
声明:
本文由药渡头条投稿作者撰写,观点仅代表作者本人,不代表药渡头条立场,欢迎交流补充。联系方式:010-82826195 转8048
如需转载,请务必注明文章作者和来源
投稿详
情请点击“
3月-4月 | 王牌写手获奖名单
”