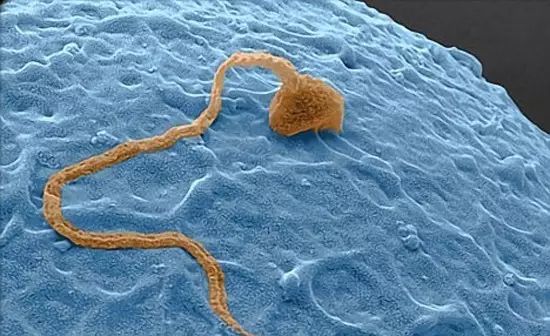
《Science》及《Cell》子刊都报道了颠覆传统生殖观念的研究。尽管的研究方法不同,研究对象也有差异,但最终的结论有一个共同点:无须雄性或Y染色体,便可实现生殖的目的。
Science:
利用转基因技术,无Y染色体也可生殖
2016年1月28日,发表于《Science》上的研究表明了通过转基因技术,可使无Y染色体的小鼠重拾生育能力。研究人员发现利用其它染色体中的两个基因足以恢复无Y染色体的雄性小鼠精子的形成过程,通过辅助生殖技术可与卵子受精并形成胚胎,研究人员表示这两个基因可能与Y染色体功能冗余。
该研究由夏威夷大学的Monika Ward 及其同事引领,该结果建立在2014年的研究基础上,当时他们曾揭示了限制Y染色体功能的只有两个功能基因——Sry和Eif2s3y,拥有这两个基因就足以形成精子。这两个基因是小鼠的雄性决定因子,Sry基因在生命早期引发睾丸的形成,Eif2s3y启动精子的形成,使配子成熟。
而在本次研究中,研究人员首次把目标转向编码在11号染色体上的直接靶基因Sox9,将之与Y染色体上的Sry基因替换。正常状态下,Sox9在Sry的激活下启动一些列的分子事件,从而使胚胎发育成为雄性。研究人员利用转基因技术将Sox9基因在缺乏Sry基因但携带Eif功能的XY染色体小鼠内表达,结果发现这些小鼠最终发展为具有生育能力的雄性小鼠。随后研究人员再将该小鼠的Eif2s3y基因替换成Eif2s3x(Eif2s3x为X染色体上的同源物,与Eif2s3y为同个基因家族)。最后研究人员成功地将Sry和Eif2s3x在XO小鼠体内表达,并对转基因小鼠与正常XY小鼠的基因表达、睾丸发育和精子的形成于发展进行比较。
研究人员发现,尽管多数的Sox9及Eif2s3x转基因XO小鼠存在睾丸缺陷和缺乏生殖细胞,但在27%的小鼠体内可形成圆形精子。虽然这些细胞不能成熟发展成为带有尾巴的精子,但当注入到卵子中,却能成功进行受精并形成胚胎。同时研究人员发现形成精子细胞的能力与Eif2s3y或转基因Eif2s3x有关:单剂量的X染色体同源基因不足以弥补Y染色体基因的功能,但将转基因Eif2s3x的量增加5-7成能更加紧密地模仿Y染色体基因的功能。
X-Y基因同源体的研究仍需继续
总体而言,这项研究与他们之前的研究相呼应,美国国家环境健康科学研究所的 Humphrey Hung-Chang Yao说,例外的是,X连锁基因—— Eif2s3x并不像Y染色体连锁基因那样能强大地诱导精子的形成,这就是两项研究的主要区别。在Yao看来,转基因的剂量如何影响精子的形成尚未清楚。由于Eif2s3y和Eif2s3x两个基因在序列上高度相似,因此进一步研究探讨转基因的表达如何影响RNA及蛋白质的水平十分重要。
MD癌症研究中心的Richard Behringer的说,“该研究有助于人类更好地了解生育机制,在研究人员的第一篇文章中,他们揭示了男性所需的最小的Y染色体基因,在这篇论文中,如果我们绕过这些基因往前走,那么男性还是男性吗?”
Ward 说,“我们知道操纵Sox9基因可使XX雌性小鼠发展成为雄性小鼠,但在之前的大多数研究中,人们基本上都是研究睾丸的早期发育,并没有进一步研究成熟男性在生育时睾丸的变化。其他X-Y基因同源体的额外研究可以帮助科学家确定这种基因能否执行类似功能或相互替换。从进化的角度来看,这非常有意思,因为目前理论上认为Y染色体基因在逐步退化以及X染色体来补偿,但对于这对特定的基因,Y同源体仍属于强者。”
【Cell共同发力】两颗卵子产健康幼鼠

《Science》的此项研究,不免让人回想起去年中国科学家两度发表于《Cell 》子刊的研究,在整个过程中都无须雄性参与,研究人员只需一对卵子便可生育健康的幼崽,这两项研究来自同一个研究团队的结果,研究核心是类精子细胞”单倍体细胞系。
2015年7月10日研究人员在《Cell Stem Cell》上发文表明建立了能稳定支持半克隆小鼠出生的“类精子细胞”单倍体细胞系,并证明这些细胞能携带CRISPR-Cas9文库一步产生大量携带不同突变基因的小鼠。2015年11月17日,《Cell Research》揭示了继建立能稳定支持半克隆小鼠出生的“类精子细胞”单倍体细胞系之后,该研究团队在单倍体细胞技术上又取得新突破,该研究从卵子中产生了能代替精子使用的单倍体胚胎干细胞,并证明这些细胞能高效产生半克隆小鼠,从而简化了单倍体胚胎干细胞技术,促进单倍体胚胎干细胞技术的广泛应用。
结语
尽管《Science》和《Cell》都揭示颠覆生殖规则的结论,但仍属于研究阶段。关于《Cell》子刊中的研究,专家表示要在人类身上运用该技术,应该要格外谨慎,在安全性和伦理问题得到解决之前,这种技术应该长期留在实验室中。在《Science》的这项研究中,研究人员也表示需要更多的研究佐证,同时需要进一步探讨转基因的表达对RNA和蛋白质的影响。
Two genes substitute for the mouse Y chromosome for spermatogenesis and reproduction 10.1126/science.aad1795
(来源:生物探索 2016-01-30 )
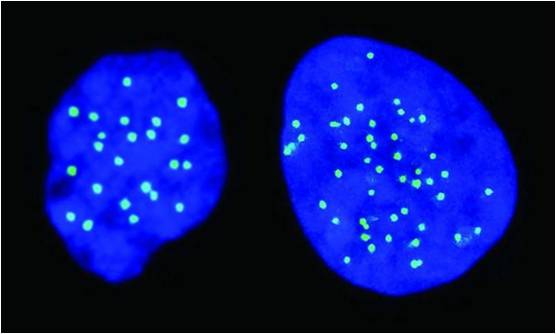
二倍性是哺乳动物的一个基本遗传特性,单倍体细胞往往只出现在生殖细胞中。2016年3月16日,发表在《自然》杂志上的一项研究中,科学家们成功生成了一种只携带单拷贝人类基因组的新型胚胎干细胞。
研究人员分析了一批来自单倍体卵母细胞的人类孤雌生殖胚胎干细胞系,成功分离和培养了携带正常单倍体染色体组型的人类胚胎干细胞系。单倍体人类胚胎干细胞表现出典型的多能干细胞特征,如自我更新能力以及多能特异性分子信号。此外,研究人员还证明了这类新型干细胞可作为功能缺失基因筛选平台使用。
尽管单倍体人类胚胎干细胞与它们的二倍体对应部分十分相似,但也显示出了一些独特属性,包括X染色体激活调节的不同、参与氧化磷酸化基因调节的不同,此外绝对(absolute)基因表达水平和细胞大小会降低。
令人惊讶的是,科学家们发现,单倍体人类基因组不仅与未分化的多能性状态兼容,也与已分化的Somatic Fates兼容。研究人员表示,单倍体人类胚胎干细胞将为研究人类功能基因学和发育提供新的手段。
领导该研究的耶路撒冷希伯来大学干细胞和遗传研究Azrieli中心的博士生Ido Sagi说:“使用单倍体人类细胞的最大优势之一是它们的基因更容易编辑。”在二倍体细胞中,由于其中一个拷贝是正常的,检测单拷贝突变的生物学效应非常困难。
此外,由于该研究描述的干细胞与卵细胞捐赠者基因匹配,它们有望用于开发治疗失明、糖尿病等疾病的细胞疗法。另一方面,由于它的基因组成与生殖细胞相当,也可能会用于生殖领域。
Derivation and differentiation of haploid human embryonic stem cells
文献检索:doi:10.1038/nature17408
(来源:生物探索 2016-03-22 )
中科院之声
5月17日,国际学术期刊
Cell Research
在线发表了中国科学院上海生命科学研究院生物化学与细胞生物学研究所李劲松研究组和上海交通大学仁济医院陈子江研究组的合作研究论文,该研究建立了来自人孤雌囊胚的单倍体胚胎干细胞系。
哺乳动物,包括小鼠、大鼠和猴,其单倍体胚胎干细胞的建立为遗传筛选研究以及制备基因编辑动物模型提供了新的手段。然而,是否能建立人的单倍体胚胎干细胞仍然不得而知。
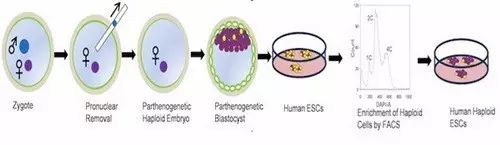
通过去除受精卵雄原核的方法建立人的孤雌单倍体胚胎干细胞
该研究中,为了获得人的单倍体胚胎,研究人员采取了两种方法。在第一种方法中,他们对成熟的卵母细胞进行孤雌激活,即将停滞在减数分裂II期的卵母细胞在体外通过化学刺激的方法诱导重新进入细胞周期,排除第二极体,激活的卵母细胞能够在体外发育到囊胚阶段。研究人员从孤雌激活的25枚卵母细胞中获得了10枚囊胚,建立了3株系细胞系。然而,3株细胞中均没有明显的单倍体细胞的存在。在第二种方法中,研究人员通过显微操作的方法将受精卵的雄原核去除获得了只含有雌原核的单倍体胚胎,最终从23个单倍体胚胎中产生了4个细胞系,其中有2株细胞系含有单倍体细胞。通过流式分选技术定期地富集单倍体细胞的方法,单倍体细胞系能够在体外稳定地维持。














