
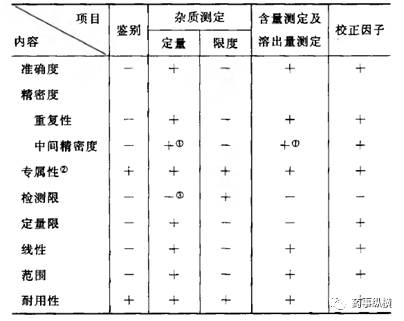
2015 版中国药典通则 9101《药品质量标准分析方法验证指导原则》中新增了校正因子验证项目和验证要求,见下表。
由于校正因子的研究对于选择合适的杂质定量方式,
准确测定杂质含量具有重要意义,因此已成为有关物质方法学验证中一项非常重要内容。
校正因子如何测定?耐用性如何考察?影响因素有哪些?本文借助印度 Natco Pharma 制药公司的一篇文章,抽提了其中的一些关键点和代表性图谱去回答这些问题,为药物分析人员提供了解决思路,能够降低研发风险。
这篇文章通过
改变 HPLC 色谱条件的参数来研究相对响应因子(Relative Response Factor,RRF)/校正因子(Correction Factor,CF)的影响因素
,考察因素包括:不同色谱柱、流速、pH值、柱温、缓冲液浓度、检测波长、不同检测器(UV和PDA)、不同溶剂级别等。结果表明某些色谱参数的改变可引起结果巨大变化,提示在 HPLC 方法开发和方法验证中应注意考虑的问题。
相对响应因子(RRF)
是一个与药物中杂质相关的重要参数,用来校正杂质对主成分峰的响应差异。RRF 通常通过标准曲线法测定。
不同药典对于 RRF 的要求不同。
USP 的 RRF 是指等量的杂质和药物的响应值的比值
,将 RRF 称为相对响应因子(Relative Response Factor,RRF)。EP/BP通常称为校正因子(Correction Factor,CF)。EP/BP 的校正因子是 USP 相对响应因子的倒数。
当对照品不稳定性、想降低杂质制备成本、杂质的合成或分离难度很大、以及为了节约检测时间或提高效率时,往往需要测定并建立杂质 RRF 值。RRF 值可用于不同阶段:如 1-4 期临床阶段,药物纯度测试、质量平衡测试、杂质测试、稳定性指示方法研究等。
在测定 RRF 值之前,先测定空白溶剂、分离度溶液、对照溶液,系统适用性应符合要求。
方法 1
配制至少 7 份单个主成分和单个杂质溶液,
浓度为供试品浓度的 0.1%-1.0%
(例如0.1%、0.2%、0.3%、0.5%、0.7%、0.8%和1.0%),
或配制至少 3 个点低于限度
(高于LOQ)
3 个点高于限度 7 份单个主成分和单个杂质溶液。
在同一色谱条件下测定。
方法 2
配制至少 7 份单个主成分和所有杂质混合溶液(如果杂质间不相互干扰,可进杂质混合溶液),
浓度为供试品浓度的 0.1%-1.0%
(例如0.1%、0.2%、0.3%、0.5%、0.7%、0.8%和1.0%),
或配制至少 3 个点低于限度(高于LOQ)3 个点高于限度共 7 份单个主成分和所有杂质混合溶液。
在同一色谱条件下测定。
方法 3
配制至少 7 份主成分和所有杂质的混合溶液(如果所有峰不相互干扰,可进主成分、杂质的全混合溶液),
浓度为供试品浓度的 0.1%-1.0%
(例如0.1%、0.2%、0.3%、0.5%、0.7%、0.8%和1.0%),
或配制至少 3 个点低于限度(高于LOQ)3 个点高于限度共 7 份主成分和所有杂质的混合溶液。
在同一色谱条件下测定。
绘制主成分浓度对峰面积的标准曲线图,不包含“零”点。
所有数据点使用最小二乘法列出线性回归方程
即 y =mx+c
公式 1:
主成分或杂质的浓度=重量(mg)/稀释(mL)×(游离碱的分子量/盐的分子量)×纯度
公式 2:
主成分或杂质的浓度=重量(mg)/稀释(mL)×纯度
公式 3:
杂质的相对响应因子=杂质的斜率/主成分的斜率
(注意:计算时,如果杂质的斜率为分子,则计算出的相对响应因子值在用于计算药物中的杂质含量时,应出现在分母中,即除以该值)。
公式 4:
杂质的校正因子=主成分的斜率/杂质的斜率
(注意:计算时,如果杂质的斜率为分母,则计算出的校正因子值在用于计算药物中的杂质含量时,应出现在分子中,即乘以该值)。
根据杂质或主成分对照品使用说明书规定确定含量及杂质或主成分存在形式,必要时进行折算。
当采用其他实验室(除药典对照品外)的对照品时,宜测定 LC-MS、色谱纯度、TGA 等。
如果杂质为定量测定,应在原料或制剂的杂质限度附近(低于、相当、高于)测定 RRF。
[1] 色谱柱的变化(同种型号来自不同色谱柱制造商)
[2] 色谱柱粒径的变化
[3] 检测波长的变化
[4] 检测器的变化
[5] 溶剂级别的变化
[6] 缓冲液浓度的变化
[7] 柱温的变化
[8] 流速的变化
[9] pH值的变化
甲磺酸伊马替尼是一种抗肿瘤药物,分子式为 C
29
H
31
N
7O
·CH
3
SO
3
H,分子量为 589.7。
甲磺酸伊马替尼片中含有两种已知杂质,即杂质 F(去甲基杂质)和杂质 G(异构体)。甲磺酸伊马替尼、杂质 G、F 的结构式和光谱图见图 1-3。
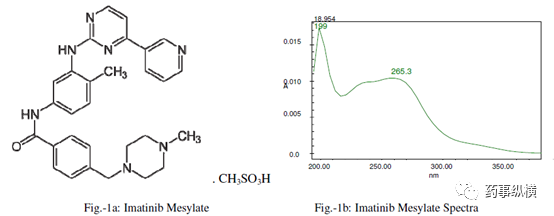
图1. 甲磺酸伊马替尼结构式及其光谱图
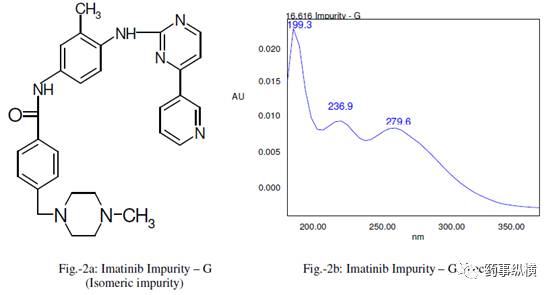
图2. 杂质 G(异构体)结构式及其光谱图
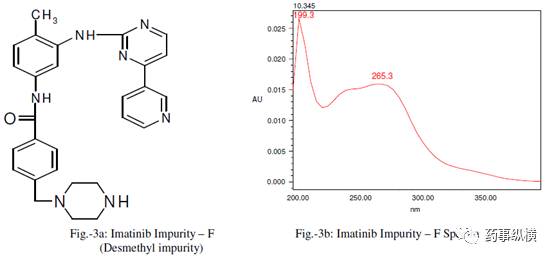
图3. 杂质F(去甲基杂质)结构式及其光谱图
仪器
Waters高效液相色谱仪(泵为2487,检测器为2695,工作站为Empower2)
色谱柱:Waters X-Bridge C18,250 x 4.6 mm, 5µm
微量天平:Mettler Toledo,XP6
分析天平:Mettler Toledo,AB204S
pH计:Lab India,Pico+
试剂
水、三乙胺、磷酸二氢钠均为 HPLC 级;乙腈、甲醇均为梯度级;甲磺酸伊马替尼、杂质 G、杂质 F 工作对照品由 Natco Pharma Limited,Hyderabad,India 公司提供。
溶液配制
缓冲液
:取 3.0g 磷酸二氢钠二水合物,用 1000mL 水溶解,用三乙胺调节 pH 值至 8.0±0.05
混合溶剂
:甲醇-乙腈(600:400)
流动相 A
:缓冲液-混合溶剂(550:450)
流动相 B
:混合溶剂
溶剂
:流动相 A
杂质 G 和杂质 F 储备液
:精密称取杂质 G 和杂质 F 对照品各5.0 mg,置 25mL 量瓶中,加溶剂溶解并稀释至刻度,摇匀。
对照品溶液
:精密称取甲磺酸伊马替尼 24.0mg,置 100mL 量瓶,加溶剂溶解并稀释至刻度,摇匀。取上述溶液 1.0mL,置 100mL 量瓶中,用稀释剂稀释至刻度,摇匀。
样品溶液
:精密称取甲磺酸伊马替尼片细粉适量(相当于伊马替尼100mg),置 100mL 量瓶中,加溶剂 60mL,超声处理15分钟,不时振摇,放冷至室温,用溶剂稀释至刻度,混匀,在 3500rpm下离心处理 10 分钟,取上清液。
色谱条件及色谱图
色谱柱:X-Bridge C18,250mm×4.6mm,5μm
柱温:30℃
流速:1.0mL/min
进样量:20μL
检测波长:230nm
运行时间:60min
表 1. 梯度洗脱程序
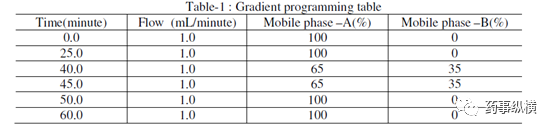
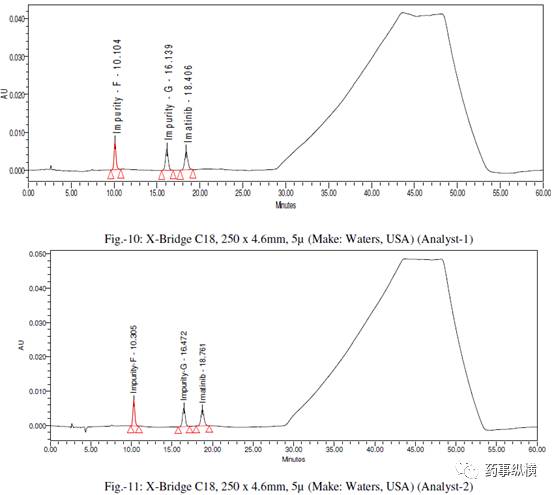
伊马替尼及其杂质在此色谱条件下在 230nm 附近均有较大吸收,混合溶液的色谱图见图 10,RRT 值和 RRF 值见表 2。
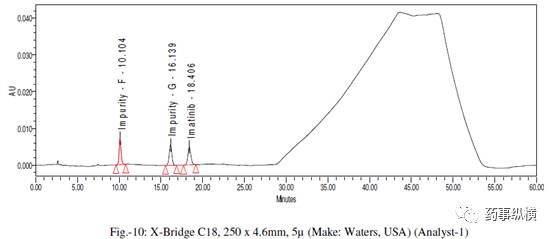
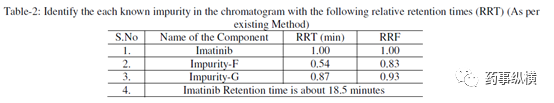
表 2. 主成分和各杂质的 RRT 和 RRF
溶液配制
储备溶液制备(主成分和杂质混合物):精密称取 5.002mg 甲磺酸伊马替尼、4.978mg 杂质 F 和 5.029mg 杂质 G,置 100mL 量瓶中,加溶剂溶解并稀释至刻度,摇匀。
对照品和杂质的纯度和称样量见表 3。
从储备液制备成各浓度溶液(0.02%-1.00%)的过程及线性范围试验结果见表 4-6。
表 3. 主成分和各杂质的称样量和纯度
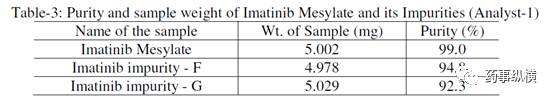
表4. 伊马替尼相对响应因子的计算(分析人员-1)
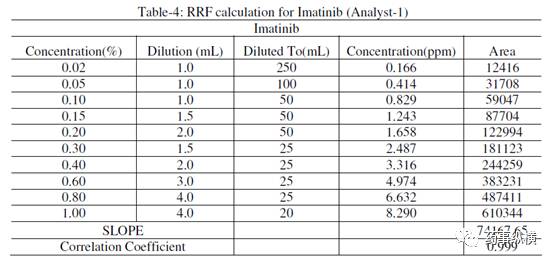
表5.杂质 F 相对响应因子的计算(分析人员-1)
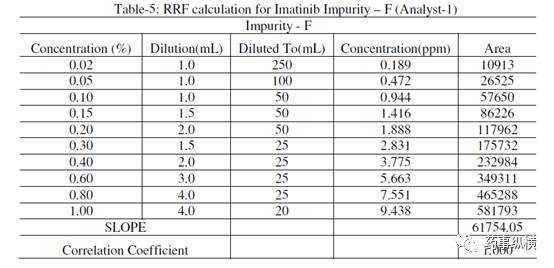
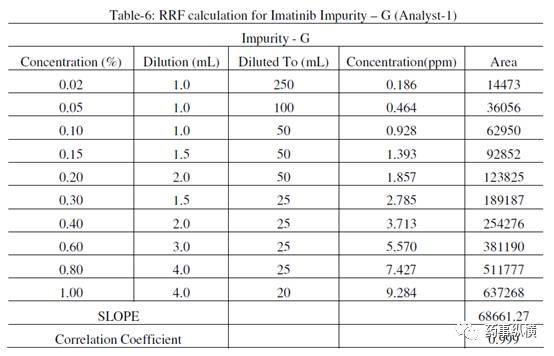
表 6. 杂质 G 相对响应因子的计算(分析人员-1)
杂质 F 和 G 相对响应因子的计算(分析人员-1)
[1] 甲磺酸伊马替尼储备液的制备
:
储备液制备=(5.002/100)(99.0 / 100)(493.6 / 589.7)1000 = 41.45ppm
稀释溶液=储备溶液(ppm)×取样体积(mL)/稀释至体积(mL)
注:折算系数为493.6/589.7,493.6为伊马替尼的分子量,589.7为甲磺酸伊马替尼的分子量。
[2] 杂质 F 储备液的制备:
储备液制备=(4.978/100)×(94.8 / 100)×1000 = 47.19ppm
稀释溶液=储备溶液(ppm)×取样体积(mL)/稀释至体积(mL)
[3] 杂质 G 储备液的制备:
储备液制备=(5.029/100)×(92.3 / 100)×1000 =46.42ppm
稀释溶液=储备溶液(ppm)×取样体积(mL)/稀释至体积(mL)
[4] 杂质 RRF 的计算:
公式= 已知杂质的斜率/主成分的斜率
杂质F的RRF = 杂质F的斜率/伊马替尼的斜率=61754.05/74167.65 = 0.83
杂质G的RRF = 杂质G的斜率/伊马替尼的斜率= 68661.27/74167.65 = 0.93
溶液配制
储备溶液制备(对照品和杂质混合物):精密称取 5.140 mg 甲磺酸伊马替尼、5.110mg 杂质 F 和 5.050mg 杂质 G,置 100mL 量瓶中,加溶剂溶解并稀释至刻度,摇匀。
对照品和杂质的纯度及称样量见表 8。
从储备液制备成各浓度溶液(0.02%-1.00%)的过程及线性范围试验结果见表 9-11。
表 8. 主成分和各杂质的称样量和纯度
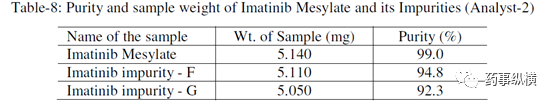
表 9. 伊马替尼相对响应因子的计算(分析人员-2)

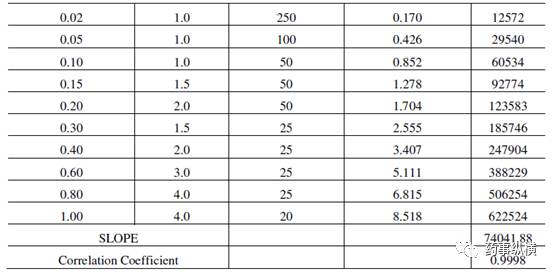
表 10.杂质 F 相对响应因子的计算(分析人员-2)
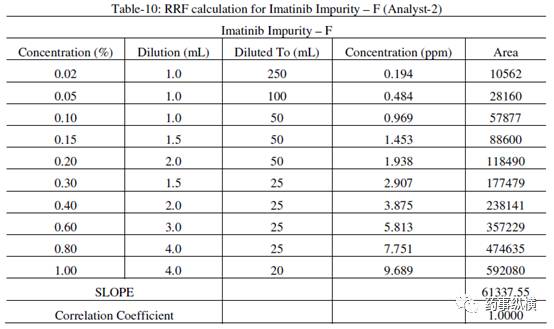
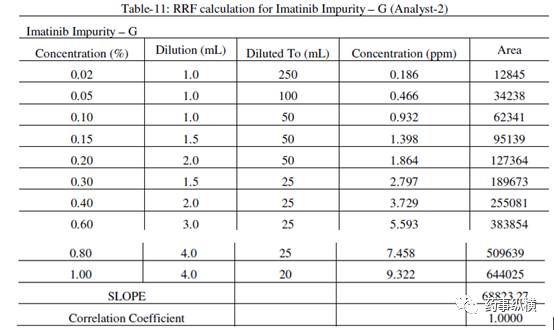
表 11.杂质 G 相对响应因子的计算(分析人员-2)
杂质F和G相对响应因子的计算(分析人员-2)
[1] 甲磺酸伊马替尼储备液的制备:
储备液制备=(5.140/100)×(99.0 / 100)×(493.6/589.7)×1000 = 42.59ppm
稀释溶液=储备溶液(ppm)×取样体积(mL)/稀释至体积(mL)
注:折算系数为493.6/589.7,493.6为伊马替尼的分子量,589.7为甲磺酸伊马替尼的分子量。
[2] 杂质 F 储备液的制备:
储备液制备=(5.110/100)×(94.8 / 100)×1000 =48.44ppm
稀释溶液=储备溶液(ppm)×取样体积(mL)/稀释至体积(mL)
[3] 杂质 G 储备液的制备:
储备液制备=(5.050/100)×(92.3 / 100)×1000 =46.61ppm
稀释溶液=储备溶液(ppm)×取样体积(mL)/稀释至体积(mL)
[4] 杂质 RRF 的计算
公式=已知杂质的斜率/主成分的斜率
杂质F的RRF =杂质F的斜率/伊马替尼斜率=61337.55/74041.88 =0.83
杂质G的RRF=杂质G的斜率/伊马替尼斜率= 68823.27/74041.88=0.93
[1] X-Bridge C18,250×4.6mm,5μm(Waters,USA)
[2] X-Terra RP-18,250×4.6mm,5μm(Waters,USA)
[3] Inert Sustain C18,250×4.6mm,5μm(LCGC,Japan)
[4] Cosmicsil BDS C18,250×4.6mm,5μm(Cosmic Age Analytica,USA)
[5] Purosphere star C18,250×4.6mm,5μm(Merck,Germany)
[6] Cosmicsil Aster C18,250×4.6mm,5μm(Cosmic Age Analytica,USA)
[7] Cosmicsil Agate C18,250×4.6mm,5μm(Cosmic Age Analytica,USA)
[8] Hypersil BDS C18,250×4.6mm,5μm(Thermo Scientific,UK)
[9] Kromasil 100,5-C18,250×4.6mm,5μm(Kromasil,Sweden)
[10] X-Bridge Shield RP-18,250×4.6 mm,5μm(Waters,USA)
[11] YMC Pack ODS AQ,250×4.6mm,5μm(YMC,Japan)
[12] Atlantis T 3 C18,250×4.6mm,5μm(Waters,USA)
[13] X-Bridge C18,250×4.6mm,3.5μm(Waters,USA)
[14] Develosil ODS MG-5,250×4.6mm,5μm(Nomura Chemicals,Japan)
[15] Sunfire C18,250×4.6mm,5μm(Waters,USA)
采用不同色谱柱测定的混合溶液的色谱图见图 10-25。
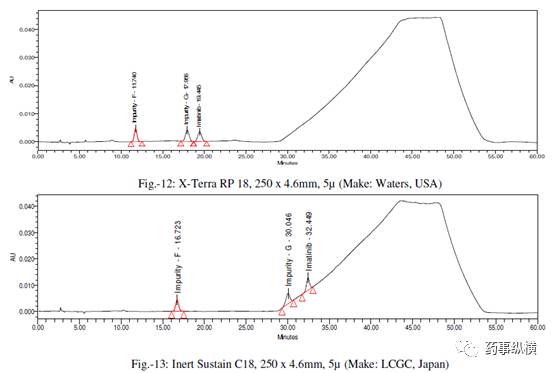
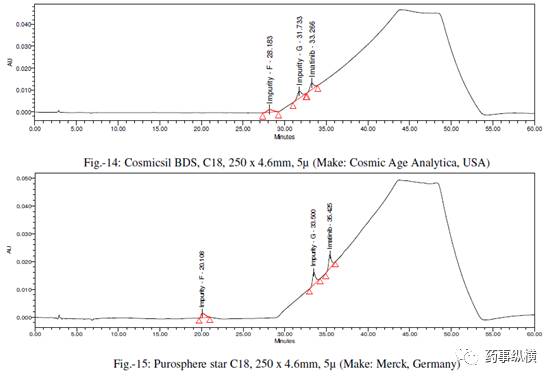
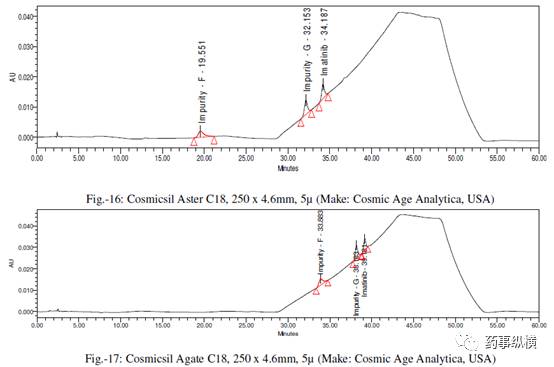
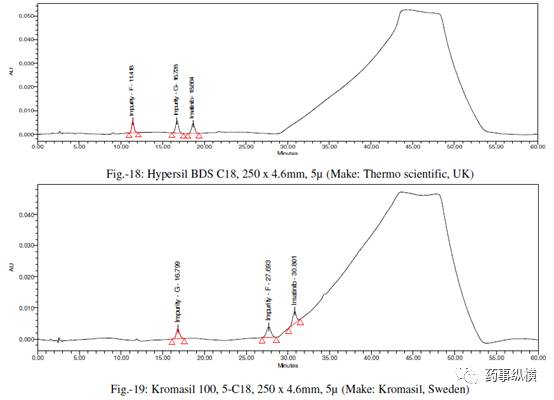
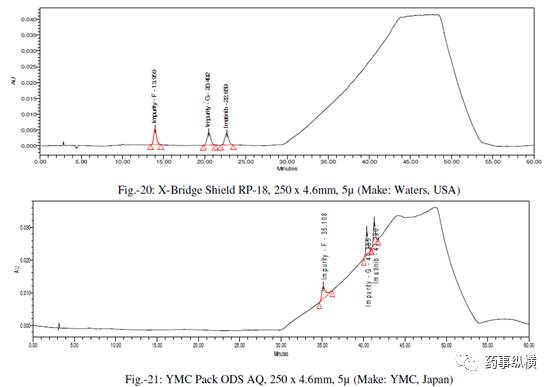
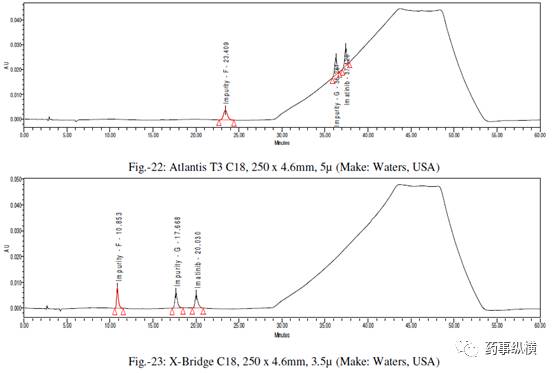
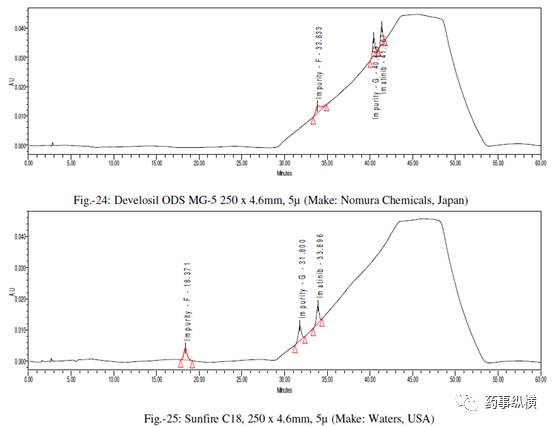
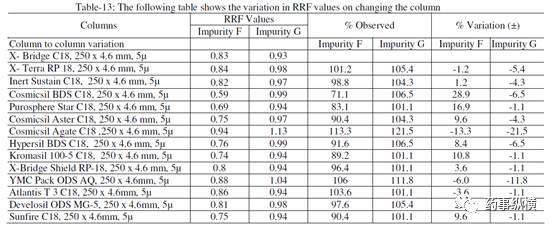
采用不同色谱柱测得的 RRF 值及其变化百分比见表 13。
表 13. 不同色谱柱测定的 RRF 结果汇总
[1] 粒度变化(30%)
[2] 流速变化(1.0±0.2mL)
[3] 柱温变化(30°C±5°C)
[4] 检测波长变化(230±3nm)
[5] pH值变化(±0.2)
[6] 不同检测器的变化(UV-2487和PDA-2998)
[7] 缓冲液浓度变化(±10%)
[8] 溶剂级别(HPLC级和梯度级)
在各变化条件下的色谱图见图 26-39,RRF 值及其变化百分比见表 14-21。
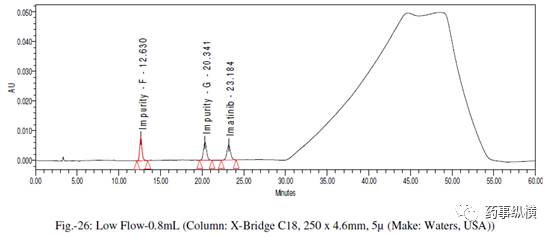
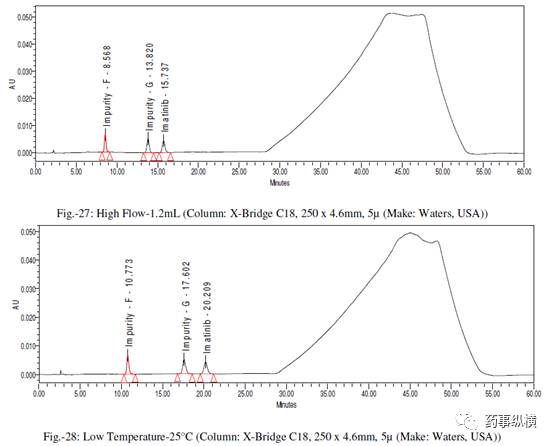
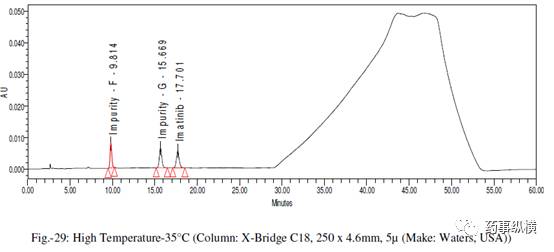
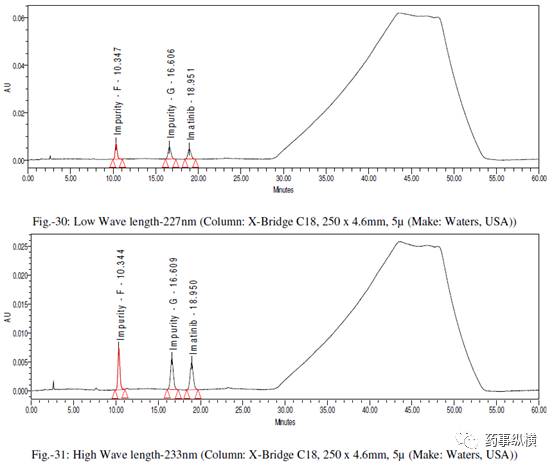
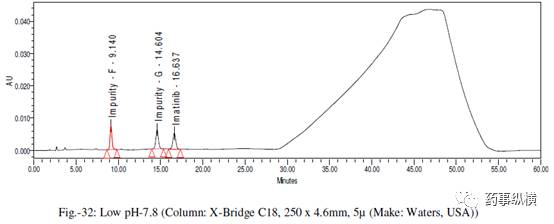
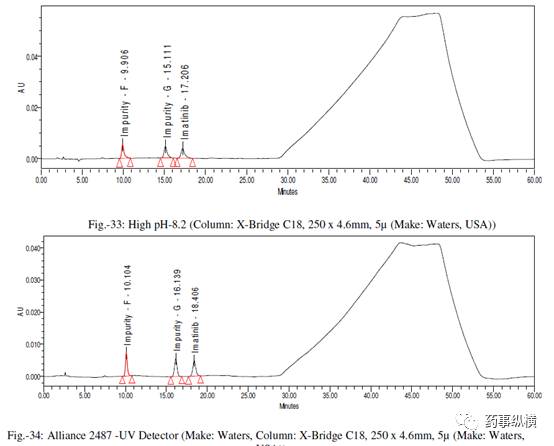
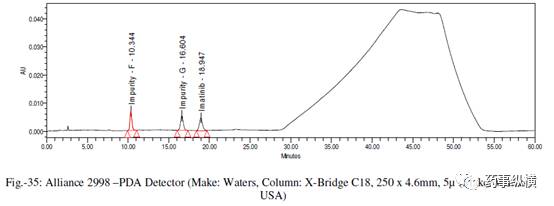
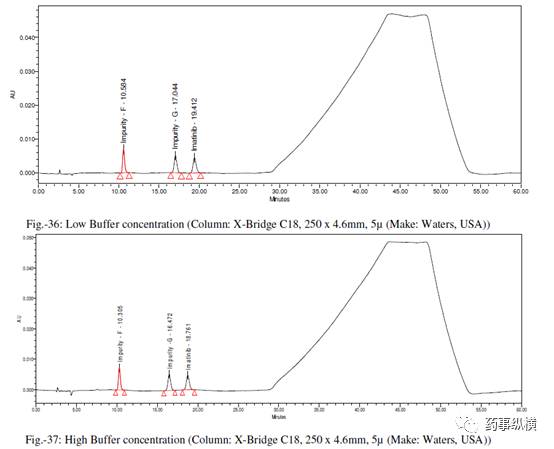
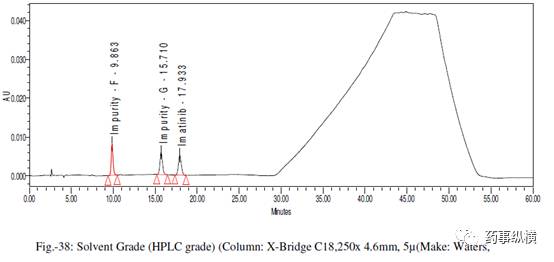
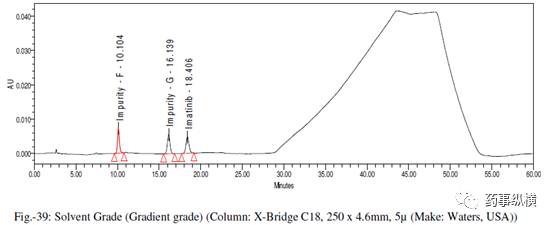
表 14. 粒径改变测定结果
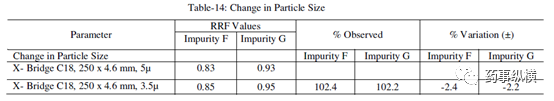
表 15. 流速改变测定结果
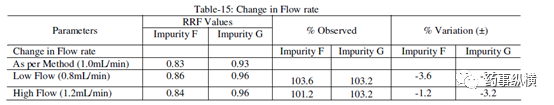
表 16. 柱温改变测定结果
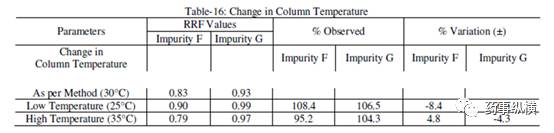
表 17. 检测波长改变测定结果
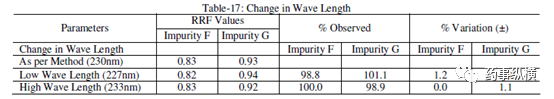
表 18. 流动相 pH 改变测定结果
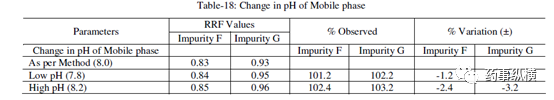
表 19. 检测器改变测定结果
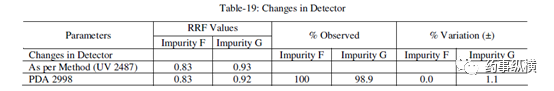
表 20. 检测器改变测定结果
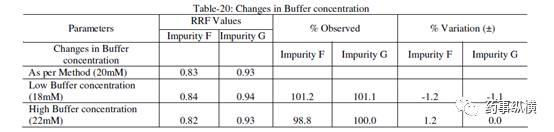
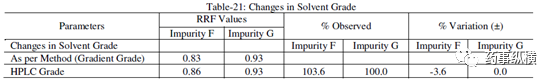
表 21. 溶剂级别改变测定结果
本文通过改变不同色谱柱和耐用性参数来研究对相对响应因子(RRF)的影响。在不同色谱柱研究中,采用了不同生产厂家相同固定相的色谱柱。
结果表明,
伊马替尼及其杂质的保留时间变化非常大,RRF值发生了显著变化。
这是因为每个色谱柱生产厂家所使用的硅胶是不同的,每个色谱柱在相对保留、疏水性、硅羟基效应等方面都有所不同,引起了 RRF 的变化。
在改变柱温和流速时,RRF 值也发生了显著变化。而在改变检测器、溶剂级别、检测波长、色谱柱粒径、流动相 pH值、缓冲液浓度时,RRF 值发生了发生轻微变化。检测器的能量也会影响 RRF 值。
药典并没有规定在什么情况在可以将 RRF 值修约到 1.0,申请人有时把 0.80-1.2 修约到 1.0;有时把 0.90-1.1 修约到 1.0;也有时把 0.95-1.05 修约到 1.0。
药典中,一般情况下,RRF 值如果大于等于 1.0,则保留 1 位小数;如果小于1.0,则保留 2 位小数。
EP 规定如果校正因子在 0.8-1.2 范围外,应在专论中进行规定。
BP 规定如果校正因子值小于0.2或大于5,则是不能使用校正因子的。
当杂质和主成分具有不同的响应值时,也可以使用不同的检测波长或不同的检测方法对杂质进行研究和测定。
相对响应因子(RRF)在杂质研究中是一个常用的参数,对于杂质测定非常重要! RRF 对有些色谱参数的变化非常敏感,会发生变化,因此当测定RRF值时,应采用相对准确的色谱条件。
注:本文为药事纵横编辑翻译,译文版权归药事纵横所有。点击阅读原文即可获取英文PDF。
药事纵横是一个开放,由自愿者组成的团体,现有成员14名,分别为Voyager88,雷诺岛,三分话,Herman,Mzwinsunny,文竹,duke,巉巉之石,蓝色枫叶,ISAL,海角边,冯姝婷,yhqqqqq,陈小牛,欢迎有志之士加入我们团队。投稿、加专业微信群【合成、制剂、分析、注册、BD、一致性评价】请加微信442015666,QQ群:22711855/22711679(限加一个)





