分析人员在制剂研究中应做好哪些工作?如何在看似枯燥的工作中提升发展自己?刚刚从事分析的人员从哪些方面进行切入?作者结合案例和工作经历进行一个简要分析,抛砖引玉,欢迎讨论!
1.
研究
API
的降解途径
拿到一个新项目,在未开始具体试验前,应检索参比制剂相关信息,
API
中英文献、
FDA
评估报告、日本
IF
文件、国内外药典质量标准,并
对文献中
API
的降解杂质、降解途径和机理进行汇总
,包括固体状态、溶液状态等多种情况。如果为衔接前人的项目,还应对已有数据进行系统分析和总结。
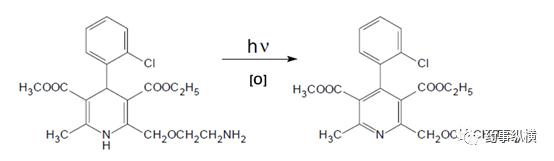
例如根据文献报道,氨氯地平在光照、氧化条件下会产生相同的降解杂质(见图
1
)。
 图
1.
氨氯地平的降解途径和降解杂质
图
1.
氨氯地平的降解途径和降解杂质
在对不同溶出曲线进行考察时,会遇到不同
pH
值的溶液,
供试品在不同
pH
值溶液中的稳定性如何?
这些需要进行考察,采用
API
进行考察即可。有时
API
在对照品溶液中的稳定性也需要研究(见图
2
)。
如果制剂工艺中采用了湿法制粒、高温干燥、微分化等工艺,那么
API
在这些条件下有无降解,其中某种水解杂质是否有增加,晶型在溶解或干燥的过程中有无晶型的转化,这些都是要分析人员要了解的。
当工艺中可能会接触湿、热、光照等与条件时,应对中间产品或中间体的贮藏时间、贮藏条件进行考察,掌握其降解程度、条件的敏感性,采用好必要的保护措施。
图
2.
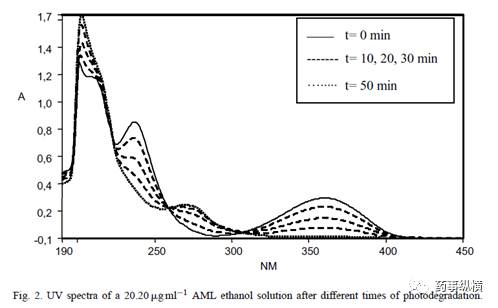
氨氯地平的乙醇溶液光稳定性考察
在对降解杂质、降解途径进行研究时所采用的方法应具有较好的专属性
,在制剂处方开发早期,可在杂质谱分析的基础上选择药典或文献中比较成熟的方法。
进行降解途径研究中,应重点关注或确认在某种条件下的降解情况与国内文献是否一致,
如氧化、酸碱水解、光照、高温、高温
+
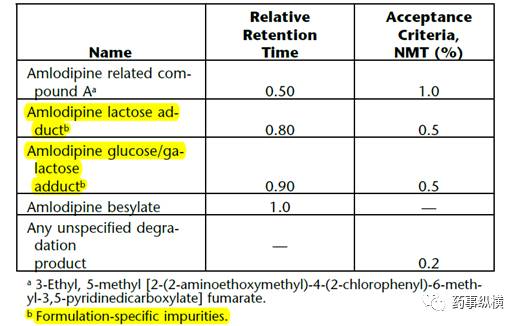
高湿等条件。如根据原辅料相容性基本原理分析,有可能存在相互作用,那么应该选择出恰当的检测方法,如氨氯地平
USP
方法就可以检测乳糖、葡萄糖、半乳糖和氨氯地平的加合物(见表
1
),这些杂质与所采用的处方有关,如果有的标准中没有规定这些杂质,说明可能没有采用乳糖等辅料,因此
制剂的杂质分析与
API
是有一定差异的,需要结合处方工艺甚至加速长期试验结果一起去分析
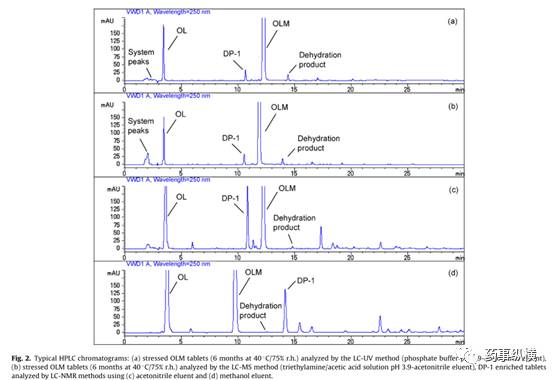
(见图
3
)。
表
1. USP
氨氯地平片有关物质限度表
图
3.
奥美沙坦酯片加速
6
月降解杂质
DP-1
研究图谱
在
API
的降解途径研究阶段,
对文献检索是否全面?理解与把握是否到位?非常重要,不仅要求分析人员要具有较高的检索能力,更需要具有较高的英文阅读能力、逻辑分析能力。
不要仅仅从
“
检测样品
”
的角度去考虑问题,需要站在整个项目的宏观角度,
“
质量研究
”
的角度去考虑问题,需要主动配合制剂进行分析研究。
2.
研究
API
的溶解性和溶液稳定性
制剂样品中
API
的溶解性和溶液稳定性影响着最终质量标准的建立、过程中制剂样品结果的准确性。
那些对于原料药检测中用到的溶解溶剂,对于制剂而言则不一定适用,如某
API
有关物质溶剂为纯乙腈,但是制剂中由于辅料的影响使用纯乙腈往往会导致
API
的溶解度降低,这时可能需要考虑在有机相中加入少量水相来增加制剂中主药的溶出和溶解,但是溶液稳定性仍要进行考察。
当
API
为手性药物需要检测异构体时,如果必须采用正相系统,那么
API
在异丙醇、无水乙醇、正己烷等中的溶解度也是需要重点考察的,
这有助于在方法开发过程中评估所采用的溶剂、样品处理方式。
通常同一份溶剂,单独
API
的溶解度会比
API+
辅料的溶解度大,但这也与
API
的结构式、处方中辅料的种类和量有关,有些辅料能够改变最终溶液的
pH
,影响
API
的溶解度。
分析人员应该了解
API
的结构式以及
pKa
、溶解度、
pH
依赖性等特点,也要了解处方中所用的辅料的名称、性质、用量情况,
不要在做制剂分析时连处方组成还不清楚。
分析人员有时在样品配制过程中可以测定一下溶液的
pH
,这可能有助于方法的开发与建立。
如某药物在酸性条件下(如
pH
值
1-2
)条件下稳定,而制剂溶液由于辅料的原因溶液发生了
pH
改变,那么其稳定性就可能会受到影响,导致结果不准确,所以应该对溶剂进行优化筛选考察。
样品溶液(如含量、含量均匀度、溶出、有关物质等)的稳定性在检测中很重要,分析人员需要评估溶液是否稳定,可以采用归一化法,考察在室温、冷藏、避光等条件下的稳定性情况,如果不稳定,应了解降解速度如何?有哪些降解产物出现?主峰面积变化
%
(通常认为含量、溶出等主峰面积
RSD
小于
2.0%
可以接受)?哪些条件可以减少或避免降解?选择低温保存样品、在短时间内测定、使用
UPLC
、还是短色谱柱可以解决稳定性问题吗?
3.
多掌握一些原辅料相容性知识
辅料本身是一种具有某种官能团的化学物质,这些官能团在制剂的正常贮藏条件下或加速条件下可能与
API
发生相互作用,
因此辅料不能认为是惰性的。
辅料中常见的影响因素有水分、
pH
值等,当主药对湿度敏感时,水分限度就是一个关键的因素,因此有时需要控制辅料中水分的含量。许多药物的水解反应或氧化反应均受
pH
值的影响,因此
当发现这种影响存在时,不同厂家来源的辅料或不同型号的辅料就需要考察和制定内控标准。
常见辅料官能团及其功能见表
2
。
表
2.
常见的辅料基团及其功能
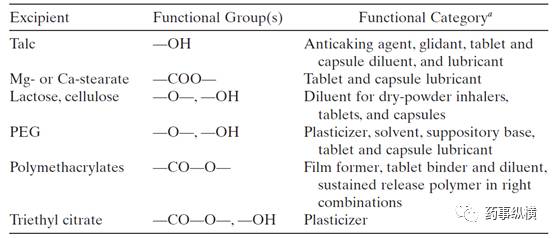
如果辅料与主药相互作用,产生的杂质分子量可能比主药大,也可能比主药小,这意味着在
HPLC
中可能比主药先出来,也可能后出来,离子型的杂质可能就先洗脱出来(比如氨氯地平的加合物杂质),对于中性的杂质可能后洗脱出来。
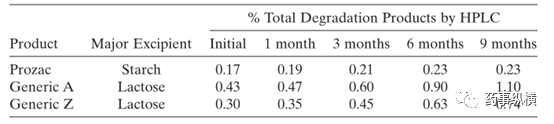
乳糖和盐酸氟西汀会发生作用,这是一个典型的美拉德反应。
参比制剂与两个仿制药在加速条件
(40°C/75% RH)
对比研究表明,降解杂质不一致,研究表明这
与辅料的类型和处方中的用量有关
(见表
3
)。
表
3.
盐酸氟西汀制剂在加速条件
(40°C/75% RH)
的稳定性对比
原辅料相容性试验对制剂有关物质等检测方法选择和优化,以及质量标准的建立具有重要提示或指导意义。
4.
多了解一些
HPLC
法在制剂分析中的应用
HPLC
法是制剂分析中最常用的方法,因此应该多了解
HPLC
法的特点,如反相色谱、正相色谱、离子对色谱法;熟悉并慢慢积累各种检测器的类型和应用特点,如
ELSD
、
RID
、
UV
、
PDA
、
FLD
、
CAD
等,可以用于没有
UV
吸收、有
UV
吸收、弱
UV
吸收等物质的检测。
不同的试验目的关注重点是不一样的。
通常
HPLC
法有如下应用:
(
1
)批检验和稳定性考察:
鉴别、
溶出度、
有关物质、
异构体、
含量均匀度、
含量测定
(
2
)工艺验证:
混合均匀度、
溶出曲线
(
3
)清洁验证:
需要灵敏度较高、专属性好的
HPLC
法
在有关物质研究中,制剂生产或稳定性中产生的杂质应进行研究和控制,
HPLC
方法应能够对所有已知杂质和未知杂质进行分离,具有一定的专属性(空白辅料不干扰、与有关物质分离、峰纯度符合要求)、重复性(精密度)、定量(线性、范围、
LOD
、
LOQ
、回收率),耐用性较好。有时原料药所使用的有关物质方法适用于制剂,有时不适用。
当工艺杂质、降解杂质较多时可以考虑在原料药的方法基础上进行优化,重点考察辅料干扰情况、溶剂选择情况。
5.
认识降解试验的作用
通常,降解试验具有如下作用:
(
1
)方法开发与验证阶段考察方法的专属性
(
2
)快速确定
API
和制剂的降解途径,降解杂质
(
3
)识别哪些是
API
的降解杂质,哪些是
API
与辅料相互影响才产生的降解杂质
(
4
)考察
API
的稳定性和对某种条件的敏感性
(
5
)考察
API
和制剂在液体或固体状态下的稳定性
(
6
)研究在高于加速条件下
API
或制剂的稳定性,指导包材的选择和贮藏条件
(
7
)研究
API
或制剂在热、酸碱水解、氧化、光照、高温高湿等条件下的降解机理
在做降解试验时,每种药物的降解条件都是不一样的,指导原则自然不会规定具体的降解条件。在处方工艺开发过程中,分析人员应该研究降解条件,最好应多次进行重复,考察其重现性(特别是当采用降解溶液作为系统适用性溶液的时候),可以采用制剂也可以采用
API+
辅料的形式。降解程度一般为主药降解
5%-10%
,但有时如果发生明显的次级降解也可适当降低程度。
一般降解条件为:
(1)热:室温、
40
℃、
50
℃、
60
℃
(2)光:
ICH
指导原则
(3)湿:
75%RH
(4)酸:
0.1mol/L
盐酸
(5)碱:
0.1mol/L
氢氧化钠
(6)氧化:
3%
H
2
O
2
、
AIBN
、
BPO
等
(7)湿热:
50
℃
+75%RH
需要注意的是,分析人员应清楚每一项降解的机理和程度,与分成人员进行好沟通,不宜降解过度,导致降解试验失真。
有些降解试验结果不一定能够真实反映出来,需要体现出一定的相关性和预测性。
6.
关注样品溶液的制备方法
有些制剂分析中,采用已有标准中的供试品溶液制备方法,不一定能够对主药进行完全提取。如果理论分析某总混样品中主药含量应为



















