医药市场是政策市场。仿制药产品立项的政策影响因素中,医保目录的调整特别是产品“调入”绝对是各大药企重点关注对象。止吐药和止恶心药多拉司琼注射剂剂型,新纳入2017年医保目录乙类,医保限制为“限放化疗且吞咽困难患者的二线用药”,正符合企业蹭政策热点立项的好项目。
文|道鸣
一直以来止吐药和止呕药的市场在全国样本医院市场保持10亿以上的规模。多拉司琼2011年上市五年样本医院就突破1.2亿元的规模,进入医保目录后销售翻倍可期。

通用名甲磺酸多拉司琼注射液(DolasetronMesylateInjection)在国内只有辽宁海思科制药一家企业上市,作为独家产品,不少企业自然垂涎三尺,希望加以仿制。然而这个产品到底能仿制吗?
 参比制剂怎么整?
参比制剂怎么整?
2015年CFDA药品注册法规改革,根据新规,化学药仿制药被定义为仿制原研产品的产品,在我国申报上市要和原研药质量和疗效相一致。甲磺酸多拉司琼注射液最早是Hoechst Marion RousselInc.研发并在1997年6月在澳洲上市,随后1997年7月在德国和瑞士上市,1998年在美国上市。安万特公司(现在是赛诺菲-安万特公司)接手开发,原研厂家至今未在国内上市。

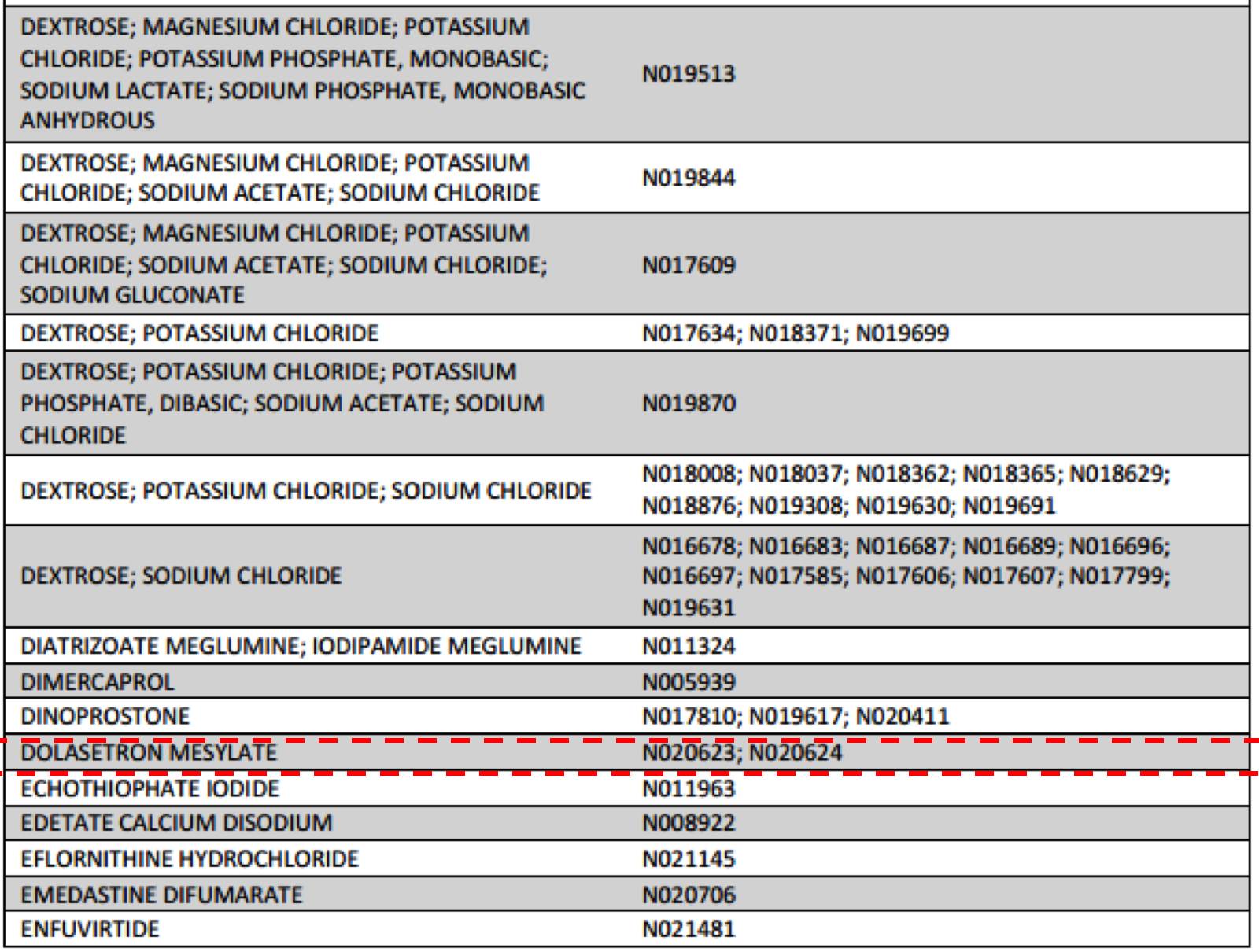
无论是注射剂再评价还是仿制药一致性评价,国内厂家要仿制此产品首先要找准原研厂家目前的规格。分析CFDA总局已发布的六批仿制药参比制剂目录,发现总局发布的参比制剂都是要对应到规格的。
甲磺酸多拉司琼注射液国内已上市的规格为1ml:12.5mg和5ml:100mg。从FDA网站查询结果可知,甲磺酸多拉司琼注射液批准了三个规格,分别为5ml:100mg、0.625ml:12.5mg和25ml:500mg,其中25ml:500mg已退市。可见目前国内已上市的2个规格中只有1个即5ml:100mg与原研一致。按新法规,海思科上市的1ml:12.5mg为非原研规格,将无法被仿制,如此一来,海思科可享受独家规格市场。
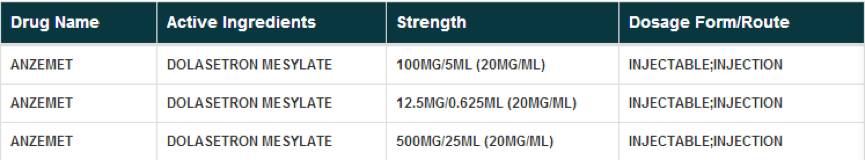
那5ml:100mg此规格国内生产厂家可以仿制吗?按照新药品注册分类管理办法,仿制药事要做到与原研质量和疗效一致,质量和疗效的比对首先要获得原研作为参比制剂。甲磺酸多拉司琼注射液的原研为US PHARM HOLDINGS公司生产的ANZEMET。据深圳市欣妍生物技术有限公司总经理刘爱军介绍,有几家药企询问购买这个药的原研制剂,但从去年十月开始,ANZEMET注射剂的参比制剂在全球范围内已买不到了,包括德国产的仿制药都买不到了。这点多家参比制剂供应商都给出了相同的信息反馈。CFDA最看中的根红苗正的原研厂家生产的原研药理论上已买不到了。
 为什么买不到原研制剂?
为什么买不到原研制剂?
阅读FDA网站ANZEMET注射剂的说明书,可以发现,2011年版的说明书虽然保留了术后恶心呕吐(PONV)的治疗和预防的适应症,但是2009年说明书治疗癌症化疗时引起的恶心和呕吐的适应症已经没有了。
2009年说明书:ANZEMET还有治疗癌症化疗时引起的恶心和呕吐的适应症。https://www.accessdata.fda.gov/drugsatfda_docs/label/2009/020624s020lbl.pdf

2011年的说明书:ANZEMET仍可用于术后恶心呕吐(PONV)的治疗和预防,但不能治疗癌症化疗时引起的恶心和呕吐。
https://www.accessdata.fda.gov/drugsatfda_docs/label/2011/020624s022lbl.pdf

ANZEMET注射剂的停产缺货是否与该适应证被拿掉导致市场萎缩还是其他的原因呢?
根据FDA公布地方2014年版的说明书,ANZEMET注射剂能引起心律失常(尖端扭转型室速),该病很可能致命。有心律问题或潜在风险的患者发生心律失常的风险较高。Anzemet会根据剂量引起QT、PR及QRS间隔延长等反应。

https://www.accessdata.fda.gov/drugsatfda_docs/label/2014/020624s025lbl.pdf
是市场原因还是新发现的这些不良反应导致该品种不再生产亦不得而知。然而确定的是,这个品种的参比制剂是拿不到了。拿不到参比制剂,仿制就变得不可能。当然,也不排除有厂家买来海思科的产品去无知无畏地做参比制剂进行仿制。海思科此产品2个规格有望凭着参比制剂买不到而享受国内独家生产身份独享市场,这是政策变动带来的杠杠的红利。
 按新3类还是新4类仿制?
按新3类还是新4类仿制?
假如,甲磺酸多拉司琼注射液的原研制剂ANZEMET恢复了生产,是可以买到的,企业去申报仿制,是按新的3类还是4类去报呢?
根据CFDA发布的2016年3月4日《总局关于发布化学药品注册分类改革工作方案的公告(2016年第51号)》,化学药品注册分类新3类是指“仿制境外上市但境内未上市原研药品的药品”,新4类是指“仿制境内已上市原研药品的药品”。由于甲磺酸多拉司琼注射液原研药在国内未曾上市,毫无疑问,无论找不找到参比制剂,想要申报新的仿制,都需要按新3类的要求申报。注射液的仿制没有BE之忧,以前老6类可以直接拿海思科的产品进行仿制报产,作为一个新3类品种是否还需要做至少100对的临床试验是个问题。
 注射剂一致性评价的影响
注射剂一致性评价的影响
2017年5月,总局关于征求《关于鼓励药品医疗器械创新实施药品医疗器械全生命周期管理的相关政策》(征求意见稿)意见的公告(2017年第54号)首次提出要开展上市注射剂再评价。

国家准备用5-10年的时间基本完成已上市注射剂再评价工作,对于海思科,这意味着有望享受5-10年的市场独家独占期。10年内慢慢完成没有原研药上市的一致性评价工作。怎么评价?可以参照国内特有品种的方式,按照2017年4月5日CFDA总局仿制药质量和疗效一致性评价品种分类指导意见(2017年第49号),企业选择可重新开展临床试验证明其安全有效性。根据现有的信息,这个品种只要投入经费去做一致性评价,不通过的可能性不大。
海思科一旦获批一致性评价并被列为参比制剂,国内其它厂家就可以仿制海思科的产品,那会是N年以后的事情了。不会有谁等一致性评价之后有了参比去做仿制吧?
 到美国申报仿制去
到美国申报仿制去
2017年6月美国FDA公布了至今仍没有企业或研发机构提出申请准备仿制研发的170种即将或已经到期的原研药目录,其中就有这个甲磺酸多拉司琼(Dolasetron Mesylate)。FDA正准备开放和鼓励仿制药研发,让更多制药企业以公开竞争方式获得仿制研发权益,从而有更多的仿制药上市,通过市场竞争机制来左右药品的最终价格导向。
https://www.fda.gov/downloads/Drugs/ResourcesForYou/Consumers/BuyingUsingMedicineSafely/UnderstandingGenericDrugs/UCM564441.pdf
FDA政策的鼓励说明甲磺酸多拉司琼注射液这个产品的停产或撤市并非是因为安全性的原因被FDA终止。那么,如果FDA批了第一家国外药厂的首仿,虽然不是原研,仍可被列为RLD,国内的仿制就有了参比制剂。我国生产厂家若在美国FDA上市,也可以通过境内共线生产并在欧美日上市品种获得一致性评价在国内上市抢夺海思科的市场。对于没有原研产品作为参比制剂的情况在FDA申报仿制是否需要做临床研究是另一个问题。
 法规变化造就的独家产品
法规变化造就的独家产品
2015年以前我国化学药仿制药对质量的要求没有严格到要和原研质量和疗效一致的高度,许多产品在药品注册积压年代由于排队顺位等原因变成了独家产品,甲磺酸多拉司琼注射液则因为参比制剂的不可获得成为医保独家产品。此品种并非是唯一。进入2017年医保目录乙类的因卡磷酸二钠注射剂同样因为原研制剂无法买到而“被独家”。截止至2017年7月13日,2015年以后这两个产品均无生产厂家申报仿制。对已有的生产厂家而言,这是法规大变带来的市场“独占期”,这是可遇不可求的天大的政策红利。对于其他厂家而言,望洋兴叹的声音不时可以听到。像甲磺酸多拉司琼注射液这样的医保独家产品,为了药品的可及性,未来CFDA是否也会像FDA那样,将其列入短缺品种目录并给予“优先审评”的资格呢?
会讯
电子通用技术文档(eCTD)申报 8月4-5日 南京















