BioArt按
:
作为哺乳动物中唯一的III 型磷脂酰肌醇激酶(PI3K-III),VPS34催化底物磷脂酰肌醇(PI)磷酸化生成的3-磷酸磷脂酰肌醇(PI3P)为自噬小体(Autophagosome)形成所必需。迄今的研究表明,VPS34与其调控蛋白作用形成VPS34-p150-Beclin 1核心复合物是激活其活性的主要机制。近日,
Molecular Cell
杂志在线发表来自浙江大学医学院
刘伟
教授研究组题为“VPS34 acetylation controls its lipid kinase activity and the initiation of canonical and non-canonical autophagy”的研究论文,
发现依赖乙酰转移酶p300的乙酰化修饰在VPS34激活中的关键作用,阐述了这一新机制在启动经典自噬和非经典自噬中的重要意义, 结果提示其对细胞内膜运输的潜在重大影响。
值得一提的是,刘伟教授是我国自噬领域的代表性学者,这是该课题组近两年多来,在
Molecular Cell
杂志上发表的第三篇自噬调控相关论文。2015年1月,该课题组阐述了核内LC3蛋白脱乙酰化修饰在自噬泡形成中的重要意义及其调控机制;2015年11月,该课题组组发现了一条激活组蛋白脱乙酰化酶Sirt1启动细胞自噬的新的信号途径。

论文解读:
细胞自噬(Autophagy)是真核生物特有的进化上高度保守的依赖于溶酶体的细胞内分解代谢途径,不仅是细胞感知能量缺乏和应激条件的适应性反应,而且参与很多重要的生理过程,在细胞稳态的维持中发挥关键作用(
“自噬”获诺奖为何只授予大隅良典?——梳理自噬领域重大发现历程
)。
自噬与组织器官发育、个体衰老、细胞免疫、肿瘤和神经退行性疾病的发生等密切相关。自噬发生需要经过自噬小体的形成、自噬小体与溶酶体的融合和自噬底物在溶酶体降解等过程。自噬小体的形成是自噬发生和完成的关键调控步骤,是当前细胞自噬研究的热点内容。
自噬小体的形成需满足两个条件:一是定位内质网膜的VPS34激活催化PI生成PI3P,PI3P在内质网膜局部的富集造成自噬前体的发生,主要受AMPK-mTORC1-ULK1通路调控;二是重要自噬蛋白LC3与磷脂酰乙醇胺(PE)共价结合,形成具有膜结合能力的LC3-PE,促进自噬前体的延伸,主要受蛋白乙酰化/脱乙酰化信号调控(
图1
)。已有研究表明,细胞内蛋白乙酰化水平的降低能充分诱导自噬小体的形成,这提示细胞乙酰化水平的改变除了调控LC3-PE的生成外,还能潜在调控PI3P的产生。而最近的研究发现,在特定应激条件下,细胞能不依赖于AMPK、mTORC1或ULK1等蛋白/蛋白复合物启动自噬。这促使研究人员研究蛋白乙酰化修饰直接调控VPS34活性的可能性。
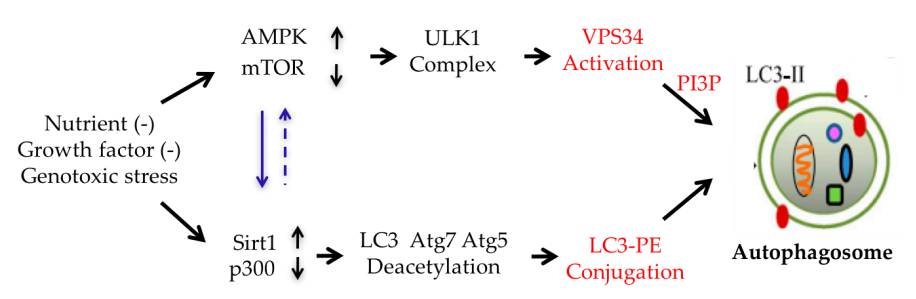
图1 自噬小体形成的必要条件
该研究中,研究人员通过基因高表达、基因敲低/敲除、体外乙酰化反应、质谱分析和位点突变等手段发现组蛋白乙酰基转移酶p300能直接乙酰化VPS34,并鉴定出K29、K771和K781是VPS34上的主要乙酰化位点。接下来,他们通过改变p300活性、制备应用VPS34模拟乙酰化和脱乙酰化突变体,结合免疫荧光实验和一系列体外脂激酶实验发现,乙酰化能抑制VPS34脂激酶活性,K29、K771和K781位点的脱乙酰化对VPS34的激活发挥协同效应,K771位点的脱乙酰化对VPS34的激活起决定作用(
图2
)。
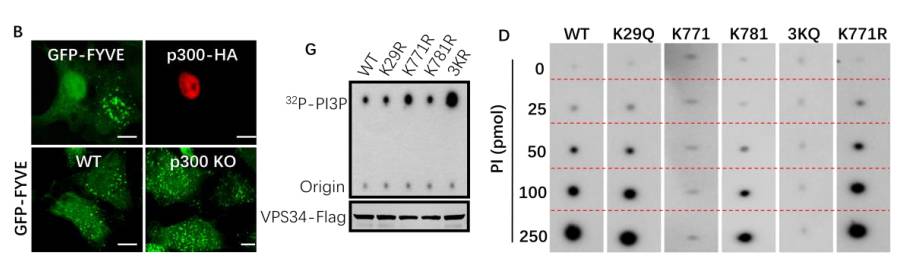
图2 VPS34乙酰化调控其脂激酶活性
为揭示乙酰化修饰调控VPS34脂激酶活性的分子机制,他们首先检测了乙酰化是否调控VPS34复合物的形成。出乎意料的是,只有K29位点的乙酰化抑制核心复合物VPS34-p150-Beclin 1的形成。那么K771和K781位点的乙酰化为何能显著调控VPS34活性呢?通过蛋白结构模拟、运用含有PI的脂质体,结合脂质体沉降实验和蛋白质-脂质分子结合实验,他们发现K771和K781位点的乙酰化虽然不会影响VPS34核心复合物的形成,但却直接左右VPS34与其底物PI的结合,脱乙酰化能显著和直接地增强VPS34-PI的亲和力,从而解释了K771位点乙酰化对VPS34活性的决定性调控作用,由此揭示了一个新的VPS34脂激酶活性调控机制。
继而,研究人员检验了该p300-VPS34途径在细胞自噬启动中的作用。令人兴奋的是,p300-VPS34途径除了在营养缺乏诱导的经典细胞自噬中发挥作用外,对不依赖于VPS34 上游信号分子(AMPK、mTORC1或ULK)的非经典自噬的启动至关重要(
图3
)。这一发现为非经典自噬中自噬小体的形成提供了强有力的理论依据,也为深入研究非经典自噬的信号调控奠定了重要基础。此外,研究人员还发现,该p300-VPS34途径还参与VPS34相关的自噬小体与溶酶体的融合和内体至溶酶体的运输。进一步的生理功能研究表明,这条途径在小鼠肝脏自噬和肝细胞脂滴的代谢中发挥重要调控作用。
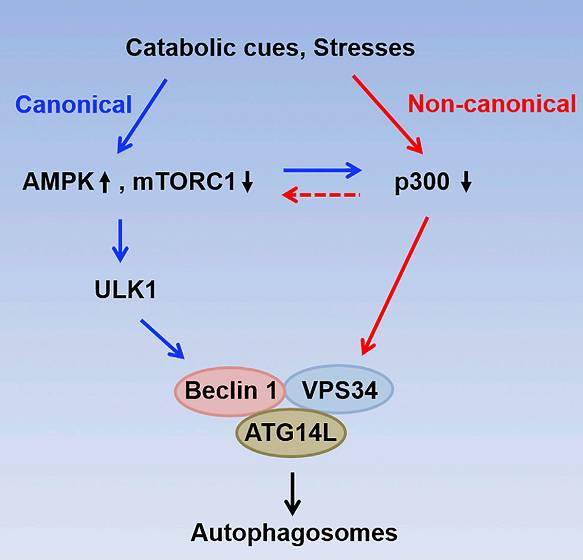
图3 p300-VPS34途径参与调控经典和非经典自噬的启动
综上所述,该研究发现并鉴定p300是VPS34的关键乙酰化酶,VPS34的乙酰化修饰对其活性、经典自噬和非经典自噬的启动等至关重要。该研究不仅为进一步研究自噬启动的分子机制、细胞能量营养代谢与细胞内膜运输的关系提供了新思路,还有助于我们深入了解自噬相关人类疾病的发生机理。
据悉,
刘伟
教授研究组的博士生
苏华
是本文的第一作者。该研究得到了国家自然科学基金重点项目和国家重点基础研究发展计划的资助。
参考文献
1.
Su H, Yang F, Wang Q, Shen Q, Huang J, Peng C, Zhang Y, Wan W, Wong CC, Sun Q, Wang F, Zhou T, Liu W (2017) VPS34 acetylation controls its lipid kinase activity and the initiation of canonical and non-canonical autophagy.
2.
Huang R, Xu Y, Wan W, Shou X, Qian J, You Z, Liu B, Chang C, Zhou T, Lippincott-Schwartz J, Liu W (2015) Deacetylation of nuclear LC3 drives autophagy initiation under starvation.
Mol Cell
57, 456–466.
3.
Chang C, Su H, Zhang D, Wang Y, Shen Q, Liu B, Huang R, Zhou T, Peng C, Wong CC, Shen HM, Lippincott-Schwartz J, Liu W (2015) AMPK-dependent phosphorylation of GAPDH triggers Sirt1 activation and is necessary for autophagy upon glucose starvation.
Mol Cell
60, 930–940.
4.
Marino G, Pietrocola F, Eisenberg T, et al. (2014) Regulation of autophagy by cytosolic acetyl-coenzyme A.
Mol Cell
53, 710–725.
5.
Codogno P, Mehrpour M, Proikas-Cezanne, T (2011) Canonical and non-canonical autophagy: variations on a common theme of self-eating?
Nat Rev Mol Cell Biol
13, 7–12.

刘伟
,现任浙江大学医学院教授,医学院生物化学系主任,“浙江省有突出贡献中青年专家”,求是特聘教授。1987年毕业于第四军医大学空军医学系,1998年在日本名古屋大学获医学博士学位。1998至1999年在名古屋大学从事博士后研究,1999年至2001年任日本爱知医科大学助理教授,主要从事肿瘤细胞信号转导和细胞凋亡方面研究。2001年至2007年在美国国家卫生研究院(NIH)美国科学院院士Jennifer Lippincott-Schwartz实验室,开展了细胞内囊泡运输和高尔基体结构及功能研究,运用GFP和实时动态荧光漂白等细胞内可视化手段,在活细胞内系统研究了囊泡包被复合体的动力学,提出了新的COPI coat在高尔基体膜上形成和解聚模型。2007年受聘浙江大学医学院教授、博士生导师,建立了以细胞器结构和功能为研究中心的细胞器生物学实验室。目前的主要研究方向是细胞自噬的分子细胞学机制和自噬与肿瘤的发生。近5年来,以通讯作者身份在包括
Mol Cell
(3篇),
J Cell Biol, Autophagy, Hepatology
等杂志上发表多篇研究性论文。















