
当前,药物晶型问题已经成为了创新药、仿制药在研发过程中必不可少,甚至是至关重要的环节之一,倘若晶型这关过不了,那么创新药的成药性就会遭到质疑,仿制药的注册申报也会危险重重。近年来,国内针对药物晶型问题也展开了一系列的讨论,尤其是由中国药理学会、中国晶体学会、中国医学科学院药物研究所联合主办的《中国晶型药物研发技术学术研讨会》,为药物晶型、晶型药物的发展奠定了基础并给予了一定的总结指导,让晶型问题更加具体化、实际化。许多仿制药物也随着晶型问题的解决得到了与国外药物生物活性方面的一致,创新药物也因晶型的透彻研究得到了强有力的效果佐证,而晶型专利保护、晶型表征方法、优势晶型的选择等技术能力更是得到了强劲的发展,国产药物 “吃进去还要拉出来”的虐心词语,终将一去不复返,而药物晶型研究水平的国际化也将接踵而来。
我们知道,药物分子通常具有多种排列方式,不同的排列方式构成了不同的晶型,即药物的多晶型现象,其一般表现为药物原料在固体状态下的存在形式。一种药物可以有多种晶型,同一种药物的不同晶型,在体内的溶解和吸收可能不同,自然会影响其制剂的溶出和释放,进而影响临床疗效和安全性。
因此,药物晶型问题会直接关系到药物的质量和疗效,研究药物的多晶型及其性质,具有多方面的意义和价值。通过多晶型研究,可以保证药物在制备、贮存过程中的晶型稳定性;选择药用优势晶型制备药物,可以改善药物的溶出速度和生物利用度,提高药物的治疗效果,也可能减小毒性;根据晶型的特点确定制剂工艺,改善药物粉末的压片性能等,可有效保证生产的批间药物等效性;通过选择在临床治疗上效果可靠且稳定可控的晶型,可以制备高效、低毒、安全、优质的口服固体制剂,等等等等......
据智慧芽专利检索,近30年来药物晶型这一技术领域在中国专利申请数量上的整体趋势:1985~1994年,在此期间该类专利总体申请量仅为30件(占总量0.8%),每年仅提出几件专利申请;1995~2004年,专利申请总量为471件(占总量12.4%),年均申请量为47件,年均增长率达114.9%;2005~2014年,专利的总体申请量高达3009件(占总量78.9%),年均申请301件,而年平均增长率高达147.9%。
各国申请人在中国的药物晶型领域的专利申请情况:中国2116件,占总量55.5 %,位居首位;美国651件,占总量17.1%,德国、印度和瑞士3国平均申请量为144件(共计432件,占总量11.3%)。可以看出,中国、美国、德国、印度及瑞士排名前5位国家的专利申请高达总量的83.9%,而其余国家或地区申请量仅占16.1%。
国内方面,恒瑞医药集团与诺华制药各申请了62件晶型专利,并列第一;中国医学科学院药物研究所、青岛蓝盛洋医药科技、天津药物研究院、上海医药工业研究院等多家制药企业或研究机构在晶型专利的申报量上也高达40多件;此外,苏州晶云药物科技公司作为一家成立于2011年的专注于药物晶型开发的科研企业,其在短短的4年中,申报了30余件晶型专利。
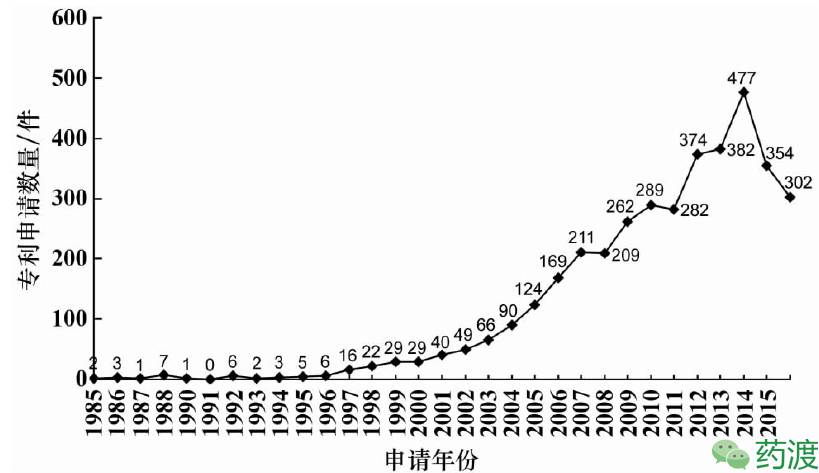



图1.近30年国内药物晶型发展情况(数据来源于智慧芽)
如何表征、确定一种药物的多种晶型,在药物研发过程及技术突破方面尤为重要。药物的多晶型包括药物的不同晶态、溶剂化物(水合物)、无定型,常用的表征手段有粉末X-射线衍射法(XRPD)、单晶X-射线衍射法、热分析法(差热分析法、差示扫描量热法以及热重分析法)、红外分光光度法、拉曼光谱法(RAMAN)、热台显微镜法、固态核磁共振法、溶解度测定法等。
X-射线衍射
分析方法能够较全面地提供固体晶型药物分子结构、分子排列规律、分子构象变化、分子间作用力,能够直观显示晶型的指纹性特征,是有效区分多晶型的重要手段。其中,单晶X射线衍射分析是以1颗单晶体作为研究对象,可提供药物晶型物质一定量分子立体结构信息和表征不同晶型药物的特质特征,而XRPD分析技术是以无数粉晶物质(晶态与无定型态)样品作为研究对象,以物相分析理论为基础,可用于物质状态、物质成分、晶型状态、晶型纯度、晶型质量控制等分析。
对于溶剂化物或者水合物的表征,
热重分析法(TGA)与差示扫描量热法(DSC)
的综合应用则具有简单快捷的评价功能。由于药物多晶型现象可能造成外观、熔点、溶解特性、稳定性和生物利用度等方面显著不同,最终可能导致药物疗效及安全性出现差异,因此在候选化合物的研发早期充分地了解药物的多晶型及其性质,将有助于提高候选化合物的成药性评价效率。

图2.三种常用表征方法的比较
首先,“优势药物晶型”是指在固体化学药物存在多种晶型状态的情况下,其中稳定性符合药用要求、临床疗效最佳、安全性最高、最适合用于制备药品的晶型状态。可以说,新药物晶型的发现是研究优势药物晶型的基础,而对于已经发现的不同晶型固体物质进行生物活性评价,则是晶型药物研究的重要内容,也是确定优势药物晶型临床作用的关键科学依据。药物晶型研究的最终目标是要获得固体化学药物的“优势药物晶型”,这是一个涉及到化学、物理学、生物学及分析学等多个交叉学科研究范畴的科学难题。
优势药物晶型的重要条件之一是具有良好的
生物学活性和临床治疗效果
。由于不同药物晶型的物理性质、化学性质和生物学活性等存在显著差异,从而影响到药品的临床作用以及药品安全性,优势药物晶型应该是一种可以产生最佳临床疗效的药物晶型存在形式,这种优势药物晶型与其他晶型固体物质状态具有更高的安全性和临床有效性特征。优势药物晶型的另一必备条件是晶型物质的
稳定性
。由于固体化学物质不同晶型的物理性质存在差异,尤其是其能量状态有明显的不同,其稳定性也有所不同,因此,选择符合制药要求的稳定性晶型,是选择优势药物晶型的重要条件。当然,对于物质的晶型稳定性,在药物制备过程中由于工艺条件的变化和辅料的应用,会直接影响药物晶型稳定性,所以,优势药物晶型的稳定性是指在复杂条件下的综合稳定性比较。
优势药物晶型除上述2个必备的条件外,还应具备的条件包括药物
制备工艺
可实施性和
质量
可控制性。工艺可实施涉及晶型制备的技术和条件,需要进行全面的研究,而质量可控制性则是指可以有效控制药物制剂中的晶型状态。优势药物晶型的研究内容包括药物晶型状态的理化性质、生物活性、制备技术、控制条件等方面,因此,评价优势药物晶型,是一项涉及化学、分析、生物等多学科的复杂研究任务。

图3.优势药物晶型的选择
国外~
欧美等发达国家经过长期的研究和探索,较早就在药品注册管理中对药物多晶型制定了详细和科学的管理规范,包括人用药品注册技术国际协调会议(ICH)在Q6A部分就药物晶型的质量研究规范和要求制定了较系统的管理办法;欧洲药品管理局(EMA)以及美国食品药品监督管理局(FDA)则分别参照依照ICHQ6A的规范,对原料药和药品质量控制中的晶型问题也制定了相应规定,包括从药物研发、生产和管理的各个阶段注重固体药物晶型的问题。此外,欧美药典很早就重视药物晶型检测标准的制定,收载的晶型药物品种也较同时期中国药典多,如2015年版《英国药典》中,“显示存在多晶型”的品种有195个(但并非一定要制定晶型控制项目,只是提醒在制剂开发过程中需注意晶型问题);同样2015年生效的《欧洲药典》8.0版中,“显示存在多晶型”的则为163个品种;而在2014年《美国药典》37版,按“X-射线粉末衍射法”查询,共搜索到23个品种;按“结晶性”查询,共有93个品种,两者总和约为116个品种。
国内~
在2000年版《中国药典》中,对固体药物晶型鉴别和检验的技术与方法收载甚少,仅列有甲苯咪唑等极少数几个品种;在2005年版的《中国药典》中,虽然关于药物晶型的内容有所增加,但仍然没有形成完整的技术体系,收载的晶型药物品种仍极为有限;2010年版《中国药典》(二部)中按“晶型”查询,共有2个品种~棕榈氯霉素、甲苯咪唑,按“结晶性”查询,除青霉素类和头孢类抗生素外,还有4个品种~盐酸米诺环素、丝裂霉素、利福平和盐酸大观霉素;在最新的2015版《中华人民共和国药典》第4部通则中,我国首次制定了“药品晶型研究及晶型质量控制指导原则”,明确要求当固体药品存在多晶型现象,且不同晶型状态对药品的有效性、安全性或质量可产生影响时,应对药品固体制剂、半固体制剂、混悬剂等中的药用晶型物质状态进行定性或定量控制;要保证药品的有效性、安全性与质量可控。
参考文献:
1.N Chieng,T Rades,J Aaltonen. An overview of recent studies on the analysis of pharmaceutical polymorphs[J]. Journal of Pharmaceutical & Biomedical Analysis, 2011 , 55 (4) :618-644.
2.EH Lee. A practical guide to pharmaceutical polymorph screening & selection[J]. Asian Journal of Pharmaceutical Sciences, 2014, 9(4) :163-175.
3.P Láng,E Várkonyi,J Ulrich,et al. Analysis of the polymorph changes of a drug candidate[J]. Journal of Pharmaceutical & Biomedical Analysis, 2015, 102: 229-235.
4.K Raza,S Ratan,M Kumar,et al. Aceclofenac polymorphs: Preparation, characterization and intestinal permeation studies[J]. Journal of Drug Delivery Science & Technology, 2017,39: 69-74.
5.陈东英,刘瑞丽,徐雪娇,等. 创新候选药物晶型的质量控制研究策略探讨. 中国晶型药物研发技术研讨会暨中国晶体学会药物晶体学专业委员会成立大会, 2011.















