作者 l 放翁是水货
编辑 l 细胞房间
和其瑞和拜耳达成PRL受体抗体的临床开发合作协议
4月8日,中国,Hope Medicine今天宣布已与拜耳公司签署了一项全球独家许可协议,旨在开发和商业化靶向PRL受体的抗体药物,用于治疗因PRL信号传导失调引起的雄激素性脱发,子宫内膜异位症和其他慢性病。PRL受体抗体是一种在研新药,以非竞争性方式阻断PRL受体介导的途径。该药物可以经皮下给药,在此前的临床研究中抗体耐受性良好。

Celltrion和iProgen Biotech公司协作开发新型抗体偶联药物
4月8日,韩国,Celltrion和iProgen Biotech公司宣布达成研发合作,共同开发靶点确定的新型抗体偶联药物。根据合作协议条款:Celltrion将生产和供应包括靶点为HER2和CD20的4种重组抗体,并提供所有临床前研究所需资源,iProgen公司将推进候选药物在各地区开展人体评估研究。iProgen公司专有抗体递送技术(抗体递送增强结构域,ADED)能够通过增强药物递送量和癌细胞内化来增加抗肿瘤功效,运用ADED技术构建的抗HER2 ADC药物,不仅可以更有效地治疗HER2高表达的乳腺癌患者,还可以治疗那些抗原低表达的患者。
三特异性免疫激活剂GTB-3550获准开展首个人体临床研究
4月8日,美国,GTBiopharma公司今天宣布已获得批准开展其候选药物GTB-3550治疗急性髓性白血病的首个人体临床研究。此次研究将招募60名CD33阳性受试者,主要目的是确定该药物的最大耐受剂量,次要指标包括完全缓解率和安全性等。GTB-3550是针对治疗AML开发的Tri-specific Killer Engager (TriK
E)候选产品,是一种单链、三特异性scFv重组融合蛋白缀合物,其由抗CD16和抗CD33抗体的重链和轻链的可变区以及IL-15的修饰形式组成。

Ascentage和君实生物联合开发肿瘤治疗新疗法
4月8日,中国,Ascentage Pharma今天宣布与君实生物进行战略合作,探索细胞凋亡蛋白(IAP)抑制剂APG-1387和抗PD-1疗法toripalimab在实体和血液肿瘤中的潜在协同作用。APG-1387是一种新型的小分子IAP抑制剂,正在开发用于治疗晚期实体瘤和慢性HBV感染。君实生物的抗PD-1疗法toripalimab已经在中国获得有条件地上市批准,用于治疗不能切除或转移的黑色素瘤。

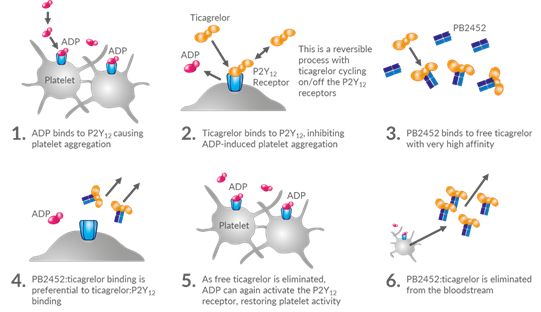
新型预防出血药物PB2452获得突破性疗法认证
4月8日,美国,PhaseBio公司今天宣布FDA已授予PB2452在逆转替卡格雷在大出血和紧急手术情况下的抗血小板活性方面突破疗法称号。PB2452是一种新型重组人单克隆抗体-抗原结合片段,现有的I期临床数据显示其可以逆转替卡格雷在大出血和紧急手术情况下的抗血小板活性,表明其可以降低出血风险,及时挽救生命的治疗效益。
阿帕替尼联合camrelizumab治疗肝癌的临床试验在美国获得批准
4月9日,LSK BioPharma和江苏恒瑞医药今天宣布已获得美国食品和药物管理局批准,在美国开展一线晚期肝细胞癌(HCC)患者的临床试验,评估LSK的rivoceranib(VEGFR-2抑制剂)与恒瑞的camrelizumab(SHR-1210)联合应用治疗肝癌的的安全性和有效性。目前,恒瑞正在开展一项II期研究评估camrelizumab和apatinib联合治疗中国晚期HCC患者的疗效和安全性。
罕见病药物eculizumab的仿制药在俄罗斯获批上市
4月9日,瑞士,Selexis和Generium今天宣布,第五款SUREtechnology™生产的eculizumab生物类似药已经在俄罗斯获批上市用于阵发性睡眠性血红蛋白尿症(PNH)和非典型溶血性尿毒症综合征(aHUS)的治疗。Eculizumab是由美国罕见病生物制药公司Alexion研制,该药是一种首创的补体抑制剂,通过抑制补体级联反应的C5蛋白发挥作用。补体级联反应的不受控激活在PNH、aHUS、抗乙酰胆碱受体(AchR)抗体阳性的重症肌无力(MG)、视神经脊髓炎谱系障碍(NMOSD)等罕见病中发挥了重要作用。
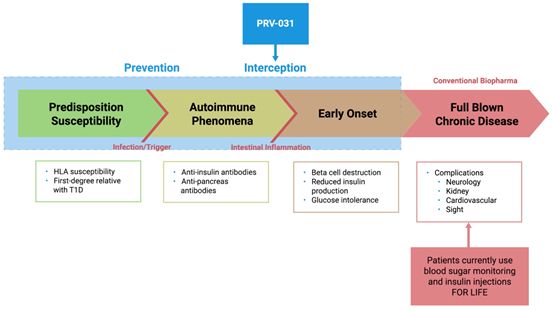
1型糖尿病候选药物teplizumab正式开启III期临床研究
4月9日,美国,Provention生物公司今天宣布其目前正在开展的teplizumab治疗1型糖尿病(T1D)的关键III期临床PROTECT研究已经迎来第一位受试者接受治疗。该研究以新诊断六周内的8-17岁儿童和青少年T1D患者为评估对象,旨在证实teplizumab能够减缓产生胰岛素的β细胞的损失并保持β细胞功能。这项随机、双盲、安慰剂对照、多中心试验预计将招募约300名年龄在8-17岁的患者,主要功效终点是β细胞功能变化,次要终点包括胰岛素产生水平,糖化血红蛋白(HbA1c),低血糖发作频率和药物安全性。Teplizumab是抗CD3单克隆抗体,可用于1型糖尿病患者的缓解治疗,此前该药已经在1000多名受试者进行了有效性评估。
小编点评:Teplizumab与成熟T细胞上表达的CD3-ε链的表位结合,抑制不需要的效应T细胞并增强有益的调节性T细胞功能,从而促进免疫耐受,这一机制可以调节多种自身免疫疾病的免疫应答。如果teplizumab能够有效保存胰腺β细胞的功能,则患者注射胰岛素的评率将大大降低。Teplizumab疗法的特点在于诱导耐受而非广谱免疫抑制,这可能会引领未来自身免疫疾病管理模式改变。
Teva制药的TRUXIMA™(利妥昔单抗)在加拿大获批上市
4月10日,加拿大,Teva今日宣布加拿大卫生部已批准TRUXIMA™(利妥昔单抗)上市,用于治疗非霍奇金淋巴瘤(NHL),慢性病淋巴细胞白血病(CLL)和类风湿性关节炎(RA)。该药于2016年11月首次在韩国获得批准,TRUXIMA™的全部证据表明TRUXIMA™和RITUXAN®高度相似,并且TRUXIMA™和RITUXAN®之间在批准的适应症的安全性和有效性方面没有临床意义上的差异,随后的2017年欧盟委员会和2018年美国食品药品监督管理局分别批准了对应适应症。
EVENITY™(romosozumab-aqqg)在美国获批骨松的治疗
4月10号,美国,Amgen和UCB今天宣布FDA已批准EVENITY™(romosozumab-aqqg)用于治疗骨折风险高的绝经后妇女的骨质疏松症。FDA根据两项III期研究的结果批准了EVENITY的上市申请,在研究中,使用EVENITY治疗一年以上的患者新发椎骨骨折明显减少,且腰椎、全髋和股骨颈的骨密度(BMD)显著增加。骨质疏松症是一种严重的慢性疾病,影响着全世界数百万人的健康。EVENITY具有双重作用机制,既能增加骨骼形成,又能在较小程度上减少骨质流失,从而迅速降低骨折风险。
单抗混合物PSB205获批开展首个临床研究
4月10日,美国,Sound Biologics公司今天宣布FDA已经批准该公司在研新药PSB205的首个人体试验申请。PSB205是一种抗PD-1和抗CTLA4单克隆抗体的混合物,与双特异性抗体相比,其优势在于能够很好控制两种抗体的相对比例,并且每种抗体均单独设计,其在靶标覆盖、效应功能和药代动力学方面相较于双特异性抗体更具有优势。此次的人体试验主要在复发/难治性实体瘤患者中评估其药学特性和初步的临床疗效。

印度的曲妥珠单抗生物仿制药即将上市惠及更多患者
4月11日,印度,Intas Pharmaceutical今日宣布靶向HER2用于治疗乳腺癌的曲妥珠单抗生物仿制药Eleftha®即将上市,该仿制药的最高售价将比原研制剂降低约65%。对于HER2阳性早期乳腺癌患者,一般需要近18个周期的曲妥珠单抗的治疗,此类患者目前在印度的治疗费用超过10万卢比。即将上市的仿制药将使更多患者能够利用曲妥珠单抗治疗,极大缓解患者的治疗负担。
KEYTRUDA在美国获批单药治疗III期非小细胞肺癌
4月12日,美国,默克公司今天宣布FDA批准扩大KEYTRUDA临床用药范围,其可作为单药治疗没有EGFR或ALK基因组肿瘤畸变的III期非小细胞肺癌的用药。新疗法的获批是基于III期临床KEYNOTE-042试验的结果,在试验中KEYTRUDA单药治疗显示,与单独化疗相比整个研究人群的OS显着改善。
艾滋病候选药物Trogarzo®(艾巴利珠单抗)获得CHMP的积极推荐
4月12日,加拿大,Thera technologies今日宣布的艾滋病专家小组对于Trogarzo®(艾巴利珠单抗)治疗HIV感染予以了积极推荐。目前该积极推荐已经递交欧洲药品管理局,预计该药品有望在今年5月获批上市,为HIV感染患者带来新的治疗选择。
TRACON公司治疗血管肉瘤的III期临床因疗效未达预期而终止
4月13日,美国,TRACON Pharmaceuticals今天宣布其III期临床评估TRC105与帕唑帕尼联合治疗晚期或转移性血管肉瘤患者的TAPPAS试验并未在患者中显示出具有临床意义的疗效,根据独立数据监测委员会(IDMC)的建议,所有受试者的试验需要终止。
TRC105(carotuximab)是一种新型靶向内皮糖蛋白(endoglin)的抗体药物,内皮糖蛋白是一种在增殖的内皮细胞上过表达的蛋白质,对血管生成(新血管形成过程)至关重要。TRC105此前已经在美国和欧盟获得了治疗软组织肉瘤的孤儿药称号。
欢迎加入小编团队成为小编一员
请加小编微信号:wuwenjun7237
如有技术解读、行业洞见愿意分享













