1、仿制药抗生素如何选择参比制剂?
参比制剂是仿制药研发的“标杆”,质量研究中应与参比制剂(原研产品)进行全面的质量对比,包括:关键质量属性的对比、溶出一致性的对比、杂质一致性的对比等。如果可以获得原研产品,应首选国外上市的原研产品、其次为原研进口产品、最后为原研厂中国分厂产品,如果无法获得原研厂产品,可以参考如下思路进行:
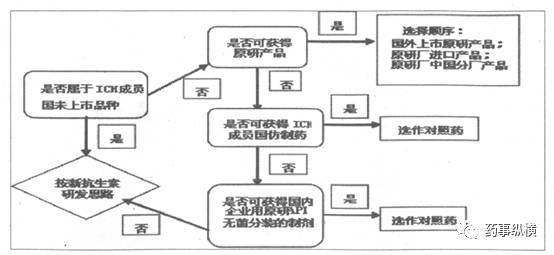
在申报时,参比制剂仍需提供获得途径以及相关证明性文件(如官方网站的批准信息、药品说明书、购买发票、一次性进口证明性文件、参比制剂实样、标签图片等等)。为了保证质量,仿制药中的杂质水平不应该高于参比制剂。
2、起始物料、中间产品如何进行研究?
无论对于合成或发酵的起始物料,均需制定相应的质量标准,严格控制质量。普通化学药起始物料的研究思路和研究指标同样适用于抗生素类药物。本公众号曾发表过占小兵的《起始物料质量标准研究》一文,可以参考。其中可能包括:基于合成路线进行的杂质谱分析,对有关物质、残留溶剂、基因毒性杂质、残留溶剂、元素杂质等进行充分研究和控制。发酵的起始原料也需要制定适宜的内控标准,包括含量测定、组分分布(如果相关)、有关物质(特定杂质、非特定杂质、总杂质)等。
对于关键中间产品,必须制定质量标准。如在有关物质检查项下,应包括特定杂质、单个未知杂质和总杂质的限度。应提供杂质谱分析和控制策略,结合多批次样品的检测结果,对潜在杂质进行分析,说明杂质是如何被除去的,哪些杂质会残留在后续产品中。此外,中间产品需要进行储存期的考察,并制定储存期。储存期的制定需要对中间产品进行稳定性考察试验,积累数据,可以参考WHO第992号技术报告附录4:保存时间研究通用指南的相关要求进行考察。
3、如何进行杂质对比研究?
(1)国内外质量标准汇总,进行不同方法的对比研究。对于仿制抗生素药物,需查询CP、EP、BP、JP、USP等国内外药典标准,列表进行分析方法的详细对比,如果存在差异,应进行充分的方法对比研究,如专属性、灵敏度和样品检测结果的对比。在此基础上,选择专属性好、灵敏度高、耐用的检测方法。方法筛选和选择是杂质控制的关键!
(2)杂质一致性研究。对于抗生素类药物,一般杂质含量较高、类别较多、来源复杂,因此与原研产品进行杂质谱的对比研究显得特别重要。抗生素类药物的仿制药与参比制剂的杂质对比研究时,不能简单的仅采用色谱技术进行研究,往往需要将HPLC-DAD及LC-MS-MS二者结合进行研究,这样可以从色谱、UV光谱、质谱(分子量、碎片特征)等多维度研究杂质的一致性。通过DAD能够获得杂质的光谱信息,判断是否与母核的结构类似,通过一级MS能够得到杂质的分子量信息,通过二级MS可以获得更多的碎片峰信息,比如有时可以推测有关各取代基的情况。最后将色谱、光谱、质谱三者结合分析验证推测结果是否正确。这其中分析人员要与合成人员一起分析,了解质谱的裂解规律。对于降解产物的对比,可以根据降解机理设计降解试验进行研究。在对结果进行分析时,应以列表的方式对结果进行汇总对比,分析杂质种类、数量、含量之间的差异,评价质量的差异。
胡昌勤在《药物杂质谱分析》一书中对醋酸麦迪霉素进行了LC-UV和LC-MS的研究,简要列举如下,供参考。
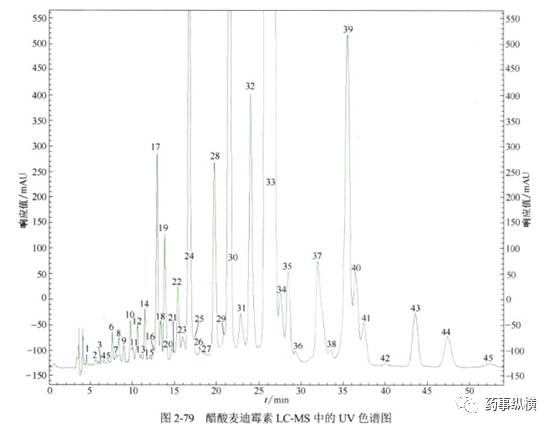
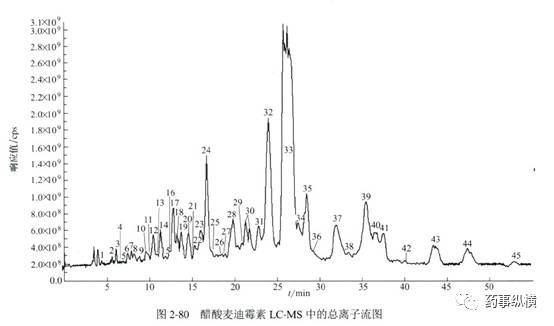
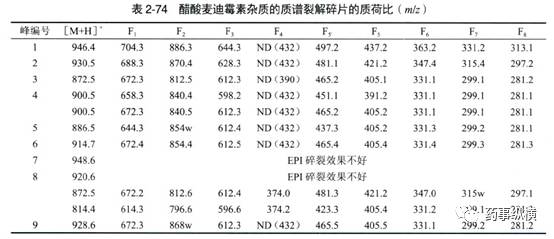


但是,LC-MS也有缺点,如只能使用挥发性流动相,非挥发性的缓冲盐进入MS后会造成离子源的污染。而大多数复杂样品的 HPLC方法都采用非挥发性的缓冲盐,因此无法直接进行LC-MS 分析。如果将非挥发性缓冲盐用挥发性缓冲盐代替,杂质的分离效果又难以保证,这一现象在复杂样品分离中尤为常见。柱切换除盐技术可以解决这一难题,使非挥发性流动相体系LC-MS在线分析成为可能,如下图所示。该除盐系统中有两个色谱柱,一个是用于复杂样品分离的分析柱(C1),另一个是用于除盐的捕获柱(trapping column,TC)。
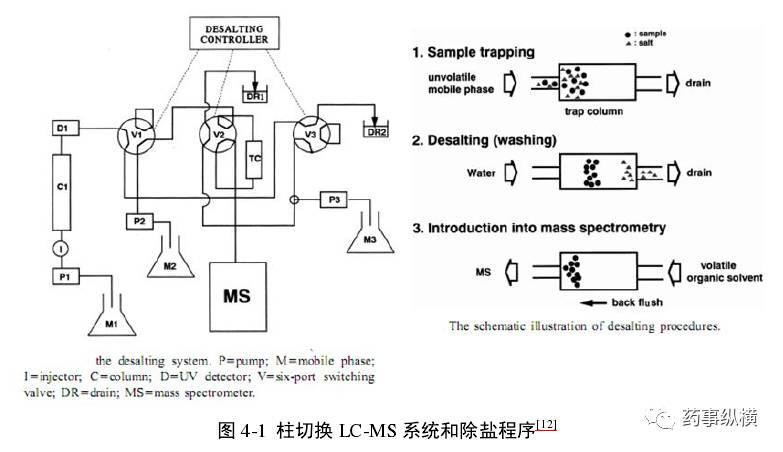
4.标准中如何对杂质进行归属和计算?
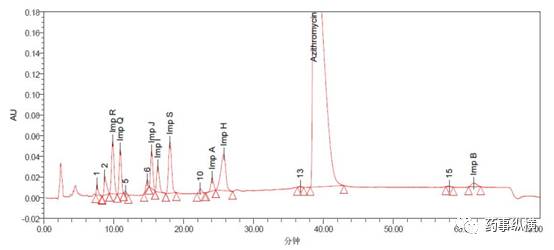
如果质量标准中需要规定的杂质较多、某些单个杂质对照品不易获得,则可以使用含有较多杂质的样品作为峰鉴别对照品进行杂质定位(样品中的定位杂质应经过结构确证),不宜单纯在标准中规定相对保留时间。如CP2015阿奇霉素有关物质项下中采用了阿奇霉素系统适用性对照品进行定位,明确了其中8个杂质的归属,值得借鉴,如下图所示:
在对杂质的含量进行计算时,首选外标法,其次为加校正因子的自身对照法。如使用校正因子,必须根据药典通则要求进行详细的方法学验证并经过药检所复核。
5.杂质限度如何制定?
通常,抗生素类药物杂质限度的制定会参考指导原则的相关规定或按照现行版国内外药典标准中的严格限度进行制定,一般包括4类:已知特定杂质、未知特定杂质、非特定杂质和总杂质。
目前,我国2005年颁布的《化学药物杂质研究的技术指导原则》中对原料药和制剂规定了杂质限度,如下图所示:
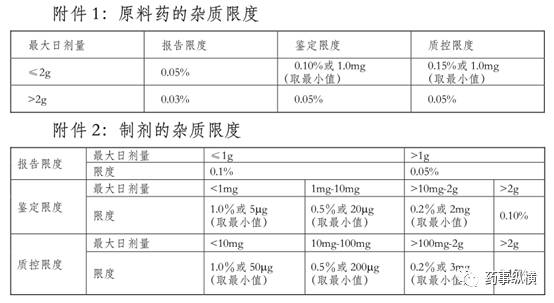
但是,在这版指导原则中明确说明:发酵工艺生产的抗生素类药物一般不包括在内。我国目前还没有专门关于抗生素类药物杂质研究的技术指导原则。
2012年7月EMA发布了《制订抗生素有关物质标准的指导原则》最终版“Guideline on Setting Specifications for Related Impurities in Antibiotics”,这版指导原则可供制定杂质限度时参考。
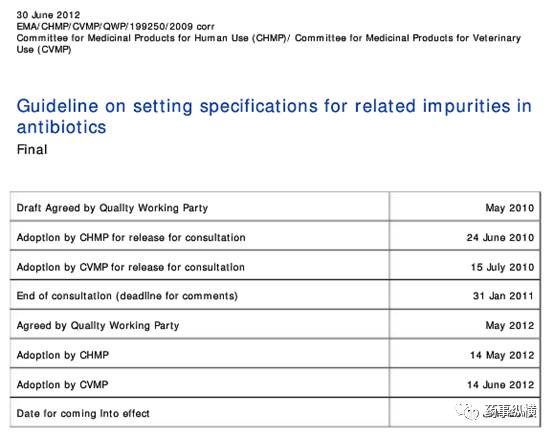
其中对于人用药品,杂质限度规定如下:
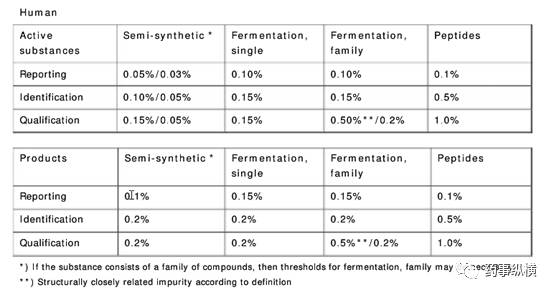
此外,对于杂质概况很复杂、不能对每个杂质进行鉴别的情况,如RRT窗口窄的一些杂质,指导原则中举例进行了分析,见下图。如果有杂质相近的类似情况可以参考。

两个批次的API的色谱图如下:
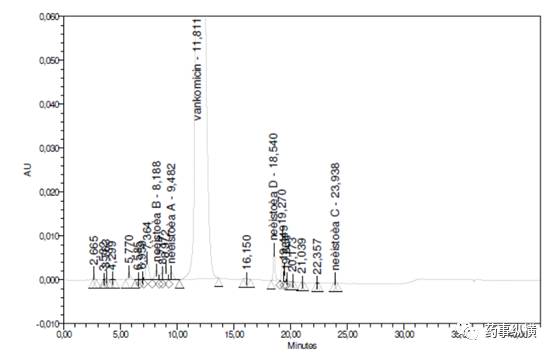
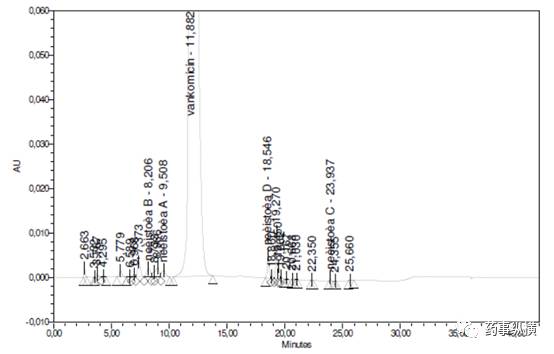
2015 年版《中国药典》抗生素的质控理念已经转变为以化学分析为主,生物学分析为辅;通过发展药品质量控制新技术、建立药物分析新方法,解决抗生素质量控制中的关键问题,将主导未来抗生素质量研究和质量标准制定的方向。
参考文献
1. 张哲峰.抗生素杂质控制的基本思路与策略.中国医药报,2015年5月19日,第006版
2. 胡昌勤.《药物杂质谱分析》
3. 张夏.杂质谱分析中复杂样品HPLC分析体系评价策略的探讨
4. EMA《制订抗生素有关物质标准的指导原则》Guideline on Setting Specifications for Related Impurities in Antibiotics
5. 胡昌勤.2015年版《中国药典》有关抗生素的增修订及其质量控制方向[J]. 中国药学杂志.2015,50 (20):1764-1769
更多干货尽在药事纵横网站,我们的网址是:www.pharmaguider.cn, 你可以点击原文链接一键直达。

药事纵横是一个开放,由自愿者组成的团体,现有成员14名,分别为 Voyager88(魏利军),雷诺岛,三分话,Herman,Mzwinsunny,文竹,duke,巉巉之石,占小兵,ISAL,海角边,yhqqqqq,陈小牛,鲁礼炎,欢迎有志之士加入我们团队。投稿、加专业微信群【合成、制剂、分析、注册、BD、一致性评价】请加微信442015666,QQ群:22711679











