EvaluatePharma预测了2022年肿瘤领域全球销售额TOP5的药物。从企业角度看,罗氏在肿瘤领域的霸主地位将受到极大的威胁,原因是大量生物类似药上市对罗氏主力产品Avastin,Herceptin和Rituxan造成了很大的冲击,罗氏未来几年的年均复合增长率将维持在1%左右,远远低于其竞争对手16%的平均值。总体讲,整个肿瘤市场将保持13%左右的复合年增长率,预计2022年市场总体量将达到1920亿美元。
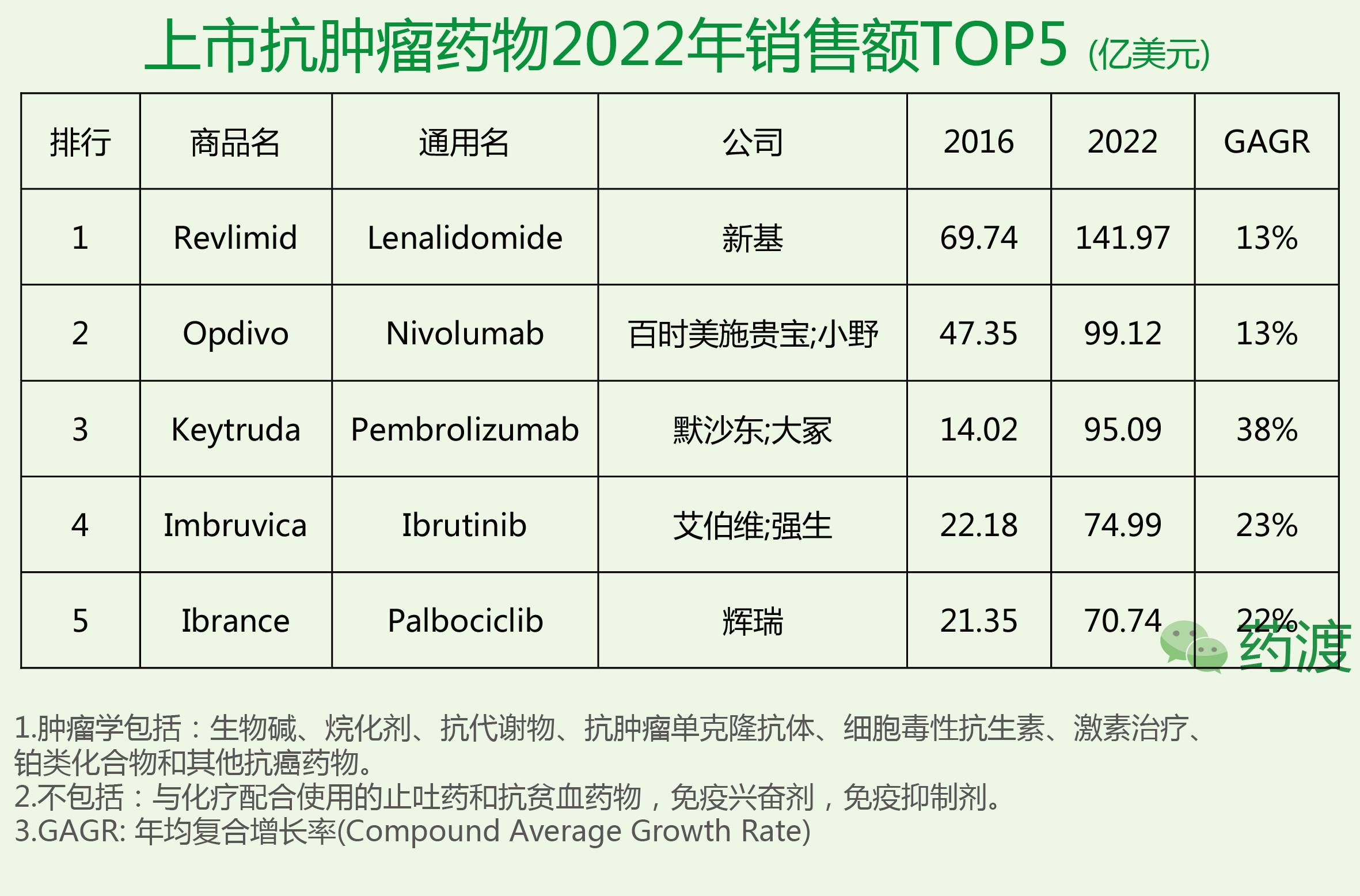
来那度胺由新基(Celgene)公司研发,首先于2005年12月27日获美国食品药品监督管理局(FDA)批准上市,然后于2007年6月14日获欧洲药物管理局(EMA)批准上市,之后于2010年6月25日获日本医药品医疗器械综合机构(PMDA)批准上市。由新基公司在上述各地上市销售,商品名为Revlimid®。
来那度胺是沙利度胺(thalidomide)类似物,具有免疫调节,抗血管生成和抗肿瘤特性。在多发性骨髓瘤细胞中,来那度胺和地塞米松(dexamethasone)协同作用,能够抑制细胞增殖,导致肿瘤细胞凋亡。该药与地塞米松联合使用,可用于治疗多发性骨髓瘤(MM);也可用于治疗已接受过至少一种疗法,因有5q染色体缺失、存在或不存在其他细胞遗传学异常的低风险或中度-1风险的骨髓增生异常综合征(MSD)所致的输血依赖型贫血,以及用于治疗已接受过包含一次硼替佐米疗法的两次治疗后的复发和进展性套细胞淋巴瘤(MCL)。
Nivolumab由小野制药(Ono)和百时美施贵宝(BristolMyersSquibb,BMS)联合研发,于2014年7月4日获得日本医药品医疗器械综合机构(PMDA)批准,2014年12月22日获得美国食品药品管理局(FDA)批准,2015年6月19日获得欧洲药物管理局(EMA)批准上市,并由小野制药和百时美施贵宝在美国、欧洲和日本共同销售,商品名为Opdivo®。
Nivolumab是一种全人源单克隆抗体,作为程序性死亡受体1 (PD-1)阻断剂,能结合PD-1并解除PD-1通路对T细胞的抑制作用。该药批准的适应症为不可切除的或转移性黑色素瘤、晚期或转移性肾细胞癌、转移性鳞状细胞非小细胞肺癌、经典型霍奇金淋巴瘤、晚期或转移性尿路上皮癌、处于铂类化疗期间或化疗之后的晚期转移性非小细胞肺癌和铂类化疗期间或化疗后疾病进展患者头颈部复发或转移性鳞状细胞癌。
Pembrolizumab由默沙东(MerckSharp&Dohme,MSD)研发,于2014年9月4日获得美国食品药品管理局(FDA)批准,2015年7月17日获得欧洲药物管理局(EMA)批准,2016年9月28日获得日本医药品医疗器械综合机构(PMDA)批准上市,并由默沙东在美国、欧洲和日本市场销售,商品名Keytruda®。
Pembrolizumab是一种人源化单克隆抗体,作为程序性死亡受体1 (PD-1)阻断剂,能结合PD-1并解除PD-1对T细胞的抑制作用。该药批准的适应症为晚期、不可切除的或转移性黑色素瘤、非小细胞肺癌和头颈癌。
依鲁替尼由美国Pharmacyclics和美国强生(Johnson&Johnson)研发,于2013年11月13日获美国食品药品监督管理局(FDA)批准上市,之后于2014年10月21日获得欧洲药物管理局(EMA)批准上市,由Pharmacyclics在美国上市销售,由强生在欧洲上市销售,商品名均为Imbruvica®。
依鲁替尼是第一种布鲁顿酪氨酸激酶(BTK)抑制剂。依鲁替尼可以与BTK活性位点中的半胱氨酸残基形成共价键,从而抑制BTK酶的活性。该药批准适应症为:①套细胞淋巴瘤(MCL)曾接受至少1次既往治疗;②慢性淋巴细胞性白血病(CLL)曾接受至少1次既往治疗。
帕布昔利布由辉瑞(Pfizer)研发,于2015年2月3日获美国食品药品管理局(FDA)批准上市,于2016年11月9日获得欧洲药物管理局批准,由辉瑞在美国及欧洲上市销售,商品名Ibrance®。
帕布昔利布是一种口服的细胞周期蛋白依赖性激酶(CDK4/CDK6)小分子抑制剂。该药被批准与来曲唑联合用药,用于治疗绝经后女性患者的雌激素受体阳性(ER+)及人表皮生长因子受体阴性(HER2-)的晚期乳腺癌。
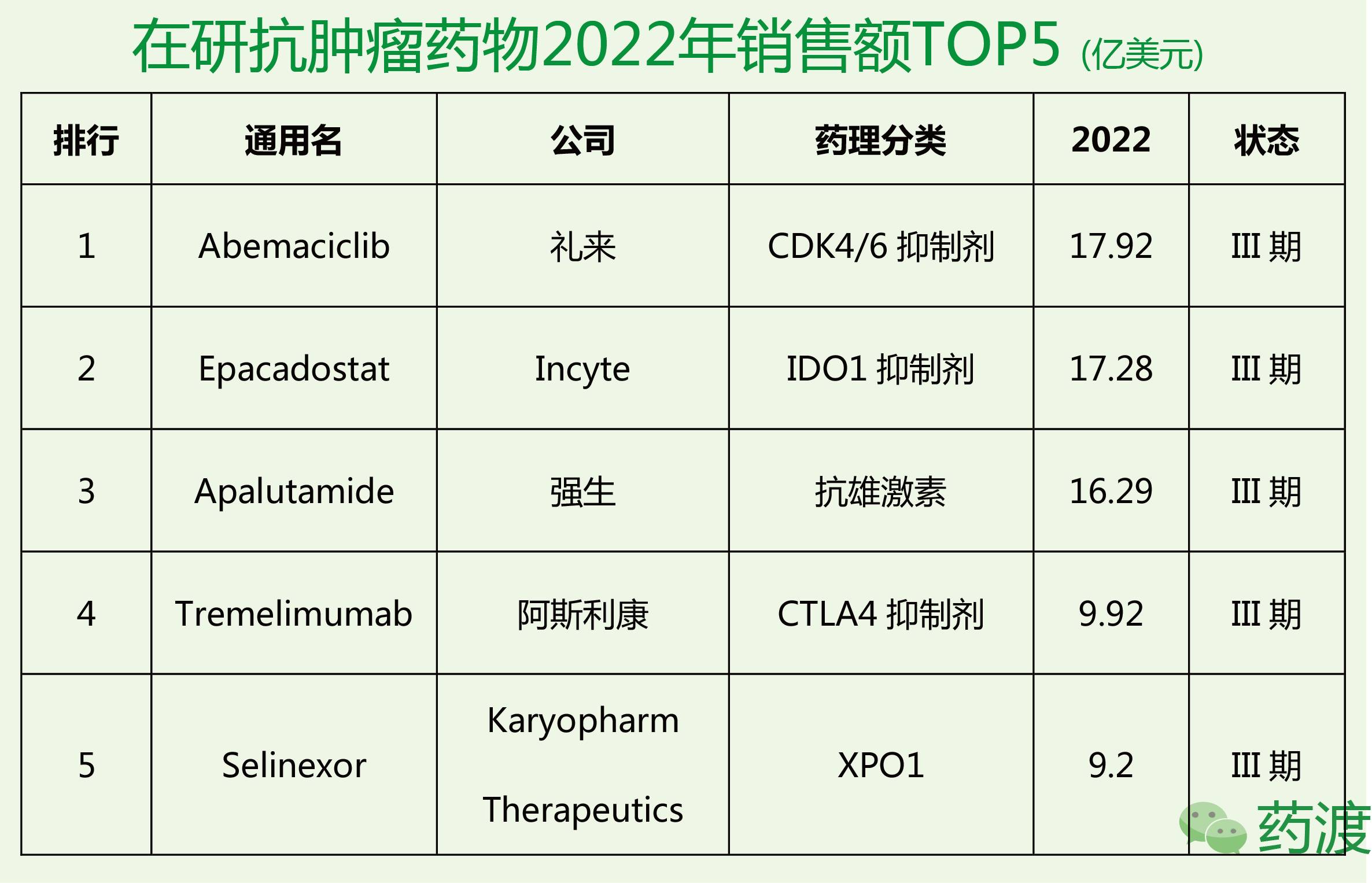
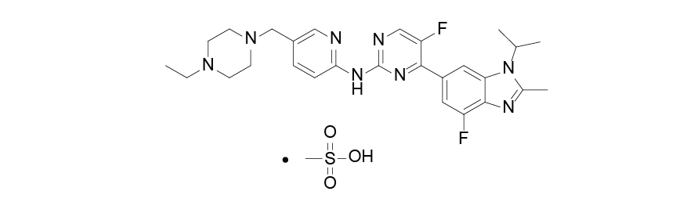
AbemaciclibMesylate由礼来公司研发,目前处于临床三期,用于治疗转移性乳腺癌和非小细胞肺癌。
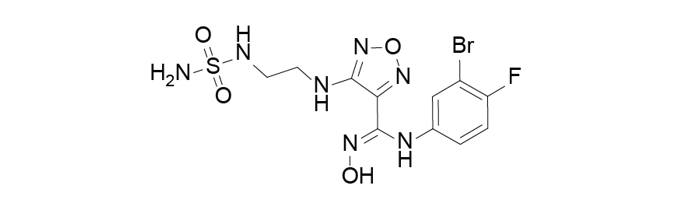
Epacadostat由Incyte研发,处于临床三期,用于治疗恶性黑色素瘤。用于治疗输卵管癌,非小细胞肺癌,卵巢癌和腹膜癌的研究处于临床二期。用于治疗其他实体瘤的研究处于临床一期。
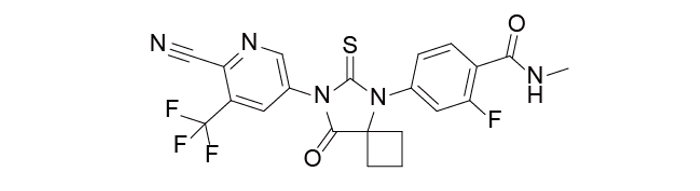
Apalutamide是由Aragon制药研发的一款小分子化合物。后来强生于2013年收购了该公司。该药治疗非转移性去势抵抗前列腺癌的研究,目前处于临床三期。
Tremelimumab是一种抗细胞毒性T淋巴细胞抗原4 (CTLA-4)全人源化单克隆抗体,能够阻断帮助肿瘤逃避免疫检查的信号通路。Tremelimumab通过结合表达于活化的T淋巴细胞表面的CTLA-4蛋白,刺激机体免疫系统对肿瘤细胞发起攻击。其适应症为非小细胞肺癌,恶性间皮瘤,头颈癌。
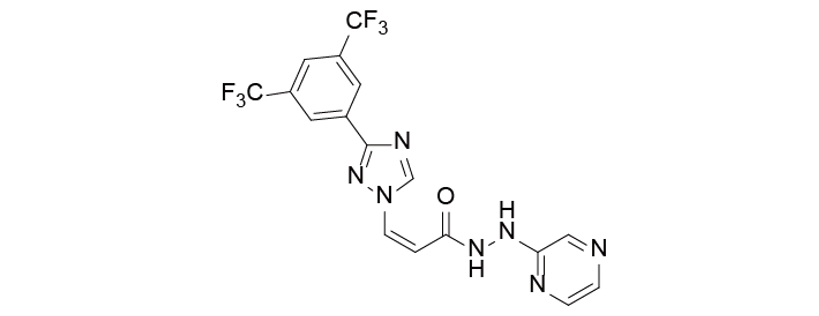
Selinexor由Karyopharm研发,处于临床二期和三期,用于治疗分化型肉瘤。
Selinexor处于临床二期,用于治疗急性骨髓性白血病与大B细胞淋巴瘤。2014年,该药因此两项适应症分别获得美国欧盟孤儿药资格。
该化合物用于治疗慢性淋巴细胞白血病、小淋巴细胞淋巴瘤(包括Richter's Transformation)与多发性骨髓瘤的研究,也处于临床二期。2014年,该药因这些适应症获得欧盟孤儿药资格。2015年,该化合物因治疗多发性骨髓瘤获得美国孤儿药资格。
该化合物的另一项研究也处于临床二期,用于治疗转移性乳腺癌,小细胞肺癌(SCLC),转移性前列腺癌(CRPC),鳞状细胞癌,多形性成胶质细胞瘤,骨髓异常增生综合征(MDS)与神经内分泌肿瘤。
参考
World Preview 2017,Out lookto2022
https://www.pharmacodia.com/药渡数据库