从测量的角度看,实验科学的发展其实就是一个不断提高测量精度的过程。精度提高一步,科学就前进一步。
这一点在分子生物物理中也不例外。有一类生物分子,一般称为
分子马达
,利用 ATP 水解产生的能量做轨道运动,完成其重要功能。
以 DNA 解旋酶为例,一般的理解是:解旋酶消耗一个 ATP,打开一对碱基,并沿着 DNA 向前移动一步。要定量刻画解旋酶的分子机理,测量精度至少要达到 0.3 nm,这是 DNA 双螺旋中碱基对之间的最小距离。
单分子荧光共振能量转移
(FRET)
是研究解旋酶分子机理的重要工具,它应用偶极子之间相互作用对距离敏感的原理,测量分子马达的运动。理论上讲,FRET 可以测量 0.1 nm 的距离变化。然而,当将 FRET 应用于 DNA 双链的解旋研究时,很少能在室温下的水溶液中逼近这一极限,以至于很难区分本来应该有很大差别的解旋酶
(图1a)
。
中国科学院物理研究所/北京凝聚态物理国家实验室(筹)软物质与生物物理实验室李明研究组多年来致力于发展单分子技术研究生物大分子的动力学,在
DNA凝聚和染色质组装
(JACS 2006,PRL 2012,JACS 2013,Mol. Cell 2016)
、
分子马达
(EMBO J. 2009,NAR 2014,NAR 2015)
以及
膜蛋白动力学
(Nature Comm. 2016)
等诸多方面取得了系列成果。这些研究的主线是通过高精度的单分子测量获取生物大分子的精细动力学信息。最近,该研究组的陆颖副研究员与博士生林文霞、马建兵等又将单分子荧光的测量精度提高了一大步。他们根据弹性力学计算,设计了一种称为“
纳米张力器
(nanotensioner)
”的 DNA 结构,将一小段 DNA 弯成一张弓,利用 DNA双 螺旋结构的弯曲弹性,将张力直接作用于待解开的 DNA 双链岔口,将 DNA 单链撑开并抑制其热涨落
(图1b)
。
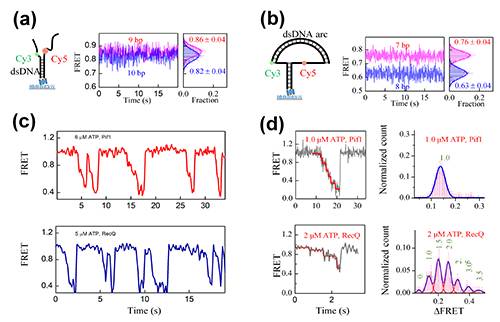
图1. (a)常规FRET实验中用带自由单链的DNA分岔结构作为底物,两个荧光分子的间距增加一个碱基对时,FRET效率只改变0.04。(b)用DNA张力器将自由单链撑开,两个荧光分子的距离增加一个碱基对时,FRET效率改变0.13。(c)常规FRET实验中,Pif1与RecQ的解旋数据类似,无法区分。(d)高精度实验中,两个解旋酶表现出完全不同的动力学性质。
他们将该方法应用于研究人源Pif1和大肠杆菌RecQ解旋酶。以往由于精度有限而看起来相似的解旋信号在新实验中表现得迥然不同。当然,表观上的不同并不意味着这些解旋酶完全不相干。高精度下测得的不同点,实际上隐含着更深层次的共同点。基于这个思路,他们提出了一个带普适意味的分子模型:解旋酶一次消耗一个ATP,破坏一对碱基的氢键;Pif1的氢键断裂与碱基释放同步,看起来一次解开一对碱基;RecQ的氢键断裂与碱基释放不同步,看起来一次解开随机个数的碱基对。该普适模型可以更准确更细致地刻画多种解旋酶的结构与功能的关系
(图2)
,加深了我们对分子马达的理解。这一研究成果发表在最新一期Physical Review Letters(PRL 119, 138102 (2017))上。
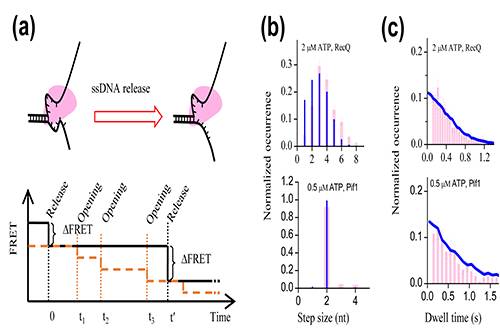
图2. (a)基于高精度实验结果提出的解旋酶的普适解旋模型:解旋酶消耗一个ATP,破坏一对碱基的氢键,但并不立即释放打开的碱基。不同的解旋酶释放碱基的速率依赖于其自身的结构,产生不同的表观解旋动力学特征。(b)模特卡罗模拟表明,通过调节碱基释放的速率,该普适模型可以解释Pif1和RecQ不同的解旋步进(左列)及其在每一步的等待时间(右列)的统计分布规律。
该工作得到了国家自然科学基金委(11674382, 11574382, 11574381),中国科学院前沿科学重点项目(QYZDJ-SSW-SYS014)以及中国科学院青年创新促进会的大力支持。
编辑:Cloudiiink
近期热门文章Top10
↓ 点击标题即可查看 ↓





