关于体内(动物)实验中
X
基因的下调、过表达的干预手段,你一般会选用什么实验方法呢?
这个是国自然研究内容、方案中需要仔细斟酌的一环。
来看看被毙的标书评审意见中,专家是怎么说的吧。
案例
1
:尾静脉注射,如何保证特异性作用?

案例
2
:尾静脉注射干预某基因的表达,如何保证特异性?

案例
3
:尾静脉注射无法保证特异性敲减某基因,可用基因小鼠
“
研究方案中使用
shRNA
腺病毒
(
AAV
)
对目标基因进行敲减,靶向性和效率都存在问题,建议使用基因鼠来设计研究方案
”
。
那么我们需要讨论两个问题:
(一)
用于基因治疗的
AAV
是什么?
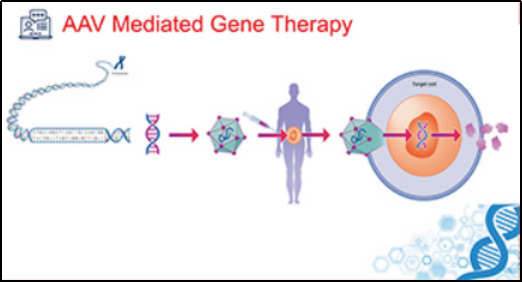
目前大多数基因治疗应用的仍是病毒载体,这些病毒载体经过改造后不具有致病性。广泛应用的病毒载体包括腺病毒载体(
ADV
)、
慢病毒载体(
LV
)
、单纯疱疹病毒载体(
HSV
)、痘病毒载体(
PV
)及
腺相关病毒载体(
AAV
)
。
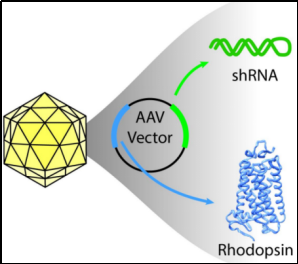
AAV
载体携带
shRNA
或者过表达基因,特异性地干预靶细胞中的
X
基因
腺相关病毒载体(
AAV
)
具有宿主范围广、安全性高、免疫原性低、表达稳定和物理性质稳定等优点,已被广泛地应用于基础研究和临床试验中
,
并已成为世界上最常用的基因治疗载体之一。
而本身
AAV
入侵动物细胞不具有特异性效果,那么其注射方式会影响其特异性吗?
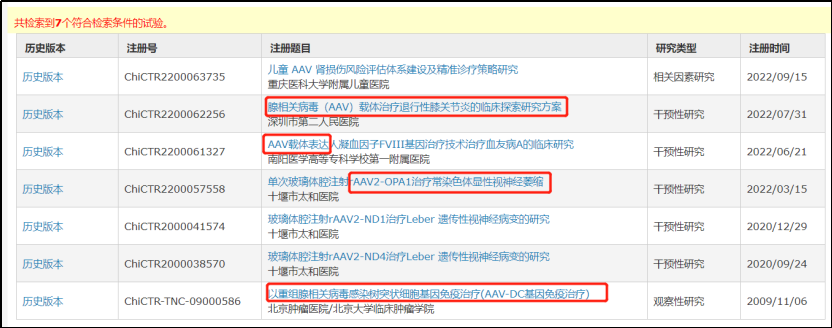
来自于
www.chictr.org.cn
(中国临床试验注册中心)
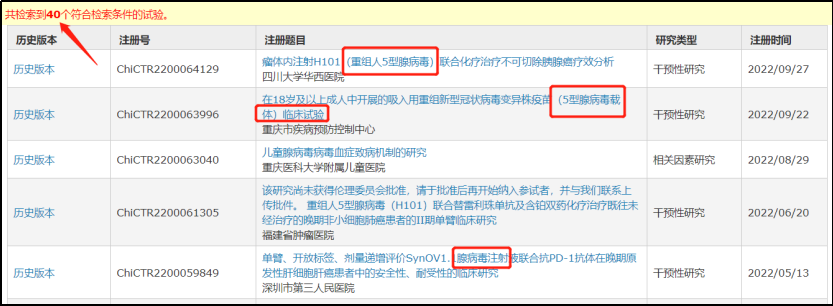
再来看看
美国
clinicaltrials.gov
上的数据,截止
2022
年
6
月,全球已经进行了
200
多项利用
AAV
递送蛋白质基因的研究,
70
余项临床试验仍在进行中,如表中所示,占据前三的是
血液疾病、神经系统疾病和视网膜病变
,分别占比
17.3%
,
13%
和
11.1%
。
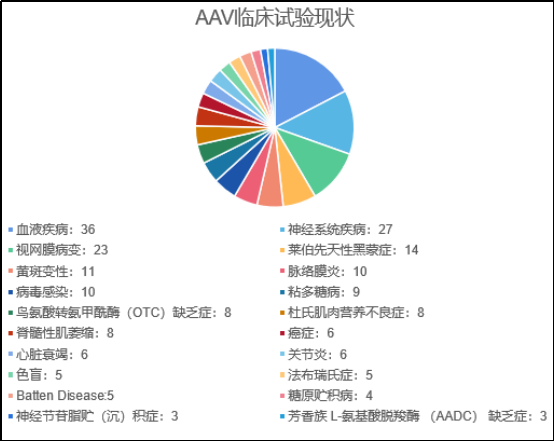
▲
AAV
临床试验现状(星耀研究院制图)
(二)
系统注射和局部注射,孰好孰劣?
而机体的
AAV
系统性注射
中最常见的注射方法有尾静脉注射、腹腔注射等。
局部注射主要包括视网膜下腔注射、脑立体定位注射、玻璃体腔注射、肠系膜上动脉注射、脾脏注射、灌胃、肌肉注射、皮下注射、皮内注射、鞘内注射、脊神经内注射等。
我们以心脏疾病的国自然研究方案为例,
AAV
在心脏的注射方式有多种
:心肌原点注射、冠状动脉注射、颈静脉注射和尾静脉注射均可以将药物递送到心脏,通常文献报道
较多的是心肌原点注射和尾静脉注射(观看视频
)
。

如果是动物实验的话,推荐使用特异性更强的组织直接注射,虽然创伤更大,但特异性强。
(三)
ShRNA
相比
CRISPR
、
Cre\Loxp
等沉默方式,熟好熟劣?
ShRNA
腺病毒转染,只是沉默,同时相比较
CRISPR
等技术,具有脱靶效应,而其他优缺点相比较如下:

来自于源井生物
最后,总结如下:
-
虽然尾部静脉注射对机体伤害最小,但尾部静脉注射尽量更换为组织特异性地注射(局部注射),要么就构建CRISPR基因敲除的小鼠直接代替“每批小鼠”的尾部静脉注射。
-
RNAi(siRNA、shRNA)的效果不如CRISPR,CRISPR技术超越RNAi已是大势所趋,因此国自然项目中可以广泛使用CRISPR技术干预目的基因的表达。最主要的是,价格并没有那么贵了,小几万能够搞定基因鼠,但就是繁育周期较长(1.5年左右)
2024年度国自然医学部50大科研热点中标数统计如下:

本团队从国自然、省市级课题申报、学术代表作规划、实验方案设计、科研技能教育培训等提升年轻科研者科研水平,真正掌握国自然课题设计的核心要点、精妙逻辑和标书撰写技巧,提高标书水平和质量,最终中标国自然。

















