传统止血材料难以应对非压迫性出血(如内脏出血)和凝血障碍患者的需求,且开放性伤口易感染并发展为慢性创面(如糖尿病溃疡)。糖尿病伤口因高糖环境、细菌感染、缺氧和血管破坏等问题,愈合周期长、复发率高。
现有材料往往功能单一,无法同时满足快速止血、抗菌抗炎、改善缺氧微环境和促进血管再生等综合需求,亟需开发
多功能一体化敷料。
鉴于此,来自
西安交通大学的杨雨桐,郭保林团队与胡娟团队
联合开发了一种
基于明胶/透明质酸复合的仿生冷冻凝胶(GA/HD/MDP)
,集凝血障碍止血与感染性糖尿病伤口修复功能于一体。相关研究以
“All-in-One: A Multifunctional Composite Biomimetic Cryogel for Coagulation Disorder Hemostasis and Infected Diabetic Wound Healing”
为题发表在
《Nano-Micro Letters》
上。

以下是对本论文创新点的简要概述:
(1)物理化学协同止血——不依赖凝血因子的“双保险”:
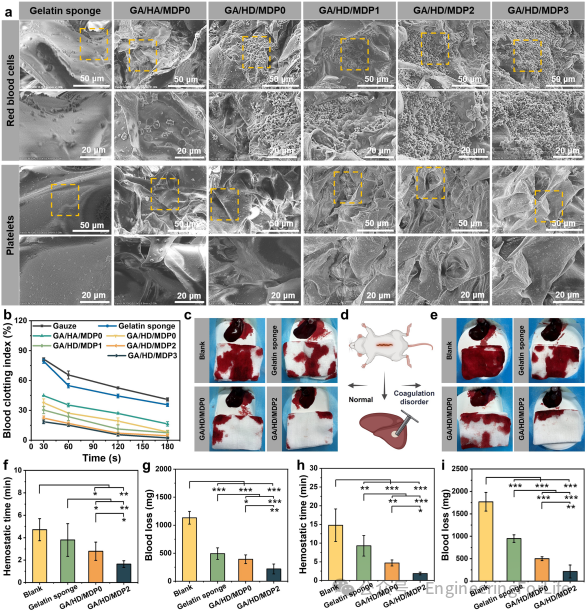
冷冻凝胶通过十二烷基链的疏水作用锚定红细胞/血小板,并结合聚多巴胺的化学粘附作用激活血细胞,形成物理-化学协同止血机制。实验显示,其在凝血障碍大鼠肝脏出血模型中止血时间仅需1.9分钟,出血量比商用明胶海绵减少50%以上,显著降低对凝血通路的依赖性。
(2)光热抗菌+抗氧化——双管齐下改善伤口微环境:
凝胶中MnO₂纳米酶兼具光热转换(近红外杀菌率>98%)和类SOD/CAT抗氧化活性,可清除活性氧(ROS)并释放氧气。感染糖尿病小鼠模型中,该凝胶通过光热快速杀灭MRSA,同时缓解氧化应激与缺氧,显著缩短炎症期。
(3)缓释药物促血管再生——破解糖尿病伤口“缺氧困局”:
凝胶负载的载铁胺(DFO)可持续释放21天,通过稳定缺氧诱导因子(HIF-1α)促进血管再生。动物实验显示,其显著提升VEGF表达,加速血管网络重建,使糖尿病伤口愈合速度比商用敷料Tegaderm™快1.5倍,且新生皮肤更接近正常组织结构。
该冷冻凝胶通过仿生设计与功能集成,为凝血障碍患者和糖尿病慢性伤口提供了“止血-抗菌-修复”一体化解决方案。
1. 材料设计与多孔结构构建——仿生冷冻凝胶的合成策略
研究团队基于明胶(GA)和透明质酸(HD)的天然细胞外基质特性,通过酰胺化反应和氢键交联构建了三维多孔冷冻凝胶(GA/HD/MDP)。通过引入十二烷基链修饰的HD和聚多巴胺(PDA)包覆的MnO₂@DFO纳米颗粒(MDP),赋予材料疏水锚定、光热抗菌及抗氧化功能。冷冻凝胶的宏观多孔结构(平均孔径57-102μm)通过冰模板法形成,具有快速吸液膨胀和形状恢复能力,可适应非压迫性出血伤口的复杂形态。
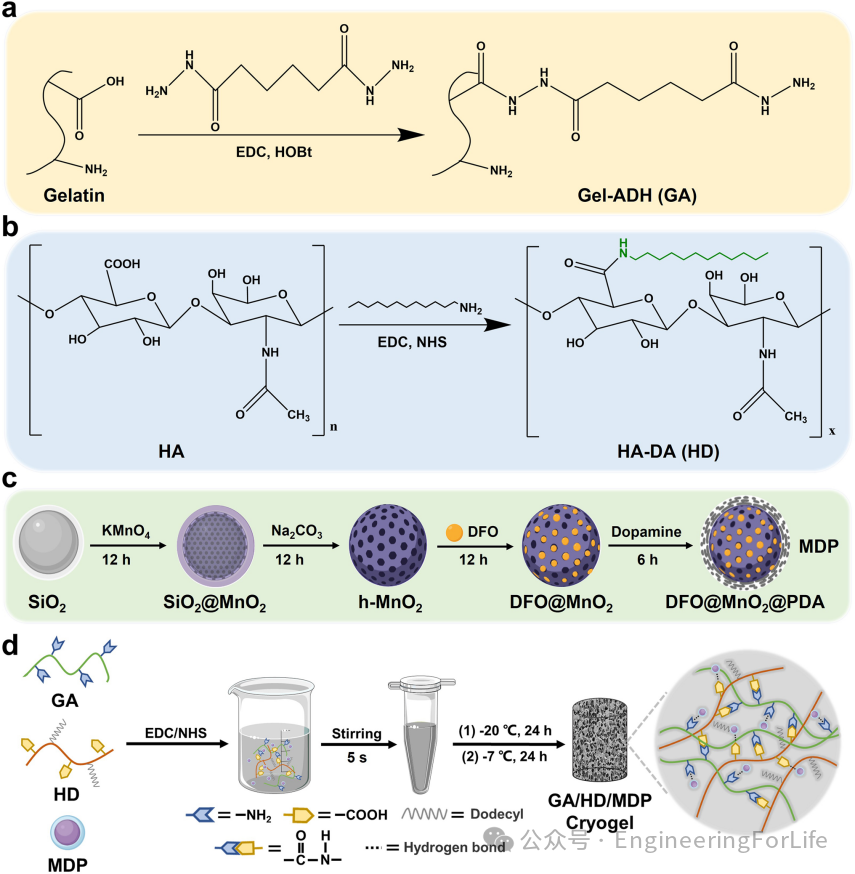
图1 材料合成与冷冻凝胶制备示意图
2. 物理-化学协同止血——不依赖凝血因子的止血机制
冷冻凝胶通过十二烷基链的疏水作用锚定红细胞/血小板,并结合PDA的化学粘附激活血细胞,形成物理-化学双重止血机制。体外实验显示,其可显著缩短凝血时间(BCI低至2.4%),并在凝血障碍大鼠肝脏出血模型中实现1.9分钟快速止血,出血量较商用明胶海绵减少50%以上。这种机制突破了传统止血材料对凝血通路的依赖性,尤其适用于血小板功能异常或凝血因子缺乏患者。