今天是2017年7月24日
农历六月初二
医麦客:肿瘤干细胞的靶点开发需要大力支持
2017年7月24日/医麦客 eMedClub/--
近日,
加利福尼亚再生医学研究所(CIRM)独立公民监督委员会给予了加州大学圣地亚哥分校医学院研究人员580万美元的奖金
,用于开发针对那些使用标准疗法无效或者生存期很短的癌症患者的一种新的免疫疗法,研究人员通过改造患者的T细胞使其能够
靶向肿瘤干细胞表面的某种特殊标记物。
该奖项授予的是由UC San Diego Moores癌症中心的Ezra Cohen博士所领导的研究团队。所开发的免疫疗法是建立在酪氨酸激酶受体ROR1的早期和正在进行的研究上,先前的研究结果表明
酪氨酸激酶受体ROR1蛋白在实体瘤和血液癌中都表达,但在正常组织中不表达。

Thomas Kipps博士(图片来源 ucsdnews.ucsd.edu)
另外一个UC San Diego团队由Moores 癌症中心的Thomas Kipps博士负责,目前已经开展了
cirmtuzumab(ROR1-基于人源化的单克隆抗体药物)针对复发性或难治性慢性淋巴细胞白血病(CLL)患者的首例人类I期临床试验。
其中cirmtuzumab这个名称的开头正是CIRM,因为UC San Diego的ROR1治疗的基础研究以及开发,是由加利福尼亚再生医学研究所(CIRM)提供持续的资金支持的。
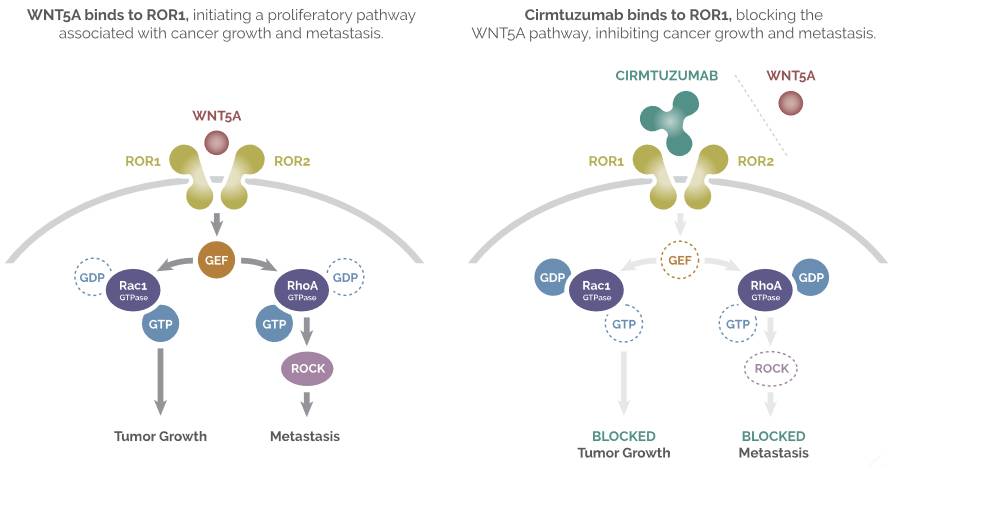
ROR1,这种新型靶点在许多恶性肿瘤中高度表达,包括CLL、MCL等血液肿瘤以及肺癌、卵巢癌和三阴性乳腺癌等实体瘤。cirmtuzumab与ROR1在肿瘤细胞上的结合抑制Wnt5a信号传导,这是阻断肿瘤细胞增殖,迁移和存活的重要途径。
Cohen 表示,ROR1几乎完全是在胚胎和早期胎儿阶段产生,其帮助新生组织迁移到身体的正确部位。而在这个阶段过后,它几乎没有任何用处。这个靶点也许是一个很安全的目标,其实在发现他之前,因为肿瘤干细胞的遗传活性有些类似于正常的干细胞,给治疗带来巨大的挑战。

Ezra Cohen博士(图片来源 onclive.com)
有一些迹象表明ROR1可能会在某些前体细胞中产生,而B细胞是产生抗体的免疫细胞。在没有B细胞的情况下生存是可能的,就像在药物破坏B细胞以阻止B细胞淋巴瘤的情况一样。与此同时,
Kipps博士的研究也表明ROR1蛋白在难治疗癌症中会大量表达。于是头颈癌专家Cohen开始考虑如何将这些理论应用于CAR-T细胞技术。
针对标准治疗没有希望的癌症患者,CIRM对于Cohen团队这项新研究的资助代表着更积极的一步。这是一个新兴的CAR-T细胞治疗的例子,研究人员实验室中提取和改变患者的T细胞。
在这种情况下,添加基因以允许其与ROR1相互作用时,导致T细胞活化。大量扩增T细胞之后回输到患者体内,希望它们将寻找并破坏表达ROR1的癌症干细胞。
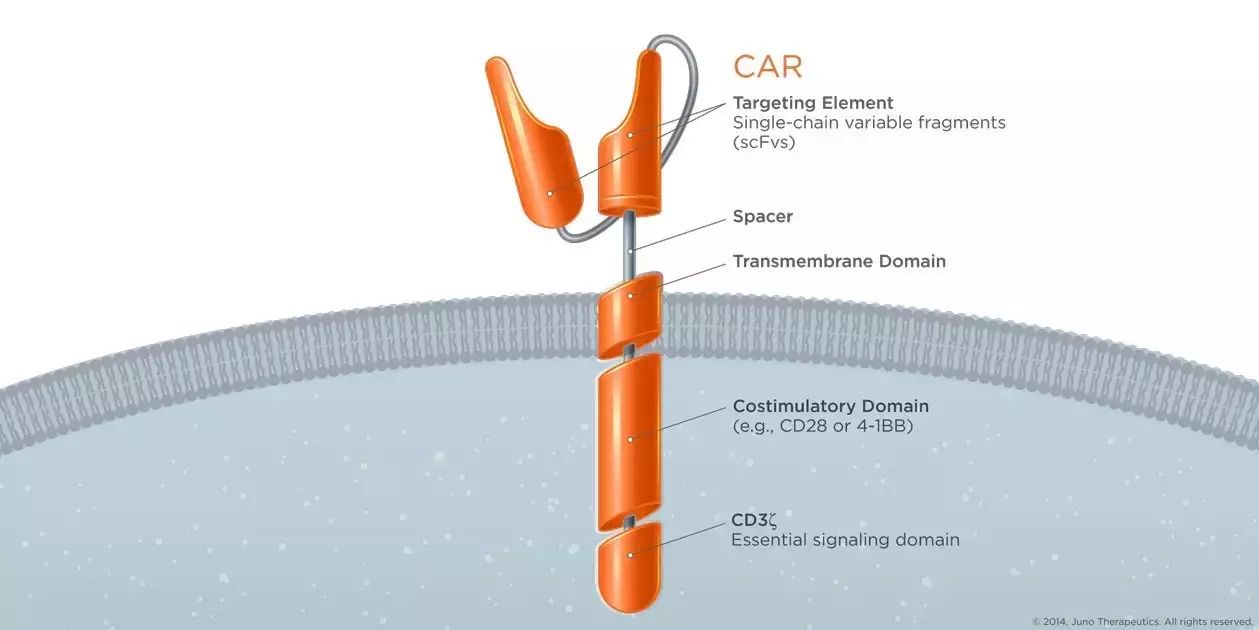
CAR结构(图片来源 Juno官网)
在此之前,UC San Diego医学院进行的研究表明,
在头颈鳞状细胞癌,三阴性乳腺癌,胰腺癌,卵巢癌以及慢性淋巴细胞性白血病的体外模型中,ROR1 CAR-T细胞可以靶向并杀死表达ROR1的癌症干细胞。
这里我们需要注意的是,所提及的到的五种癌症都是最致命的,而且难以治疗。
另外,Cohen表示,新的CIRM补助金将支持在人类早期阶段临床试验计划开始之前就开展相关准备工作,以创建必要的概念证明和试点安全数据。在这个30个月的过程结束之前,
研究团队的最终目标是在FDA的投入和支持下建立一个完整的临床前计划,以便开发新的药物并在临床试验中进行测试。
那ROR1蛋白何以被称作免疫治疗最理想的靶点?
相关研究表明,酪氨酸激酶受体ROR1蛋白在恶性血液肿瘤与实体瘤的表达上占据支配地位,而在正常细胞中几乎不表达。这岂不就是免疫治疗最理想的靶点,
但是ROR1蛋白并不是在细胞表面表达,而是在细胞质中,所以这个靶点的理想度还是打了折扣。
尽管如此,ROR1的利用价值还是不容小觑的。
众所周知,由于靶标的特异性问题,免疫疗法所导致的on target/off tumor毒性是致命的,














