
五月一日,美国FDA宣布加速批准阿斯利康(AstraZeneca)的Imfinzi(durvalumab)上市,治疗晚期或转移性尿路上皮癌患者。这些患者在先前的铂类化疗中或化疗后病情依旧出现进展,或在接受辅助或新辅助铂类化疗(neoadjuvant or adjuvant treatment with platinum-containing chemotherapy)的12个月内疾病出现进展。值得一提的是,本次批准较预期快了将近6周。
尿路上皮癌是最常见的膀胱癌类型,占了膀胱癌病例总数的90%。而膀胱癌是一种很恐怖的癌症,恐怖在于膀胱无感应神经,所以膀胱癌早期很难被发现,一旦发现异常就诊,大多患者癌细胞已经转移。更可怕的是转移性膀胱癌是一种预后很差的膀胱癌,5年生存率不足15%,该领域近30年无重大进展,Durvalumab可以说是“破天荒”的一个产品。
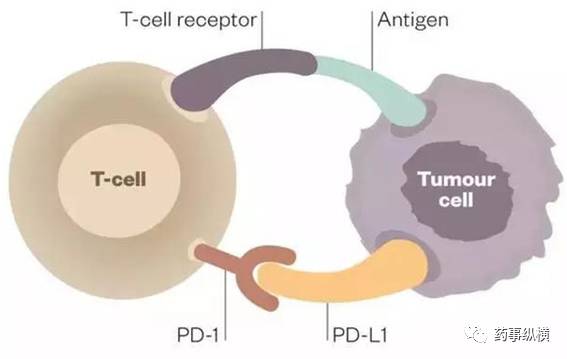
Durvalumab是一种PD-L1单抗,由阿斯利康研发,早在2016年12月,该产品BLA申请已被FDA接受。作为针对PD-L1蛋白的单克隆抗体,它能够结合肿瘤表面表达的PD-L1蛋白,抑制它们与T细胞表面的PD-1蛋白结合。因此,肿瘤细胞就无法利用PD-L1/PD-1途径来逃避免疫系统的追杀。Durvalumab也正是利用这一机理,起到激活免疫系统杀伤肿瘤的效果。先前,它曾获得了美国FDA颁发的突破性疗法认定与优先审评资格。在今年的一份报告中,它也被列为有望在2017年上市的潜在重磅药物之一。
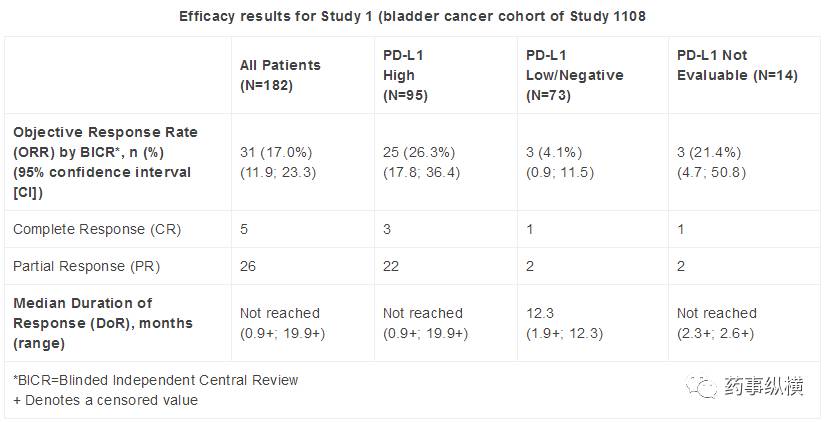
在一项有182名患者参与的临床试验中,durvalumab的疗效得到了确认。这些罹患晚期或转移性尿路上皮癌的患者先前接受了铂类化疗,但病情依旧出现了进展。每两周,这些患者以静脉滴注的方式接受10mg/kg durvalumab。结果是Durvalumab治疗的总体客观缓解率(ORR)为31%,其中PD-L1高表达患者为46%,疾病控制率(DCR)为48%,PD-L1高表达患者为57%,基于这些出色数据,美国FDA在今日加速批准durvalumab上市。与此同时,美国FDA也批准了VENTANA PD-L1 (SP263) Assay这一检测手段,用于评估尿路上皮癌组织样品中的PD-L1表达量。由该检测手段获得的数据将被纳入诊断参考。
值得一提的是,durvalumab在其他类型的癌症中也有不俗的临床试验表现。去年10月,在欧洲肿瘤医学学会(ESMO)的年会上,阿斯利康公布了durvalumab在晚期非小细胞肺癌与转移性或复发性头颈部鳞状细胞癌患者中的治疗数据。在PD-L1表达量较高的患者中,durvalumab在这两种疾病里的客观缓解率分别达到了25%与18%。目前,更多durvalumab的临床试验正在进行中。它也有望以其他在研新药共同使用,治疗更多癌症。
https://www.fda.gov/Drugs/InformationOnDrugs/ApprovedDrugs/ucm555930.htm

药事纵横是一个开放,由自愿者组成的团体,现有成员11名,分别为Voyager88,雷诺岛,三分话,Herman,Mzwinsunny,文竹,duke,巉巉之石,蓝色枫叶,ISAL,海角边,欢迎有志之士加入我们团队。投稿、加专业微信群【合成、制剂、分析、注册、BD、一致性评价】请加微信442015666,QQ群:22711855/22711679(限加一个)















