

摘 要:目的
探索夏黄颗粒治疗阿片类药物所致便秘的潜在作用机制。
方法
在
TCMSP
数据库中查找夏黄颗粒的各药材成分和靶点信息,在
Genecards
数据库中以“
opiod constipation
”“
opioid-induced bowel dysfunction
”“
opioid-induced constipation
”为关键词搜索阿片类药物所致便秘相关靶点,与夏黄颗粒活性靶点映射筛选出共同靶点作为研究靶点;将共同靶点导入
STRING
数据库中构建靶点相互作用网络图,利用
Cytoscape 3.3.0
软件进行可视化处理,筛选出核心靶点;借助
OmicsBean
分析平台与
STRING
数据库对靶点进行基因本体论(
GO
)功能和基因组百科全书(
KEGG
)通路富集分析
。
结果
通过筛选得到夏黄颗粒化学成分
55
个,候选靶基因
158
个,
Venny
映射后的共同靶点
86
个,对应化学成分
49
个,核心靶点
12
个,主要化学成分
19
个。
GO
功能富集分析得到生物过程条目
4 150
个,涉及化学刺激性细胞反应、化学反应、生物质量调控等过程;细胞组成条目
302
个,涉及体元投射、细胞外间隙、全膜等过程;分子功能条目
459
个,涉及蛋白结合、分子转导活性、酶结合等过程。
KEGG
富集分析得到与夏黄颗粒作用相关的信号通路
149
条,涉及糖尿病并发症
AGE-RAGE
信号通路、肿瘤坏死因子信号通路等;
构建了夏黄颗粒核心靶点的“药材
-
成分
-
靶点
-
通路”网络
。
结论
夏黄颗粒中主要化学成分柚皮素、川陈皮素、芦荟大黄素、大黄酸等可能通过作用于
TNF
、
MAPK3
、
IL-6
、
VEGFA
、
PTGS2
等关键蛋白,调节内分泌抵抗、肿瘤坏死因子信号通路等信号通路,发挥通便、解痉、促进胃肠运动等作用,为夏黄颗粒治疗阿片类药物所致便秘提供理论依据
,同时与夏黄颗粒药效初步验证结果相吻合
。
全球癌症统计报告显示,
2018
年中国新增癌症病例
428
万,死亡病例
286
万,肺癌、胃癌、肝癌、食管癌、结直肠癌的死亡例数排前
5
位
[1]
。不同的恶性肿瘤临床症状各异
[2]
。疼痛是癌症患者常见的症状之一,若疼痛得不到缓解,患者不适感加重,产生焦虑、抑郁、乏力、失眠、食欲减退等症状,其日常活动、自理能力、交往能力和整体生活质量受到严重影响。临床常以阿片类药物治疗癌症疼痛,但会产生胃肠道不良反应如便秘、恶心、呕吐、口干、胃食管反流、腹部绞痛、痉挛、腹胀等,统称为阿片类药物引起的肠道功能障碍(
opioid-induced bowel dysfunction
,
OIBD
)
[3-5]
。由阿片类药物引起的便秘症,临床称为阿片类便秘(
opioid-inducedconstipation
,
OIC
),已成为癌症治疗过程中急需解决的问题
[6-7]
。
夏黄颗粒为天津中医药大学第一附属医院肿瘤科贾英杰主任的临床经验方
[8]
。贾英杰教授多年来致力于肿瘤晚期
OIC
的临床研究,根据
OIC
的病因病机,提出“解毒泻浊、通腑和胃”的治疗理论。胃与大肠均为消化的重要脏器,均属六腑中的脏器,生理上属于“泻而不藏”,具有“六腑以通为用”的特点,药毒犯胃、枢机不利、失于和降,出现恶心、呕吐,同时导致传导不利,出现大便秘结;反之腑气不通更易引起恶心、呕吐等症。调理胃肠的和降与通畅,是治疗癌性疼痛
OIC
的重要环节之一。
夏黄颗粒中大黄通腑泄浊、荡涤积滞、软坚化燥;芦荟清泻肝热、通便;决明子清热泻火、润肠通便;枳实泻热通便、荡涤积滞、软坚化燥;厚朴清泻肝热、通便;半夏、旋覆花降逆理气,枳壳、厚朴、莱菔子行气除满;生地清热生津。旋覆花、枳壳一升一降,上下呼应,清上通下,配合其他药物使全方共奏解毒泻浊、通腑和胃之功。
本研究通过网络药理学分析夏黄颗粒中的主要活性成分、潜在作用靶点、主要通路,探索其对
OIC
的作用机制,为夏黄颗粒的应用提供理论依据。
1
方法
1.1
夏黄颗粒中药材
、
成分和靶点总结
借助中药系统药理学数据库与分析平台(
TCMSP
,
http://tcmspw.com
)
[9]
,检索并筛选“大黄”“半夏”“旋覆花”“地黄”“枳壳”“厚朴”“莱菔子”“芦荟”“决明子”中生物利用度(
OB
)≥
30%
且类药性(
DL
)≥
0.18
的化学成分及其对应的靶标蛋白。由于检索到的药物靶标存在命名不规范等问题,利用
Uniprot
(
https://www.uniprot.org/
)数据库中
UniProtKB
搜索功能,通过输入靶标蛋白名称并限定物种为“
human
”,将检索得到的蛋白进行校正
[10]
。
1.2
OIC
相关靶点的检索
在
Genecards
数据库(
https://www.genecards. org/
)
[11]
中以“
opiod constipation
”“
opioid-induced bowel dysfunction
”“
opioid-induced constipation
”为关键词,搜索
OIC
相关的靶点信息,与夏黄颗粒的候选靶标蛋白在
Venny 2.1.0
中生成韦恩图,映射筛选出共同靶点。查找共同靶点对应的化学成分及所属药材,将共同靶点和对应成分导入
Cytoscape 3.3.0
中,导出相关的拓扑数据度值,筛选大于平均度值的节点,得到夏黄颗粒抗
OIC
的主要化学成分。
1.3
靶点相互作用网络
(
PPI
)
的构建
为明确夏黄颗粒潜在抗
OIC
靶点间的相互作用,将筛选出的靶点导入
STRING
网络平台(
https://string-db.org/
)
[12]
,蛋白种类设置为“
homo sapiens
”,置信度设定>
0.9
,构建
PPI
网络。利用
Cytoscape 3.3.0
软件将
PPI
网络可视化,对节点的度值“
degree
”和介值中心度“
betweenness centrality
”进行分析,确定夏黄颗粒抗
OIC
的核心靶点。
1.4
基因本体论
(
GO
)
功能富集和
基因组百科全书
(
KEGG
)
通路分析
运用
Omicsbean
平台(
http://www.omicsbean.cn/
)对靶点蛋白进行生物信息学分析,探究靶点蛋白在生物过程、细胞组分和分子功能方面的作用机制。
通过
STRING
网络平台得到与靶点相关的通路过程,利用
KEGG
数据库并查阅相关文献,对得到的通路进行深入分析。
1.5
夏黄颗粒
“
药材
-
成分
-
靶点
-
通路
”
网络构建
根据夏黄颗粒化学成分、靶点及通路预测结果,在
Excel
表格中建立药材
-
成分、成分
-
靶点、靶点
-
通路的相互对应关系,导入
Cytoscape3.3.0
软件中构建夏黄颗粒“药材
-
成分
-
靶点
-
通路”之间的相互关系网络图。网络中节点表示药材、成分、靶点和作用通路,边表示药材
-
成分、成分
-
靶点、靶点
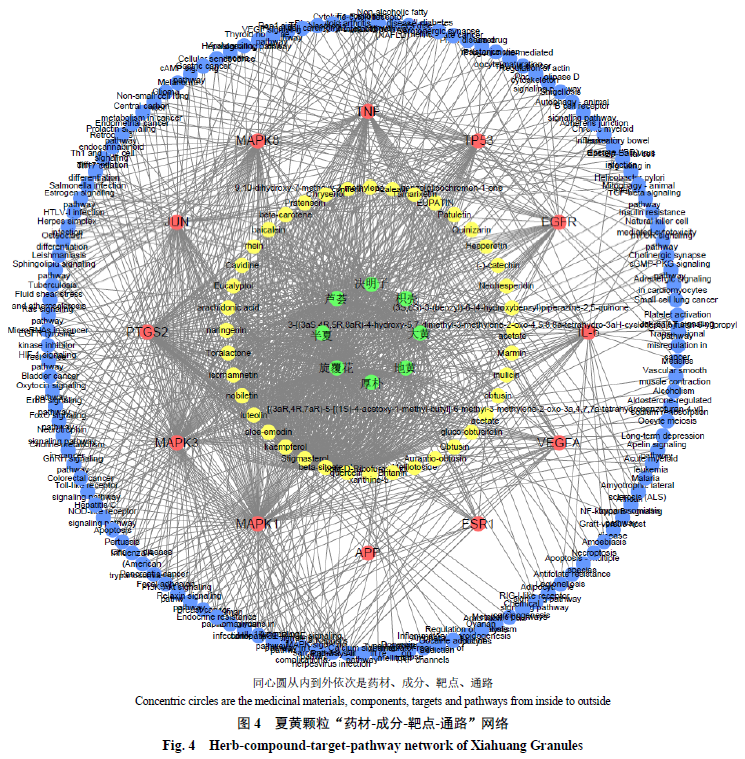
-
通路相互作用。
2
结果
2.1
夏黄颗粒中药材
、
成分和靶点的预测
通过借助
TCMSP
研究平台,筛选出不重复且有作用靶标的化学成分
55
个,其中大黄化学成分
10
个、半夏化学成分
12
个、旋覆花化学成分
16
个、地黄化学成分
2
个、枳壳化学成分
5
个、厚朴化学成分
2
个、莱菔子化学成分
2
个、决明子化学成分
13
个、芦荟化学成分
7
个。利用
Uniprot
数据库确定了不重复的靶点共计
158
个。
2.2
OIC
相关靶点的筛选
通过
Genecards
数据库搜索到不重复的
OIC
相关靶点
699
个,与夏黄颗粒
158
个候选靶基因在
Venny 2.1.0
中映射筛选出
86
个共同靶点。将共同靶点和对应成分导入
Cytoscape 3.3.0
中,得到夏黄颗粒抗
OIC
的靶点
20
个,化学成分(槲皮素、
β-
谷甾醇、豆甾醇、山柰酚、芦荟大黄素、木犀草素、异鼠李素、川陈皮素、卡维丁、桉叶油醇、花生四烯酸、决明内酯、红车轴草素、黄芩素、柚皮素、松柏苷、金圣草黄素、
β-
胡萝卜素、大黄酸)
19
个。
2.3
夏黄颗粒靶点
PPI
分析
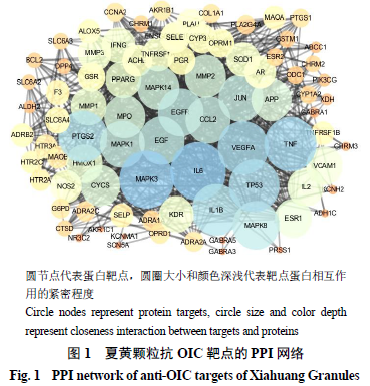
将夏黄颗粒抗
OIC
的
86
个相关靶点蛋白输入至
STRING
数据库,构建靶蛋白相互作用
PPI
网络。如图
1
所示,共
86
个节点,
183
条相互作用关系,平均度值为
4.26
。将在
STRING
平台中构建的
PPI
网络数据导入
Cytoscape 3.3.0
中,节点的平均度值为
5.083 3
,大于该平均度值的节点有
21
个;节点平均介值中心度为
0.048 777 355
,大于该平均介值中心度的节点有
19
个。如表
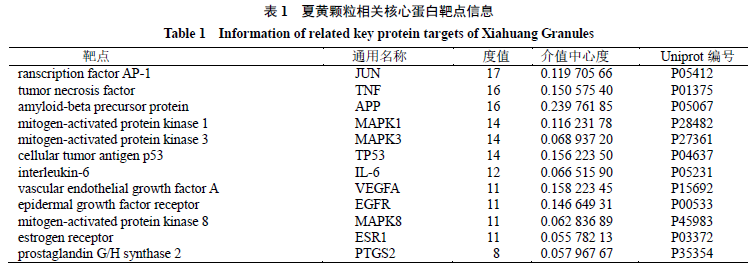
1
所示,共有
12
个节
点的度值和介值中心度均高于均值,包括
JUN
、
TNF
、
APP
、
MAPK1
、
MAPK3
、
TP53
、
IL-6
、
VEGFA
、
EGFR
、
MAPK8
、
ESR1
、
PTGS2
。
2.4
夏黄颗粒
GO
功能富集和
KEGG
通路分析
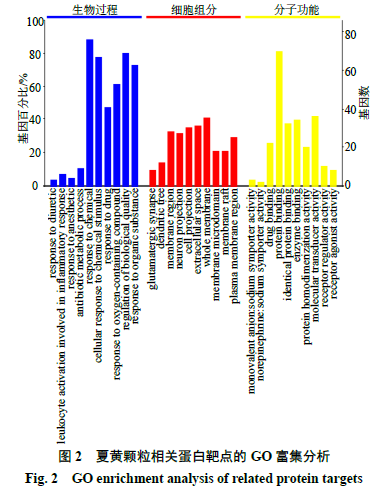
如图
2
所示,
GO
功能富集显示,生物过程主要涉及化学刺激性细胞反应、化学反应、生物质量调控等过程;细胞组分主要涉及体元投射、细胞外间隙、全膜等过程;分子功能主要参与蛋白结合、分子转导活性、酶结合等过程。
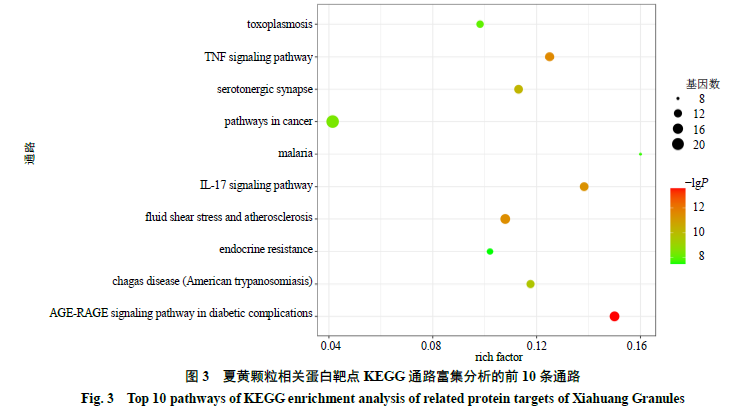
在
STRING
数据库中得到
149
条通路(
FDR
<
0.01
),
FDR
值前
10
的通路如图
3
所示,为糖尿病并发症
AGE-RAGE
信号通路、肿瘤坏死因子信号通路、流体剪切应力与动脉粥样硬化、白介素
17
信号通路、
5-
羟色胺能突触、查加斯病(美国锥虫病)、癌症相关通路、弓形体病、内分泌抵抗、疟疾。
rich factor
表示相关基因中位于该通路的基因数目与所有注释基因中位于该通路的基因总数的比值,该值越大代表富集程度越高。
2.5
夏黄颗粒
“
药材
-
成分
-
靶点
-
通路
”
网络构建
夏黄颗粒
12
个核心靶点的“药材
-
成分
-
靶点
-
通路”的网络关系如图
4
所示,该网络有
35 910
条边,且构建网络的节点度分布服从幂分布
[
P
(χ)
=
22.195 χ
−0.765
(
r
2
=
0.656
)
]
,表明夏黄颗粒网络为无标度网络。特征路径长度
2.821
,即网络路径长度为
2
步,大多数蛋白联系密切,表明该网络具有较快的传播速度和较小的反应时间,具有小世界性质。网络异质性为
1.932
,平均相邻节点数目
6.568
,网络中心度
0.473
。网络中既存在一个分子与多个靶点蛋白的相互作用,也存在不同分子作用于同一个靶点蛋白的现象,显示了夏黄颗粒多成分、多靶点、多通路的特点,初步阐释了夏黄颗粒理气和胃、解毒泻浊的药效物质基础和作用机制。
3
讨论
阿片类药物通过与阿片受体(
μ
、
κ
、
δ
受体)结合发挥生物活性
[13-14]
。阿片受体广泛分布于肠道神经系统,参与多种生理过程如疼痛信号转导、调节胃肠道机能、免疫反应等
[15-16]
。阿片类药物与胃肠道受体如
μ
受体结合,增加胃肠道非推进性收缩,抑制水和电解质排泄,从而导致便秘
[4,17-18]
。
药物
作用的信号通路有两方面:一方面通过下调细胞内第二信使和蛋白
/
磷酸激酶途径(
cAMP/PKA
),抑制
Ca
2
+
、
Na
+
通道活性,激活肠内神经元上
K
+
通道,导致神经递质如乙酰胆碱(
ACh
)、
P
物质(
SP
)等释放减少
[19-20]
,从而改变神经元的兴奋性,抑制肠神经系统内的肌肉收缩;另一方面通过激活信号丝裂原活化蛋白激酶
/
细胞外信号调节激酶途径(
MAPK/ERK
)和反应元件(
CREB
)磷酸化,从而抑制胃肠传输
[21-25]
。
阿片类药物与肠道黏膜下层的分泌运动神经元结合,抑制神经递质释放,导致氯化物和水的分泌减少
[20]
,从而影响肠道的分泌和吸收,以及胃、胰、胆的分泌,导致粪便干燥、推进动力减少;唾液分泌减少,产生口干症状
[17,26-27]
。阿片类药物还会增加括约肌张力,导致胰液和胆汁排空减少,从而延迟消化















