
8 月 17 日,清华大学医学院、结构生物学高精尖创新中心教授、千人计划入选者布莱恩·克比尔卡 (Brian Kobilka)研究组在《自然》(Nature)期刊 在线发表 题为《利用 X 射线晶体结构揭示 beta2 肾上腺素受体胞内别构拮抗剂的工作机理》的文章 (Mechanism of intracellular allosteric β2AR antagonist reveled by X-ray crystal structure)。首次报道了 beta2 肾上腺素受体同时结合正构拮抗剂卡拉洛尔(carazolol)与胞内别构拮抗剂 Cmpd-15 的复合物结构。该成果对 G 蛋白偶联受体别构调节物的研发具有指导意义。
由于对 G 蛋白偶联受体结构和功能研究的杰出贡献,布莱恩·克比尔卡教授和罗伯特·莱夫科维茨教授分享了 2012 年的诺贝尔化学奖。
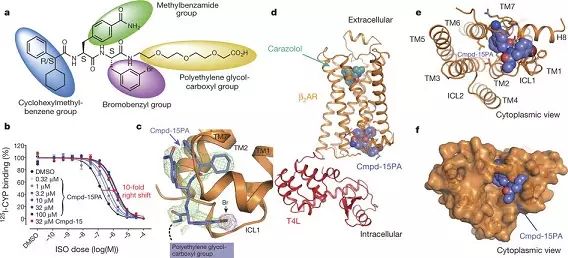
beta2 肾上腺素受体和 Cmpd-15PA(即修饰后的 cmpd-15)复合物的整体结构。其中 a 是 Cmpd-15PA 的化学结构,b 是 Cmpd-15PA 活性数据,c 是 Cmpd-15PA 的电子密度(晶体学数据),d- f 展示了复合物的整体结构,清楚表明 Cmpd-15 结合在 beta2 肾上腺素受体的胞内部分。
G 蛋白偶联受体是一类具有七次跨膜结构的膜蛋白受体。这类受体可以感知包括气味分子、激素、神经递质、趋化因子等信号,从而调节生理反应。G 蛋白偶联受体是一类重要的药物靶标,大约 30% 的商业化药物以 G 蛋白偶联受体作为靶点。由于对 G 蛋白偶联受体结构和功能研究的杰出贡献,布莱恩·克比尔卡教授和罗伯特·莱夫科维茨教授分享了 2012 年的诺贝尔化学奖。
传统上针对 G 蛋白偶联受体的药物研发工作主要以其正构底物结合位点(即天然底物结合位点)为靶点。这类正构底物结合位点在不同亚型的 G 蛋白偶联受体之间往往非常保守。例如在人体中一共有九个肾上腺素受体,它们都可以被肾上腺素激活,所以其正构底物结合位点十分相似。这就导致研发出的药物往往对不同亚型的特异性不够,造成药物副作用。别构调节物指的是不结合在 G 蛋白偶联受体正构底物结合位点的小分子化合物。其结合位置通常保守性较低,因此有可能具有更好的特异性。目前报道的 G 蛋白偶联受体结构大多数都是结合了正构拮抗剂,只有极少数结构里面结合了别构调节物。布莱恩·克比尔卡教授自从在清华大学建立实验室以来,一直保持和世界上不同实验室合作,共同研发 G 蛋白偶联受体的别构调节物,并利用结构生物学的方法研究别构调节物发挥功能的分子机理。
胞内别构拮抗剂第 15 号化合物(Cmpd-15)是罗伯特·莱夫科维茨研究组利用亲和筛选的方式,从 DNA 编码的小分子化合物库里面鉴定出来的一个 beta2 肾上腺素受体别构拮抗剂 (Ahn, S. et al. 2017)。生化实验表明第 15 号化合物 [XL1] 可能穿过细胞膜,结合在 beta2 肾上腺素受体的胞内位置。Beta 肾上腺素受体的正构拮抗剂,即乙型阻滞剂(beta-blocker)是一类极为重要的处方药。而 Cmpd-15 是第一个别构型的乙型阻滞剂,其重要性不言而喻。
在这项工作中,布莱恩·克比尔卡研究组利用一个 beta2 肾上腺素受体和 T4 溶菌酶的融合蛋白(β2AR-T4L)进行晶体学研究。研究初期利用 T4 溶菌酶的融合蛋白与 Cmpd-15 共结晶,获得了 2.5 埃的晶体数据。但是由于胞内别构拮抗剂 Cmpd-15[XL2] 溶解性很差,在结晶条件中最高只能加到 200uM。在晶体数据里虽然看到胞内部分有很弱的电子密度,但是无法准确判断其结合方式。后来合作研究组对 Cmpd-15 进行了修饰,在其上加入一个羧酸聚乙二醇基团以提高其溶解度。改造后的小分子即为 Cmpd-15PA。 布莱恩·克比尔卡研究组又获得了 T4 溶菌酶的融合蛋白与 Cmpd-15PA 复合物 2.7 埃的晶体结构。其晶体数据清楚的揭示了 Cmpd-15 的结合方式,羧酸聚乙二醇基团在晶体中处于柔性不可见的状态。Cmpd-15 结合在跨膜螺旋 1、2、6、7 的胞内端与胞内环 1 以及螺旋 8 形成的底物口袋。结构分析、分子动态模拟以及生化实验结果表明 Cmpd-15 通过两种方式形成功能。一是通过稳定跨膜螺旋 6,将 beta2 肾上腺素受体稳定在非激活状态,从而影响正构底物的亲和力。二是直接与下游信号蛋白如 G 蛋白或者抑制蛋白 (arrestin)竞争,干扰下游信号传导。
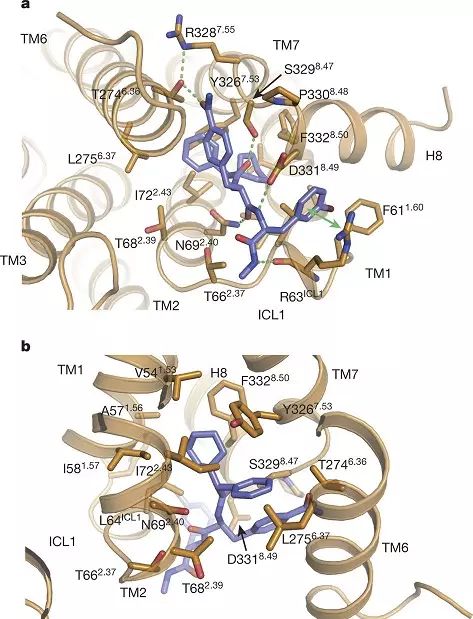
beta2 肾上腺素受体和 Cmpd-15PA 结合的细节。
值得注意的是 2016 年 12 月《自然》期刊上曾经报道了两个趋化因子受体 CCR2 和 CCR9 与各自胞内别构调节物的复合物结构(Zheng, Y. et al. 2016。 Oswald, C. et al. 2016)。尽管小分子的化学结构很不一样,和小分子相互作用的氨基酸序列也不保守,但是本工作中肾上腺素能受体β2 抗体 (β2AR)上的第十五化合物结合区域和趋化因子受体上的别构调节物结合区域在结构上很接近,都是由跨膜螺旋 1、2、6、7 的胞内部分组成。这表明该位置可能在不同类型的 G 蛋白偶联受体里面都可以作为别构调节物结合口袋,本工作对针对其他 G 蛋白偶联受体的别构药物研发工作具有指导意义。
清华大学医学院、结构生物学高精尖创新中心教授、千人计划入选者布莱恩·克比尔卡教授与杜克大学罗伯特·莱夫科维茨教授、常州大学陈新教授以及斯坦福大学罗恩·德洛尔(Ron Dror)教授共同合作的成果。其中布莱恩·克比尔卡教授实验室负责结构生物学工作,罗伯特·莱夫科维茨教授实验室负责生化实验工作,陈新教授实验室负责化学合成工作,罗恩·德洛尔 (Ron Dror)教授实验室负责分子动态模拟工作。布莱恩·克比尔卡教授与罗伯特·莱夫科维茨教授为本文的共同通讯作者。医学院助理研究员刘翔宇博士与杜克大学佐恩科尔·安 (Seungkirl Ahn)博士为本文的共同第一作者。本课题得到北京市结构生物学高精尖创新中心的资助。衍射数据收集得到日本 Spring- 8 同步辐射光源的支持和协助。
原文检索:Mechanism of intracellular allosteric β2AR antagonist revealed by X-ray crystal structure
Cell:细胞治疗领域观察者
长按识别二维码,轻松关注















