申请成为专栏作者,或原创投稿
请联系:[email protected]
推荐阅读:
近些年在海外(或拟)开展临床试验的中国境内药企(一)
本文由HEROIV根据公开信息整理,图片来源于网络。

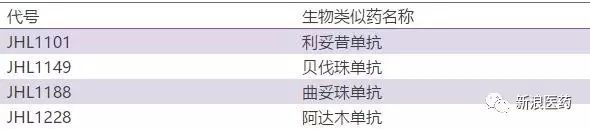
1、喜康生物目前位于台湾新竹建设有符合国际标准的抗体药物研发及中式基地。2016年2月位于武汉光谷全球首家符合国际标准的模块化大分子生物制药工厂正式投入运营。
2、喜康生物研发及生产的Rituximab生物类似药(利妥昔单抗)—JHL1101于2016年2月获得英国药监局核准,在欧洲进行用于类风湿性关节炎病人之临床一期试验,成为中国首家获准在欧洲进行单抗生物类似药临床试验的生物制药公司。该临床试验招募约150位重度类风湿性关节炎病患,以随机、双盲方式,在欧洲多国多中心进行PK/PD、安全性及疗效比较。
3、最新公告显示,JHL1101一期临床俄罗斯研究者会议在莫斯科召开。

4、产品线
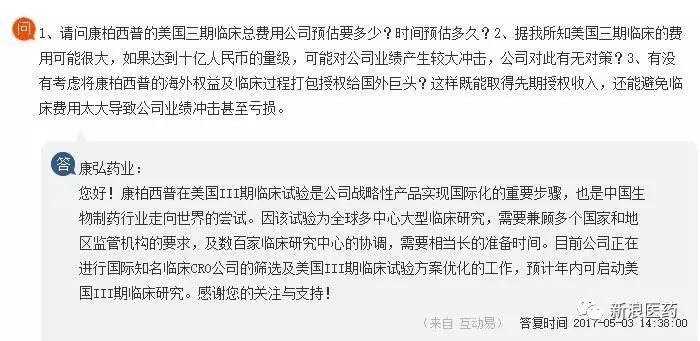
1、康柏西普-Conbercept Ophthalmic Injection是国内第一个获得FDA临床批件(IND)的中国生物制药公司。可跳过Ⅰ期和Ⅱ期临床试验直接在美国开展III期临床试验。
2、
目前康柏西普美国三期临床还在准备阶段:
CRO
筛选及临床方案优化,公司层面表示预计
2017
年内开展。
1、马来酸吡咯替尼片:

本品可用于治疗人表皮因子受体2(ErbB2)过度表达的晚期或转移性乳腺癌。目前国外已上市的同类产品EGFR/ErbB2抑制剂有2个,分别为Tykerb®(甲苯磺酸拉帕替尼片)和Gilotrif®(马来酸阿法替尼片)。数据库显示,2015年Tykerb®全球销售额为1.8亿美元,Gilotrif®全球销售额为2.3亿美元。

美国一、二期临床正进行中。
2、此外恒瑞在美国获准IND的还有几款生物大分子-注射用SHR-A1403(c-Met ADC),SHR-1316注射液(抗PD-L1抗体),及小分子IDO抑制剂。

丽珠医药集团
7
月
31
日公告:控股子公司珠海市丽珠单抗在研新药“
Recombinant Humanized anti-PD-1 Monoclonal Antibody for Injection
”的临床研究申请(受理号:
IND 133742
)获得美国
FDA
批准,同意其在美国进行临床研究。“注射用重组人源化抗
PD-1
单克隆抗体”
-LZM009
临床试验申请于美国时间
2017
年
6
月
29
日正式提交并获得美国
FDA
受理,并于美国时间
2017
年
7
月
28
日获得美国
FDA
正式批准。
丽珠单抗在申报临床试验过程当中,与境外
CRO
机构进行了充分沟通,并签订了
临床试验委托合同,确定了
临床试验医疗机构。本次丽珠单抗取得临床试验批准以后,将与境外
CRO
机构及临床试验医疗机构一同积极推动“注射用重组人源化抗
PD-1
单克隆抗体”药物在美国临床试验的实施。截至
2017
年
7
月
31
日,该药物已累计投入研发费用约
2,748.52
万元人民币。

2016
年
8
月
4
日,百奥泰在研产品—
BAT1706
(贝伐珠单抗生物类似药)在新西兰进行的Ⅰ期临床
PK
比对研究已完成所有
129
位受试者的入组,此前预计
2017
年
4
月完成临床总结报告。与此同时,国际多中心Ⅲ期临床试验已在准备阶段,近期就将启动。
这是目前首家中国企业在海外开展的贝伐珠单抗生物类似药临床研究。

2017
年
7
月,
Ensartinib
国际多中心
III
期临床研究举行中国首研会。
Ensartinib,是由贝达药业与Xcovery共同开发针对肺癌的新一代ALK抑制剂,拟用于ALK阳性NSCLC患者的一线和二线治疗。该产品临床I/ II期研究已完成89例受试者的入组,初期数据已在ASCO等会议上发表,显示出X-396在人体中的良好耐受性及其在ALK阳性的NSCLC患者中的抗肿瘤活性。2016年6月,Xcovery与贝达药业在全球范围内发起了国际多中心、随机、开放、III期注册性研究(eXALT3)。该研究将在北美、欧洲、亚洲等多个国家约120家中心开展,计划入组266例患者。目前已在国外70多家中心启动这项研究,入组30多例受试者。中国在eXALT3研究中占有重要位置,预计国内将入组133例合格受试者。

与公司相关的安罗替尼
-AL3818
也在海外开展临床研究,本品海外权益仍在爱德程手中。开展的适应症有:软组织肉瘤、卵巢癌和宫颈癌等。
1、A
Phase III Trial of Anlotinib in Metastatic or Advanced Alveolar Soft Part Sarcoma, Leiomyosarcoma and Synovial Sarcoma (APROMISS)
2、Phase 1/2a Evaluation of AL3818 in Subjects With Recurrent or Metastatic Endometrial, Ovarian or Cervical Cancer (AL3818-US-001) (AL3818)

仙琚制药持有索元生物30%股份。
1、索元生物计划于今年启动治疗弥漫性大B细胞淋巴瘤(DLBCL)的国际多中心 一线治疗的随机、双盲、安慰剂对照的Ⅲ期临床试验。该临床试验将通过生物标志物DGM1来精确筛选DB102-Enzastaurin的收益患者,这项以精准医疗为指导的临床试验申报已被CFDA受理。















