为什么《Cell》上那篇关于非侵入性脑深部电刺激的文章吸睛无数?原因之一就是脑深部电刺激(Deep brain stimulation, DBS)的作用太神奇了。即使还在手术台上,患者就能体会到这种立竿见影的疗效。
《实习医生格蕾》S01E06 中的 DBS 手术
DBS 机制并不清楚,但好在这并不影响该技术在临床上的使用,以及推进其发展所做的努力。
下文译自 2016 年 10 月《Nature》杂志关于帕金森病的 Outlooks 专栏中的文章《Electrotherapy: Shock value》。值得一提的是本文的作者 Michael Eisenstein 并不是学术界人士,而是一名自由撰稿人、科学作家。他引用了多位神经病学和神经外科专家的评论,对脑深部电刺激治疗帕金森病有非常深刻的理解。

Electrotherapy: Shock value
在医生将电极插入到你的大脑之前,你一定希望医生能够非常了解这样做的效果及其机制。然而对于帕金森病的脑深部电刺激(Deep brain stimulation,DBS)治疗,专家之间唯一完全相同的看法是:该疗法是有效的。
DBS 疗法是把毫米粗细的电极植入到大脑中,并准确定位于一个不超过玉米粒大小的靶点上。靶点位置的确定需要借助大脑影像并且需要精心计划。电极可以释放微弱的电脉冲到丘脑底核(Subthalamic Nucleus),从而控制患者的运动症状。
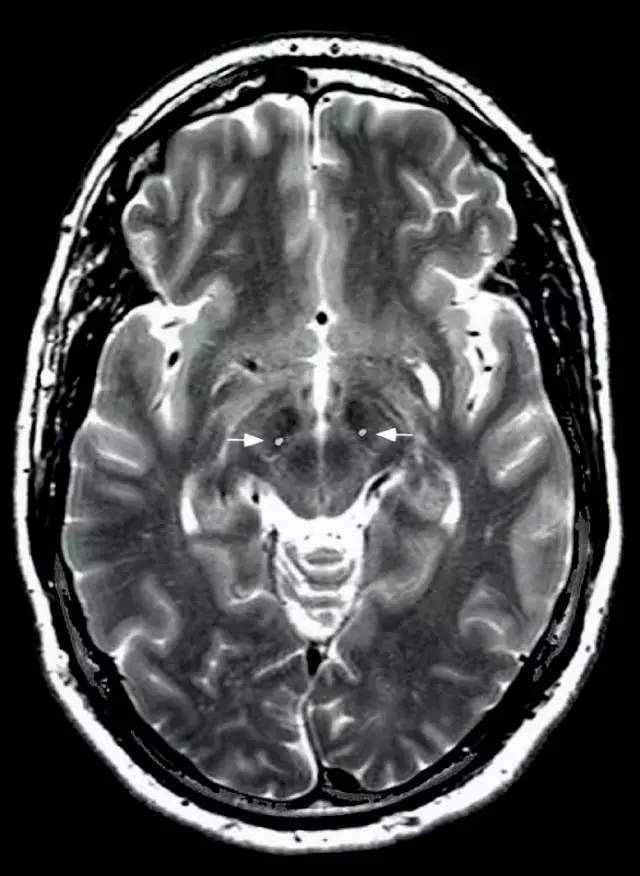
图 1 电极(白色箭头所示)定位到丘脑底核以进行电刺激
在过去几十年,医学界逐渐认可了这项技术。「该手术非常安全而且有效」,加拿大多伦多大学神经外科医生 Andres Lozano 这样说。他估计目前全世界范围内每年约有 1 万名帕金森病患者接受 DBS 手术,而至今为止已经有超过 14 万人植入了 DBS。然而,我们对 DBS 是如何恢复大脑运动环路的正常功能还知之甚少。
尽管如此,相关研究一直不断并有了一些进展,而对于该疾病理解的任何进步都可能对患者诊疗带来明显的回报。「目前我们只是用持续的电刺激轰炸大脑,奇迹是这种粗糙的干预手段竟然如此有效。」加州大学旧金山分校(UCSF)神经病学医师 Jill Ostrem 说,我们可以想象一下,如果对此有更为精细和个体化的了解,我们又能做到什么。
最大的障碍可能在于,我们对于帕金森病是如何导致大脑环路功能障碍仍然还不清楚。大多数关于该疾病神经生理的研究都聚焦在大脑的「运动环路」,由基底节、丘脑和运动皮层组成。随着帕金森病进展,可产生多巴胺递质的基底节神经元死亡,运动环路就会驶离正轨。「多巴胺在神经活动的正常运行中扮演重要角色」,Lozano 说,离开了多巴胺,神经元就开始出现异常行为,放电模式也变成了病理性。
在最初,研究者对神经元异常活动的解释青睐于「频率模型」。该模型出现于上世纪 80 年代(1980s)。美国亚特兰大埃默里大学神经病学医师 Mahlon DeLong 提出,帕金森病样症状出现是由于基底节中的丘脑底核的高频放电。
DeLong 认为这种增强的神经元放电抑制了运动环路的其他区域,还发现毁损丘脑底核可以减轻猴子的帕金森病样症状。1990s,法国神经外科医生 Alim-Louis Benabid 和他的同事依据 DeLong 的发现进行了帕金森病的 DBS 治疗。Benabid 团队证实了丘脑底核的高频电刺激缓解了病人的运动症状,如僵直。
尽管 DBS 改善帕金森病的基本原理变化不大,但频率模型已经被抛弃了。症状更可能是由于整个运动环路正常放电的「模式 (patterns) 」发生了改变,而不是在某一点上的过度放电。现在的观点是运动环路的过度同步化,UCSF 神经外科医生 Philip Star 说:「运动皮层和基底节的神经元在正常情况下是各自独立地放电的,但患病时却是同步放电」。
值得一提的是,研究者发现帕金森病患者基底节中有高强度的β频带的振荡——脑电波活动在 15-30 Hz。该频率在正常人大脑中也会出现,但在帕金森病患者大脑中明显增强,而且该频率与有意运动的延迟或受损有关。
正常情况下,基底节中生成多巴胺的神经元会阻止这种同步节律的产生;按照这种「模式」模型(Pattern Model),多巴胺能神经元减少后就失去了保护作用。但是,研究者们尚不清楚这种病理性的β振荡活动是来源于哪里。一种可能性是这种活动是从大脑的其他相连区域溢出的。
加州斯坦福大学神经病学医师 Helen Bronte-Stewart 认为,运动皮层中通常出现的β振荡活动可以通过神经元的长轴突传播到基底节。另外也不清楚的是β节律与随意运动是如何相作用的。Starr 的团队发现了一种现象,叫相位——幅度耦合,可能在此过程中有重要作用。根据这一模型,帕金森病样症状患者的运动皮层被迫按照源于基底节的β节律同步运行,而不再能独立地放电而控制身体的正常运动。
神经科学家对于 DBS 的作用机制仍是困惑不解。在频率模型盛行之时,研究者们认为 DBS 是直接抑制了 Delong 和 Benabid 等人所观察到的过度放电。然而有研究证明电刺激对于基底节神经元的作用是兴奋而不是抑制,这让神经科学家又得从头开始研究。「现在的局面是,丘脑底核电刺激在最近十年已经是世界范围内的主流疗法,有大量的证据支持,但我们仍然不知道其作用机制」,Starr 说到。
目前的「模式」模型为,DBS 是通过向基底节中引入非常规的神经活动而中止了运动环路的病态节律。「我们是在说这种病理性的活动,以及如何使之无效」,Lozano 说,没有输出总比「惹麻烦」的输出要好。但研究者们还在努力了解去同步化是如何发生的,而「模式」也没能被广泛接受。
无论具体机制如何,多数人普遍认为 DBS 所抑制的β频段放电是源于刺激所在位置的(即丘脑底核)神经元。但是日本冲绳科学技术研究所的神经科学家 Gordon Arbuthnott 等人还有另一假说。他们认为电刺激兴奋了连接运动皮层和丘脑底核间的长轴突,这种作用又逆行传递到运动皮层,而不是顺行传递到基底节。该假说认为 DBS 中断了运动皮层中的病态神经活动模式,运动皮层又反过来阻止了基底节中异常β电活动的同步化。
「运动皮层电活动、β节律的减少和症状改善之间有关系」, Arbuthnott 认为。这提示帕金森病是源于运动皮层而不是基底节。但研究仍在早期阶段,支持证据几乎都只是动物实验。然而,直接电刺激运动皮层缓解帕金森病症状的临床研究结果并不理想。
尽管作用机制仍然未知,但 DBS 就是能起作用。现在,研究者们想通过临床经验和技术进步相结合来实现电刺激的个体化治疗。
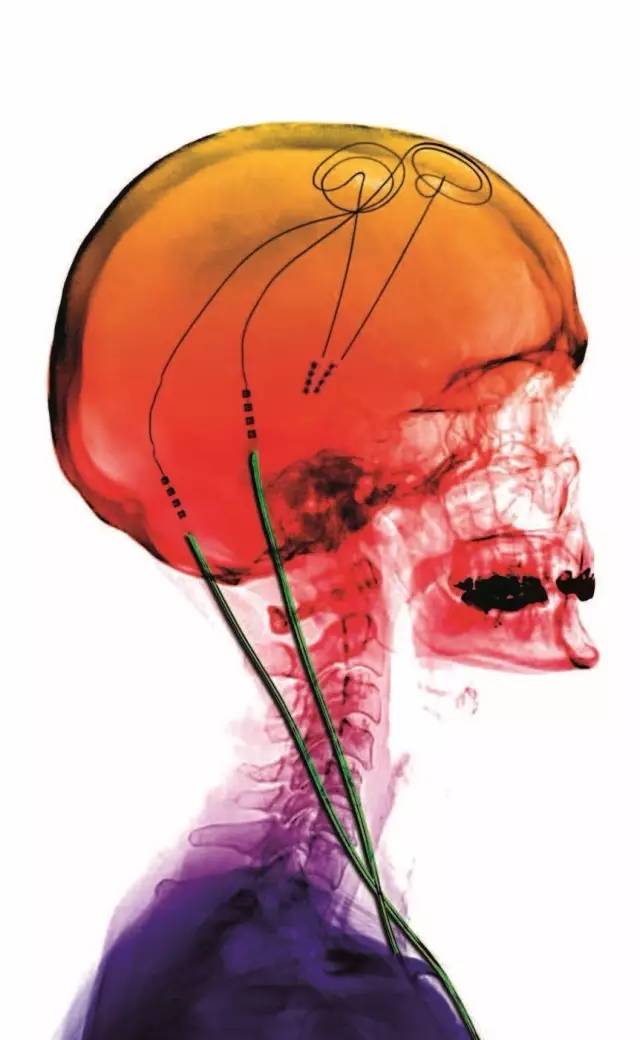
图 2 电极植入大脑后的彩色 X 射线图
一个热门的问题是,在疾病整个病程中何时手术才能最好地发挥 DBS 的作用。大部分患者都是在患病十多年后才接受 DBS 植入,这时由于疾病进展导致症状控制较为困难。一项 2013 年的临床试验(名为 EARLYSTIM)的结论是,早一些接受 DBS 植入可能对病人更有利。
在该文章发表 1 年后,美国纳什维尔范德堡大学的临床预实验则更近了一步,纳入了接受药物治疗不足六个月的患者进行 DBS 治疗。这两项研究都引起了一部分人的强烈反对,部分是由于外科手术的风险,但更重要的是担心这些患者有可能会被误诊。
然而有一些医师认为,选出能从早期干预中获益的患者并非不可能。「那些早发的、震颤为主要症状的帕金森病患者就可以」,Bronte-Stewart 说,这些患者中的不少人在接受 DBS 后可以完全不服药,而且能保持非常满意而稳定的效果,其中一些幸运儿甚至不会出现认知障碍。
目前的 DBS 是全或无的模式,通常是频率固定的连续电刺激,而频率只能由医生进行调整。不难想象,更灵活的方式应该是电刺激的时机、频率和空间分布能够自动微调以实现更好的效果并减少其副作用。
Peter Brown,英国牛津大学的一位神经病学家,正在探索新型的刺激模式。改变电刺激的时机能够从根本上影响 DBS 对于异常运动环路节律的作用,Brown 声称,「你可以通过在正确时机进行刺激来阻止异常节律,也能因为刺激时机不佳而使之恶化。」
德国尤里希研究中心的 Peter Tass 等人正努力进行相关的研究,他们称之为「协同复位」(coordinated reset),即按照一定次序刺激丘脑底核神经元的不同亚群。该研究初步结果很好,引起了 Peter Brown 教授的注意:「你可以用这种方法进行数次治疗,之后患者会有延续而稳定的症状改善,疗效甚至可以维持数周。」
DBS 的副作用包括言语障碍、非自主运动和认知损害等,这些问题在电刺激持续不断发放时更为明显。Brown 将此比喻为:「无论夏天还是冬天,一直在给屋子加热。」他的团队是目前开发适应性 DBS 的几个研究组之一,也就是电刺激可以根据某种生理学指标而自行改变,就像是在大脑中安装了「恒温器」。而这中间最困难是找到正确的「触发器」。
Brown 团队专注于基底节中的过度β频段活动,而且发现这种适应性刺激与传统的 DBS 相比疗效一致,但副作用更少。适应性的系统还更为省电,这是非常重要的优势,因为目前常用的 DBS 电池只能够使用 3-4 年左右,之后就需要做个手术进行更换。
与此同时,Starr 的团队发现运动皮质的神经元在帕金森病样症状出现时会有特征性的活动,并据此设计了一套新的刺激算法,可以在检测到这种特征性活动时开启电刺激。另外,Bronte-Stewart 团队也开发了适应性 DBS 平台,他们是通过智能手表去感知震颤,然后就会给刺激器发信号以开启刺激。
这些适应性的刺激方法也能帮助我们去揭示帕金森病患者大脑的秘密。例如,Ostrem 医生就在尝试一种新的 DBS 系统,能够在症状出现时以及症状出现前后进行大脑活动的动态监测。Ostrem 认为,这种技术加上高分辨率大脑图像数据的积累以及数学建模,能够实现针对特定神经功能异常的治疗。「帕金森病患者都有类似的症状,但很可能有不同的原因,」她说,很可能 DBS 不应该以完全相同的方式作用于每个人。
尽管揭示 DBS 的机制非常重要,但目前提高治疗精确度(Precision)的研究至少部分降低了回答这一问题的紧迫性。
目前不同帕金森病患者从 DBS 治疗中的获益程度有较大的差别。原因可能与患者的症状类型、接受手术的时机、刺激参数的选择等等都有关系。提高治疗精确度(Precision)就是要把影响患者 DBS 效果的因素找出来,并据此对各种不同类型的患者们施加相应的电刺激方式等,这也属于精准医学(Precision Medicine)的范畴。


原文:Eisenstein M. Electrotherapy: Shock value. Nature. 2016 Oct 27;538(7626):S10-S12. doi: 10.1038/538S10a.







