在细胞形态和功能上,模仿生物细胞的人造细胞,实现自主运动是设计的中心目标。细胞运动,通常涉及复杂的多蛋白机制,这对体外重组是极具挑战性的。
近日,德国 马克斯·普朗克生物化学研究所(Max Planck Institute of Biochemistry)Meifang Fu(现任职于中国科学院深圳先进技术研究院),Petra Schwille等,慕尼黑大学(Ludwig-Maximilians-Universität München)Tom Burkart,Erwin Frey等,在Nature Physics上发文,实现了细胞大小脂质体的持续运动。
这些较小的人工囊泡,主要是由大肠杆菌的MinD和MinE蛋白质系统与脂质体膜之间的直接机械化学反馈回路驱动。在脂质体周围,膜结合Min蛋白不对称地自组织,这导致形状变形,并产生诱导运动的机械力梯度。通过Min蛋白质反应-扩散动力学的固有几何敏感性,蛋白质分布响应于变形的脂质体形状。
研究表明,脂质体和Min蛋白之间的这种机械化学反馈回路,足以驱动连续运动。该项实验和理论相结合的研究,为未来设计人造细胞的运动性特征,提供了一个新起点。
Mechanochemical feedback loop drives persistent motion of liposomes.
机械化学反馈回路驱动脂质体的持续运动。
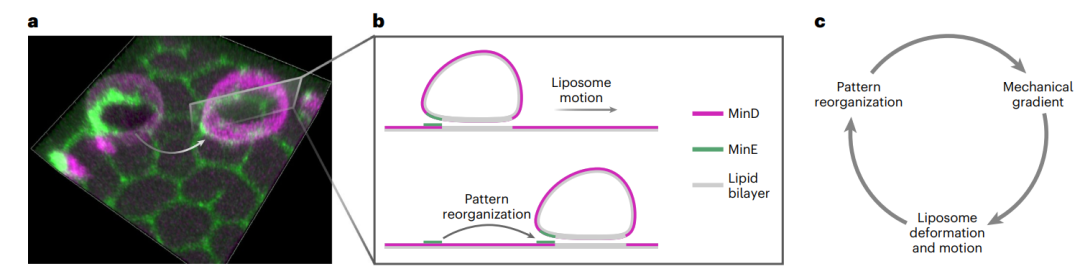 图1:基于机械化学反馈回路驱动的持续脂质体运动。
图1:基于机械化学反馈回路驱动的持续脂质体运动。
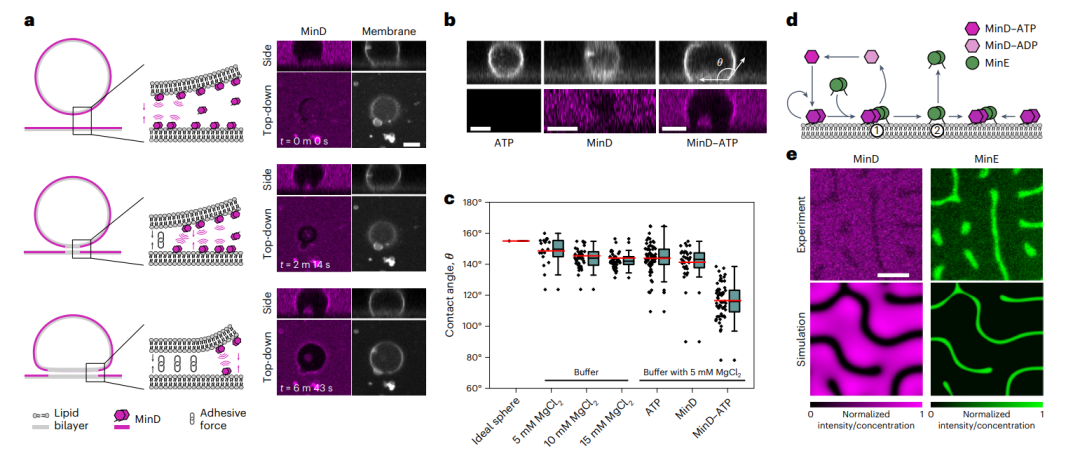 图2:蛋白MinD–ATP诱导局部脂质体,粘附于支撑磷脂膜supported lipid bilayers,SLB。
图5:在最小准静态模式时,在支撑磷脂膜SLB上,脂质体驱动的滑动。
(小注:MinD蛋白是一种普遍存在的ATP酶,在真细菌、古细菌以及植物叶绿体的分裂过程中发挥着关键的作用。MinE蛋白,在质体分裂中起着关键作用。)
图2:蛋白MinD–ATP诱导局部脂质体,粘附于支撑磷脂膜supported lipid bilayers,SLB。
图5:在最小准静态模式时,在支撑磷脂膜SLB上,脂质体驱动的滑动。
(小注:MinD蛋白是一种普遍存在的ATP酶,在真细菌、古细菌以及植物叶绿体的分裂过程中发挥着关键的作用。MinE蛋白,在质体分裂中起着关键作用。)
文献链
接
https://www.nature.com/articles/s41567-023-02058-8






