2019年3月29日,中国,上海
2019年3月29日,上海复宏汉霖生物技术股份有限公司宣布与施普林格·自然旗下的自然科研(Nature Research)签署战略合作备忘录,旨在通过出版特刊、举办论坛等方式,增进人们对生物类似药的了解,以科学、中立的态度来传播相关知识。自然科研出版了包括国际领先的科学周刊《自然》及其系列子刊在内的一系列高水准科研期刊。

▲签约仪式现场
随着第一代抗体药物陆续进入专利悬崖期,生物类似药是近年来许多制药公司致力发展的方向,它与已批准的原研生物药品(如重组蛋白、单克隆抗体、激素和细胞因子等)高度相似,但又不完全相同。与化学仿制药100%复制原研药不同,生物药分子量大、结构与理化性质复杂,对环境敏感度高,因此研发人员需要通过反向工程来探索生物类似药的生产工艺,找出适合细胞的培养环境,再通过与原研药的头对头研究来验证生物类似药与原研药药代动力学、疗效和安全性的高度类似性。到目前为止,欧洲药品管理局和美国食品与药品监督管理局FDA分别批准了17和13个抗体类生物类似药。
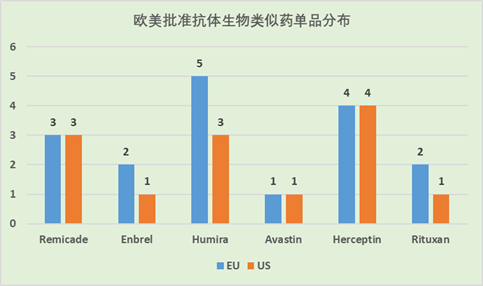
▲欧美市场批准的抗体生物类似药
虽然生物类似药在近几年发展迅猛,但是国内外尤其是国内对生物类似药的了解还极为有限,此次复宏汉霖与《自然》科研的合作,将极大地增加国内外病患对于生物类似药的认识,助力优质生物药造福更多病患。
签约仪式上,中山大学肿瘤防治中心大内科副主任黄慧强教授、解放军总医院第五医学中心乳腺内科科主任江泽飞教授依次分享了国内淋巴瘤、乳腺癌治疗领域的现状及生物类似药在各自领域的临床意义。

▲黄慧强教授出席签约仪式现场
据大量随机临床试验及长期随访数据表明,在标准淋巴瘤化疗方案中加入利妥昔单抗,可以显著提高滤泡性非霍奇金淋巴瘤和弥漫性大B细胞淋巴瘤病人的生存率以及治疗效率。自1997年利妥昔单抗上市以来,非霍奇金淋巴瘤的致死率出现拐点,明显下降。而利妥昔单抗作为国内销售额首位的抗体药物,2018年在中国境内总销售额达20.7亿元。曲妥珠单抗同样是治疗HER-2阳性乳腺癌的金牌药物,它的出现改变了HER-2阳性乳腺癌的治疗历史,经其治疗后的HER-2阳性乳腺癌患者其生存率已接近于HER-2阴性乳腺癌患者,甚至略好于后者。

▲江泽飞教授出席签约仪式现场
尽管生物药疗效良好,但其高昂的价格令患者及其家庭不堪重负。据《2017中国淋巴瘤患者生存调查》的数据,中国淋巴瘤患者以中低收入人群为主,88%的患者家庭年收入在20万元以下;在使用靶向/免疫治疗药物的患者中,有40%的患者自费金额超过家庭年收入的三倍。因此,这些金标准药品的生物类似药的研发,或将显著改善国内肿瘤领域的临床治疗。
2019年2月22日,国家药品监督管理局(NMPA)正式批准了复宏汉霖的汉利康®(利妥昔单抗注射液)的上市注册申请,是为国内首个获批的真正意义上的生物类似药,适用于非霍奇金淋巴瘤的治疗。早前时候,在广西公共资源交易中心药品和医疗器械集中采购处,挂网的复宏汉霖利妥昔单抗直接降到了1648元(100mg/10ml/瓶),比原研美罗华的价格降低了31.8%,有望显著提高国内患者对优质抗体药物的可及性。
复宏汉霖由由复星医药与海外科学家团队于2010年2月合资组建,作为目前国内领先的抗体药物研发企业,在“可负担创新”的理念支持下,复宏汉霖主要致力于应用前沿技术进行单克隆抗体生物类似药、生物改良药以及创新单抗的研发及产业化,在上海、台北和美国加州均设有研发中心。该公司首个产品利妥昔单抗注射液已与2019年2月获国家药品监督管理局(NMPA)批准,是中国大陆首个获批上市的生物类似药。
根据其官网资料,复宏汉霖当前开发的产品主要覆盖肿瘤、自身免疫性疾病等领域,其13个产品、2个联合治疗方案已完成23项适应症的临床试验申请,累计获得全球范围内29个临床试验许可(中国大陆19个,中国台湾3个,美国3个,欧盟、澳大利亚、乌克兰和菲律宾各1个)。

▲复宏汉霖产品研发管线
总体来说,生物类似药在中国还是一个比较新的概念。复宏汉霖联合创始人、总裁兼首席执行官刘世高在签约仪式上说:“作为国内首家获批的生物类似药生产企业,复宏汉霖有责任向医生、监管者和病人传播有关生物类似药方面专业和客观中立的知识。我们希望通过和自然科研的合作,以及我们对生物类似药科普教育的支持,能够广泛提高大众对生物类似药的了解,并最终帮助更多的患者实现可负担得起的治疗。”

▲复宏汉霖联合创始人、总裁兼首席执行官刘世高博士出席签约仪式现场
自然科研大中华区总监Paul Evans表示:“除了发表高质量的科研成果,自然科研还借助自己的专业经验、学术传播平台和网络,促进知识的传播和帮助我们的客户与其服务的群体进行沟通交流、提升品牌声誉和影响力。我们在中国已为许多科研机构提供了这一系列的服务,也十分荣幸能为包括复宏汉霖在内日益增多的企业客户提供相关服务和支持。”

▲自然科研大中华区总监Paul Evans出席签约仪式现场
复宏汉霖高级副总裁兼首席医学官陆英明介绍,本次复宏汉霖和自然科研的合作主要包括两大方面。首先,双方将合作于《自然》主刊出版特刊Nature Outlines,深入浅出地向读者介绍生物类似药的概念。比如,用图表的形式来展示生物类似药的发展潜力及面临的科学挑战。该特刊将于今年5月出版发行。
此外,双方将共同举办“自然科研圆桌会议”,为临床医生、药物经济学家、监管者和政策制定者研究探讨生物类似药提供一个客观及科学的交流平台。“自然科研圆桌会议”定于今年6月末召开,届时5位来自国内外的肿瘤学专家、以及临床研究、药物经济学和政策监管方面的嘉宾将发表主旨演讲,并与参会听众深入探讨对于生物类似药的不同观点,激发国内对生物类似药发展的思考。
相似性研究一直是生物类似药的研发难点,自2010年开始到现在,复宏汉霖坚持按照国际质量标准进行药学质量对比,并与原研药做头对头的比较研究,高标准要求自己以全球化的标准进行生物类似药的开发。2019年2月,汉利康与原研利妥昔单抗结构比对的数据在权威杂志《mAbs》上线,12个批次的HLX01与15个批次中国市场和7个批次欧洲市场的原研药进行了全面的质量属性比对研究,包括一级结构、高级结构、纯度、糖型、和十几种的生物学活性和免疫学特性的比对,显示高度的相似性。
作为国内生物类似药研发的有力推动者,希望此次复宏汉霖与《自然》科研的合作建立的平台将加速生物类似药在我国及全球的研发和使用。
上海复宏汉霖生物技术股份有限公司由复星医药与海外科学家团队于2010年02月合资组建,公司主要致力于应用前沿技术进行生物类似药、生物改良药以及创新型单抗的研发及产业化,在中国上海、台北和美国加州均设有研发中心,产品覆盖肿瘤、自身免疫性疾病等领域。
截至目前,复宏汉霖13个产品、2个联合治疗方案已完成23项适应症的临床试验申请,累计获得全球范围内29个临床试验许可(中国大陆19个,中国台湾3个,美国3个,欧盟、澳大利亚、乌克兰和菲律宾各1个)。其中,公司首款重磅产品汉利康®(利妥昔单抗)已获国家药监局上市注册批准,成为首个获批上市的国产生物类似药。另一重磅产品HLX03也已获得国家药品监督管理局新药上市申请受理。
自然科研(Nature Research)提供一系列专门服务于科研共同体的优质产品与服务,涵盖生命科学、物理、化学和应用科学,包括了期刊、数据库和研究者服务等。
《自然》杂志(Nature)创建于 1869 年,是国际领先的科学周刊。此外,自然科研还出版一系列 冠名“自然”的订阅型期刊、重要的多学科开放获取期刊《自然-通讯》(Nature Communications)、 包括《科学报告》(Scientific Reports)在内的其它一些开放获取期刊,以及与科研机构和协会合 作出版的自然合作期刊(Nature Partner Journals)。这些期刊同心协力,发表了世界上一些最重要的科学发现。
欢迎加入小编团队成为小编一员
请加小编微信号:wuwenjun7237
如有技术解读、行业洞见愿意分享
欢迎投稿到小编邮箱:[email protected]















