不发通知、不打招呼、直插企业!国家、省级药监局检查组飞往各地,大批医疗器械企业被查!
日前,国家药品监督管理局食品药品审核查验中心发布《核查中心2019年第四批医疗器械飞行检查情况汇总》,
28家械企被查,4家械企业被要求继续停产整改。

↓滑动下图查看↓
统计发现,被“点名”企业一半以上在检查中被发现了至少10项缺陷项,其中哈尔滨市天使卫生材料厂的缺陷项多达15项。而陕西阳光生物工程股份有限公司是唯一存在严重缺陷项的企业。
紧接着12月31日、1月3日,国家药监局又接连发布两则飞检公告。


广西双健科技有限公司、广西双健科技有限公司因质量生产管理体系存在严重缺陷,不符合医疗器械生产质量管理规范相关规定,被要求停产整改。
↓
滑动下图查看
↓
早在今年7月,国家药监局又发布了《关于建立职业化专业化药品药品检查员队伍的意见》,涉及医疗器械领域。
文件规定,在检查体制和机制上,将分为国家级和省级两个检查员队伍,配备满足检查工作要求的专职检查员。
按照国际通行做法,较发达国家和地区的药品监管机构,无一例外地都拥有高素质的专职检查员队伍,以及聘用、培训、考核和使用等完备的管理体系。
业内观点认为:
未来,我国的职业检察员也将考虑国际通行做法,同时兼顾我国国情,职业检察员工作内容将从过去认证现场检查、跟踪检查等方式,扩展到专项监督检查、飞行检查、注册现场检查、进口检查等药品全生命周期。
未来,
医疗器械检查将实现飞检常态化,力度也更强。
不止国家药监局,在农历新年到来之前,各省纷纷开展医疗器械飞检,多家械企业被查!
近日,浙江省药监局发布《2019年全省医疗器械生产企业飞行检查情况通报》。
浙江省药监局对全省90家医疗器械生产企业组织开展了飞检
,其中第三类医疗器械生产企业86家(无菌产品46家、植入性19家、体外诊断试剂13家、其他8家),第二类医疗器械生产企业4家(无菌2家、体外诊断试剂1家、其他1家)。
检查企业中,
10家企业生产质量管理体系存在严重缺陷,72家企业质量管理体系存在一般缺陷,
省局对相关企业负责人和管理者代表进行约谈,并责令企业评估风险,进行整改。
↓滑动下图查看↓
日前,湖北省药品监督管理局发布公告称,今年9月组织开展了全省医疗器械生产企业飞行检查,
此次飞行检查共派出17个检查组,检查医疗器械生产企业65家,
其中无菌医疗器械生产企业32家,义齿及口腔材料生产企业17家,体外诊断试剂生产企业3家,其他医疗器械生产企业13家。
检查结果显示,现场处于停产状态医疗器械生产企业10家,
55家医疗器械生产企业共发现缺陷项289项,其中严重缺陷项17项,一般缺陷项272项。
其中,武汉市康寿医用材料有限公司等9家生产企业不符合医疗器械生产质量管理规范及相关附录的规定,生产质量管理体系存在严重缺陷,被责令停产整改;仙桃市兴荣防护用品有限公司等46家生产企业的质量管理体系存在一般缺陷问题,被责令限期整改。
对此,湖北省药品监督管理局提出4点要求:
近期,河南省药监局对29家医疗器械生产企业组织开展了飞行检查。
25家医疗器械生产企业均不同程度存在问题,被省药监局责令限期整改。11家械企被发现存在一般缺陷达到10个以上。
↓
滑动
下图查看
↓
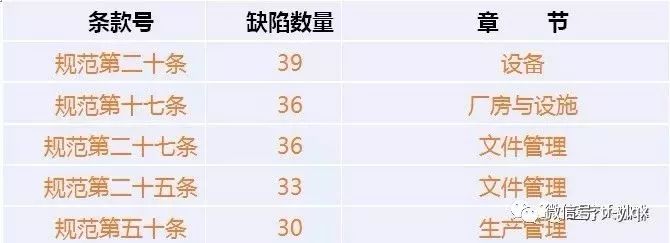
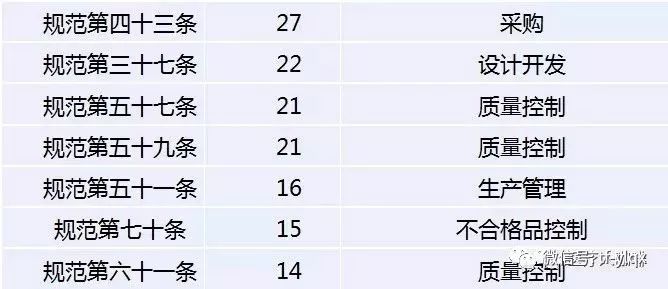
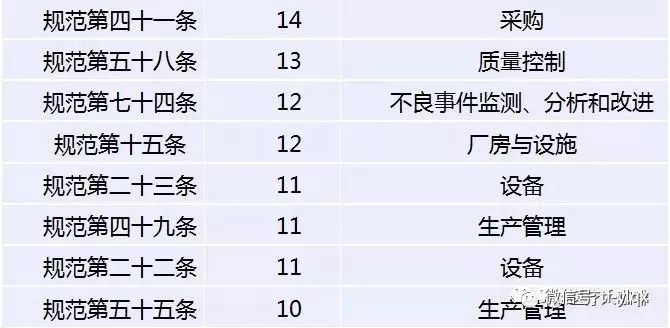
医疗器械飞检,到底哪个条款最容易出问题?
根据“医疗咖啡人微信公众号”对2018年医疗器械飞检查出的问题汇总分析,2018年的飞检缺陷共754条,分别落在《医疗器械生产质量管理规范》、“无菌附录”、“植入附录”、“体外诊断试剂附录”和“义齿附录”的156个条款上。
其中缺陷对应条款,预料之中主要是与规范相关的条款,涉及542条,其次是无菌105条。
考虑缺陷的集中度,对重复10次出现的条款号进行梳理,
发现有20个条款最容易出现问题,总共出现缺陷404项,占总数的53.6%。
可以说,这些企业被查出的问题,也是医疗器械企业最易出现问题的领域。