来自:安徽省食品药品审评认证中心
主要内容:
药品生产管理基本要求
防止污染和交叉污染的措施
药品生产关键工艺控制(固体制剂案例)
验证状态的维护
药品生产管理基本要求:
生产工艺和质量标准符合法规要求
《药品注册管理办法》第29条:
申请人获得药品批准文号后,应当按照国家食品药品监督管理局批准的生产工艺生产。药品监督管理部门根据批准的生产工艺和质量标准对申请人的生产情况进行监督检查。
2010年版GMP第184条:
所有药品的生产和包装均应当按照
批准的工艺规程
和
操作规程
进行操作并有相关记录,以确保药品达到规定的质量标准,并符合药品生产许可和注册批准的要求。
生产管理总纲:依法生产

强调现场管理
对生产过程中影响产品质量的各个因素进行控制,确保能够持续稳定地生产出符合预定用途和注册要求的药品。
现场管理
卫生管理
※洁具管理:分类、整洁
※工衣清洗:按时、区分
※更衣要求:标准程序更衣
※清洁、消毒:规定、执行和记录
物料控制
※状态标识明确、信息完整
※数量、帐、卡和物一致
※放行控制明确,质量参与
※特殊物料管理 (不合格物料、召回产品),规定区域、标识、隔离和记录
※储存条件
标识管理
※文件、记录标识:有效版本控制
※设备状态标识:完好/运行/待修/停用
※各种容器标识:已清洁/待清洁/有效期限
※生产区域标识:已清洁/待清洁/相关生产区域使用
※生产状态标识:生产品名/批号/规格/生产开始时间
※管道内介质名称及流向
※计量标识等:校验合格/有效期/停用/校验不合格等
人员管理
※是否进行基本知识、基本技能的培训
※是否经培训与考核合格允许上岗
※记录及时规范
※规范执行
最终实现:
现场整洁、有序;标识完整、清晰;记录填写完整、清晰、及时;行为符合SOP
采取措施最大限度减少生产过程中污染、交叉污染以及混淆、差错的风险。
※污染来源:
硬件固有风险(布局、材料、空调系统、设备选型)
人员及其操作引入风险(物料流转、清洁、环境监控)
※基于产品生产特点查找污染的风险点并采取措施
普通制剂:易产尘(交叉污染)和辅料多(混淆、差错)
无菌制剂:污染(微生物、尘粒、热源)
包装操作:同时包装多个规格品种等情况
批号管理
第185条 应当建立划分产品生产批次的操作规程,生产批次的划分应当能够确保同一批次产品质量和特性的均一性。
第186条 应当建立编制药品批号和确定生产日期的操作规程。每批药品均应当编制唯一的批号。除另有法定要求外,
生产日期不得迟于产品成型或灌装(封)前经最后混合的操作开始日期,不得以产品包装日期作为生产日期。
第312条 (二十七)批
例如:口服或外用的固体、半固体制剂在成型或分装前使用同一台混合设备一次混合所生产的均质产品为一批;口服或外用的液体制剂以灌装(封)前经最后混合的药液所生产的均质产品为一批。
原料药批号管理-附录
第32条 原料药生产批次的划分原则:
(一)连续生产的原料药,在一定时间间隔内生产的在规定限度内的均质产品为一批。
(二)间歇生产的原料药,可由一定数量的产品经最后混合所得的在规定限度内的均质产品为一批。
无菌药品批号管理-附录
第60条 除另有规定外,无菌药品批次划分的原则:
(一)大(小)容量注射剂以同一配液罐最终一次配制的药液所生产的均质产品为一批;同一批产品如用不同的灭菌设备或同一灭菌设备分次灭菌的,应当可以追溯;
(二)粉针剂以一批无菌原料药在同一连续生产周期内生产的均质产品为一批;
(三)冻干产品以同一批配制的药液使用同一台冻干设备在同一生产周期内生产的均质产品为一批;
(四)眼用制剂、软膏剂、乳剂和混悬剂等以同一配制罐最终一次配制所生产的均质产品为一批。
生物制品分批管理(药典三部-生物制品分批规程)
※成品批号应在半成品配制之后确定,配制日期即为生产日期。非同日或同次配制、混合、稀释、过滤、灌装的半成品不得作为一批。
※单一批号的亚批编制应仅限于以下允许制定亚批的一种情况:
(1)半成品配制后,在分装至终容器之前,如须分装至中间容器,应该中间容器划分为不同批或者亚批。
(2)半成品配制后,如采用不同过滤器过滤,应按不同批或者亚批。
(3)半成品配制后直接分装至终容器时,如采用不同分装机进行分装,应该按分装机划分不同批或者亚批。
(4)半成品配制后经同一台分装机分装至终容器,采用不同冻干机进行冻干,应该冻干机分为不同亚批。
中药饮片批号管理(附录中药饮片征求意见稿)
第29条 对每次接收的中药材均应当按产地、供应商、采收时间、药材规格等进行分类,分别编制批号并管理。
第48条 中药饮片批号应以同一批中药材在同一连续生产周期生产一定数量的相对均质的中药饮片为一批。
生产时间管理
◆
生产指令又称生产订单,是产品生产的计划性指令,是生产安排的核心,用于指导现场生产安排,对企业所生产的产品品种、数量、质量和生产进度等方面所作的统筹安排,是企业生产管理的依据。
◆在无菌药品生产计划管理中,不建议采用三班满负荷生产
,因为这样没有办法保证有效的清洁和消毒。
时限管理
第197条
(十)液体制剂的配制、过滤、灌封、灭菌等工序应当在规
定时间内完成;
(十一)软膏剂、乳膏剂、凝胶剂等半固体制剂以及栓剂的
中间产品应当规定贮存期和贮存条件。
时限管理-附录无菌药品
第56条 应当尽可能缩短包装材料、容器和设备的清洗、干燥和灭菌的间隔时间以及灭菌至使用的间隔时间。应当建立规定贮存条件下的间隔时间控制标准。
第57条 应当尽可能缩短药液从开始配制到灭菌(或除菌过滤)的间隔时间。应当根据产品的特性及贮存条件建立相应的间隔时间控制标准。
时限管理目的
※控制灭菌前后或者过滤前后微生物水平。
※产品在存放过程中可能会发生降解,实际上对物料存放周期的考察。
清洁与清场
第194条 每次生产结束后应当进行清场,确保设备和工作场所没有遗留与本次生产有关的物料、产品和文件。下次生产开始前,应当对前次清场情况进行确认。
第199条 生产开始前应当进行检查,确保设备和工作场所没有上批遗留的产品、文件或与本批产品生产无关的物料,设备处于已清洁及待用状态。检查结果应当有记录。
生产操作前,还应当核对物料或中间产品的名称、代码、批号和标识,确保生产所用物料或中间产品正确且符合要求。
第203条 包装开始前应当进行检查,确保工作场所、包装生产线、印刷机及其他设备已处于清洁或待用状态,无上批遗留的产品、文件或与本批产品包装无关的物料。检查结果应当有记录。
清洁与清场
清场与清洁目的:防止交叉污染与污染、混淆
清场与清洁内容:
物料、
记录、
设施与设备、
环境
清场记录
大清洁与小清洁
※当切换生产产品时,需要进行彻底清洁,其程序需验证。
※如果是同一产品的连续生产,则不需要每批生产之后都要进行一次清洗,则可确定一定的时间间隔和检测方法。
产量限度与物料平衡
第一百七十条(二)
预期的最终产量限度,必要时,还应当说明中间产品的产量限度,以及物料平衡的计算方法和限度;
第一百七十五条(八)
不同生产工序所得产量及必要时的物料平衡计算;
第一百八十七条
每批产品应当坚持产品和物料平衡,确保物料平衡符合设定的限度。如有差异,必须查明原因,确认无潜在质量风险后,方可按照正常产品处理。
防止污染和交叉污染的措施
法规要求
第197条 生产过程中应当尽可能采取措施,防止污染和交叉污染,如: (一)在分隔的区域内生产不同品种的药品;
(二)采用阶段性生产方式;
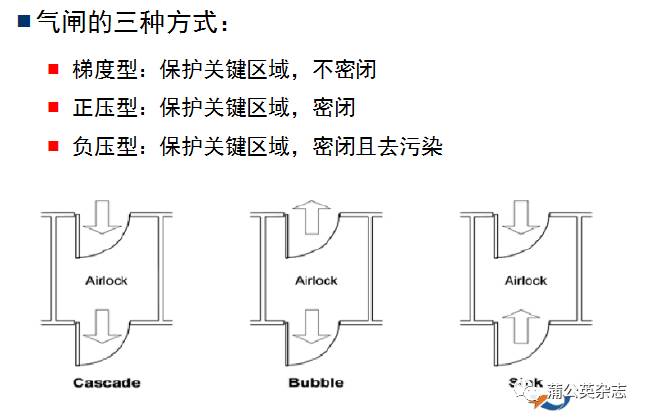
(三)设置必要的气锁间和排风;空气洁净度级别不同的区域应当有压差控制;
(四)应当降低未经处理或未经充分处理的空气再次进入生产区导致污染的风险;
(五)在易产生交叉污染的生产区内,操作人员应当穿戴该区域专用的防护服;
(六)采用经过验证或已知有效的清洁和去污染操作规程进行设备清洁;必要时,应当对与物料直接接触的设备表面的残留物进行检测;
(七)采用密闭系统生产;
(八)干燥设备的进风应当有空气过滤器,排风应当有防止空气倒流装置;(九)生产和清洁过程中应当避免使用易碎、易脱屑、易发霉器具;使用筛网时,应当有防止因筛网断裂而造成污染的措施;
(十)液体制剂的配制、过滤、灌封、灭菌等工序应当在规定时间内完成;(十一)软膏剂、乳膏剂、凝胶剂等半固体制剂以及栓剂的中间产品应当规定贮存期和贮存条件。
第198条 应当定期检查防止污染和交叉污染的措施并评估其适用性和有效性。
药品生产全过程
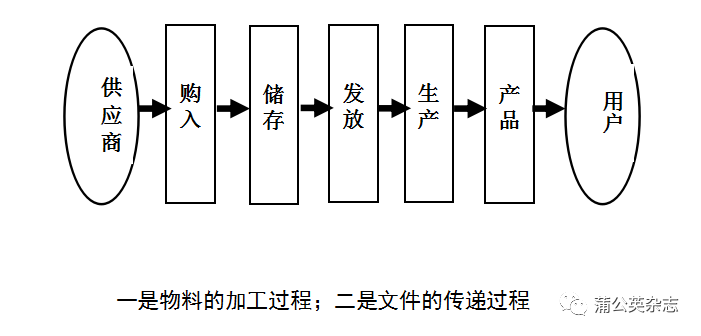
生产过程中产生污染和混淆的可能随时存在,必须在全过程各个环节都加强管理和监控。
主要引起污染和混淆的因素为:
生产中原材料
生产环境
设备器具
人员行为
文件传递等
1、生产中的原材料
原辅料和包装材料
产品-中间产品、待包装产品、成品
工艺用气- 氮气、二氧化碳、压缩空气
工艺用水-饮用水、纯化水、注射用水
消毒剂、清洁剂等
生产区废弃物:如废品、废包材、空原料桶等
引起污染、交叉污染、差错、混淆的环节

采取的措施
硬件方面
足够的空间(面积、区域)确保有序存放
有通风和照明等设施满足贮存条件
有监控措施。
物料取样区的设置
软件方面
操作规程确保接收、贮存、发放、使用和发运正确
适宜的方法,确认每一包装内的原辅料正确
称量过程的管理(称量、复核、集中存放、标识)
对各岗位人员针对性的培训和考核
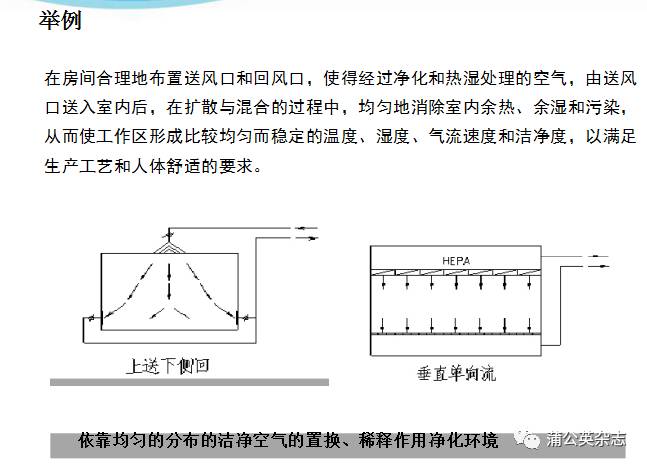
2、生产环境
位址
布局
洁净级别
生产区的条件
建筑环节:
选址、材料、施工效果、地漏设计等
功能间设计:
区域、面积足够
环境监控:
洁净级别、温湿度、防虫鼠等
厂房清洁/维护
避免设计缺陷:
科学设计、合理布局
完善厂房确认工作:
洁净级别、压差、风速风量、温湿度等符合设计需求。
完善环境监测:
监测时机/频率/人员/监测点等
清洁维护保养操作规程:
人员/何时做/如何做等
人员培训
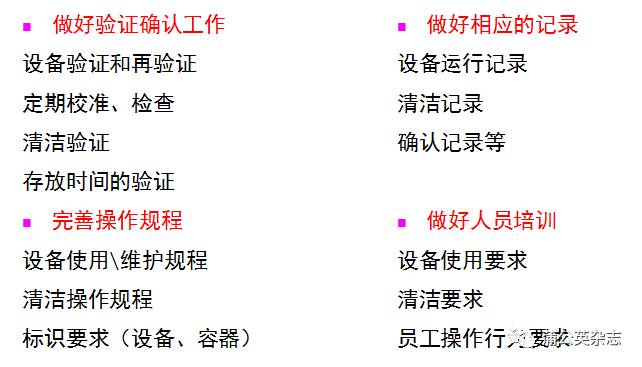
3、生产设备
固定的设备:如压片机、制粒机、灌装机等
设备备件/工艺管道:如冲头、倒料口、物料管等
容器具:如周转桶、周转盘、桶盖等
动力设备:如电机等
清洁设备:CIP\SIP、自动清洗机等
设备与器具选型与安装:
材质与表面光洁度、完好性
设备的清洁与消毒效果:
残留、存放
设备器具的使用:
组装、标识
CIP/SIP、自动清洗设备的使用:
程序、组装
4、人员
库房管理人员
生产操作人员
设施设备维护管理人员
质量管理人员
保洁人员
人员及其活动是最大的污染源
进出洁净区:
频次、数量、更衣、动作幅度、卫生状况等
操作行为:
物料转运、生产操作、清洁清场、环境监测等与规范要求的差距
加强培训,培养人员良好的行为规范:
进出数量和次数、规范的更衣习惯、缓慢小心移动的习惯、避免裸手接触的习惯、良好的个人卫生习惯等
完善操作规程,指导并约束人员行为:
详细的各岗位操作规程、卫生操作规程等
创造适当条件
舒适的环境、密封的设备、顺畅的工艺流程等

















