药明康德/报道
CRISPR基因编辑技术是近期业内的一大讨论热点。一周前,《自然》子刊《Nature Methods》上的一篇论文发现,经过CRISPR编辑的两只小鼠内出现了不少预料外的基因突变,这也引发了一场关于CRISPR潜在脱靶性的大讨论。不少CRISPR的行家们在讨论中表示,关于这一结论,我们仍然需要更多设计更为严格的实验进行验证。

相关阅读:CRISPR大危机?Nature子刊确认小鼠体内出现数百种意料外的脱靶突变
今日,自然出版集团旗下的《Cell Research》期刊上在线刊登了一篇来自中国科学院神经科学研究所杨辉博士团队的最新论文。利用CRISPR基因编辑技术,研究人员能够通过简单的“一步反应”,彻底敲除小鼠或是猴子体内的特定基因。这一工具对于基础科研中动物模型的建立能起到提速的作用,意义重大。此外,这篇论文中利用全基因组测序来评估CRISPR潜在脱靶效应的数据,也从侧面表明在严格的控制下,这一技术的脱靶效应也许并不如《Nature Methods》的论文所提的那样严重。

▲本项研究的主要负责人杨辉博士(图片来源:中国科学院神经科学研究所)
先来看看杨辉博士团队这篇论文诞生的大背景。我们知道,CRISPR技术能够按研究人员的需求来高效敲除动物体内的特定基因,做到“精准编辑”。但在实际操作中,科学家们常常发现,动物体内总有一些漏网的细胞,逃脱了CRISPR的编辑。这被称为“嵌合现象”。这种出现嵌合的动物往往需要几代的培育和杂交,才能得到基因被完全敲除的个体。因此,如何扩大CRISPR技术的编辑面,在源头做到“不放过一个细胞”,就成了业内研究的一个热门方向。
先前,不少科学家们尝试了多种不同的手段,以求达到这一目的。一些科学家尝试将Cas9的mRNA与向导RNA(sgRNA)注射入卵母细胞(oocyte),而不是常用的受精卵(zygote);一些科学家尝试过直接注射Cas9蛋白;另一些科学家则注射过多条sgRNA。这些实验都取得了一定的成果,但获取基因被完全敲除的动物的效率较低,从而限制了它们的应用。
在本项研究中,来自中国的科学家们做了一个新的设想——如果在受精卵内注射多条sgRNA,是否会提高基因敲除的效率呢?为了检验这个想法,他们让野生型的母鼠与带有纯合Actin-EGFP的公鼠进行交配,并在受精卵中注射入了Cas9 mRNA以及多条靶向GFP的sgRNA。这些sgRNA在GFP基因的外显子中相隔10-200个碱基对,研究人员们相信这样的设计能以更高的频率敲除特定基因。
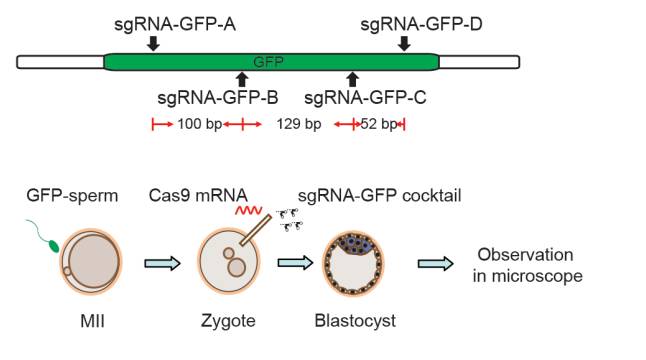
▲研究人员相信,在同一条基因的外显子中引入多个sgRNA,有望提高基因敲除的效率(图片来源:《Cell Research》)
在后续的分析中,研究人员的设想得到了证实。在没有经历基因编辑的对照组中,所有发育中的囊胚(blastocysts)都带有GFP的绿色荧光。在只有1条sgRNA注射的情况下,大约有31%-44%的囊胚没有出现绿色荧光,表明GFP基因得到了敲除。但是剩下的那些囊胚则展现出了“嵌合现象”,即部分细胞的GFP被敲除,部分细胞依旧有GFP基因。而在使用2条,3条,乃至4条sgRNA的实验组中,所有接受注射的囊胚中,GFP信号都消失了。这表明靶向的基因得到了完全的敲除。值得一提的是,多条sgRNA的引入并不会影响囊胚的生存。
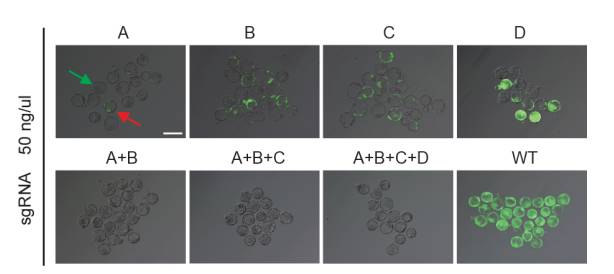
▲随着sgRNA数量的增加,表达GFP荧光的细胞也随之减少(图片来源:《Cell Research》)
由于在该实验中,GFP基因在受精卵中属于杂合状态(只有父亲为受精卵提供了GFP的基因),研究人员随后进一步测试了该方法敲除纯合子中特定基因的能力(即同时敲除两个等位位点)。这一次,他们的目标是酪氨酸酶基因Tyr,它会影响小鼠色素的形成。在这项实验中,研究人员开发的工具得到了类似的出色成果——使用3条或4条靶向Tyr基因的sgRNA后,所有的小鼠呈现“白化”症状,表明相关的成色基因已被彻底敲除。相反,如果使用1条或2条相关的sgRNA,效果则没有那么好。这一结果再次表明,通过引入多条sgRNA,人们可以极大提高在动物体内的CRISPR基因编辑效率,做到对特定基因的完全敲除。

▲多条sgRNA敲除了小鼠体内的成色基因,让它们变白(图片来源:《Cell Research》)
接下来,研究人员又测试了这套系统在猴子里的效率。在神经科学领域,猴子是主要的动物模型之一,并且因为与人的接近而受到研究人员的喜好。一些专家们指出,在“中国脑计划”中,以非人灵长类动物为模型,研究人员能够研究思考、自我意识、共情和语言等人类的高级认知功能。建立起合适的动物模型,也就成了研究的重点之一。与小鼠不同,猴子的生长周期较长。如果CRISPR基因编辑技术仅能部分敲除特定的基因,研究人员就需要用很长的时间去进行纯合动物的建立。这无论从科学角度,或是伦理角度,都不合适。如果这套系统能够在猴子体内一步到位,彻底敲除特定的基因,无疑是个重大利好。
在猴子实验中,研究人员在29个胚胎中各自注射了3条靶向Prrt2基因的sgRNA,这个基因的突变会导致阵发性运动诱发的运动障碍(paroxysmal kinesigenic dyskinesia, PKD)。这些胚胎被移植入了9只代孕的母猴,并成功让其中一只母猴生下了两只小猴。其中一只小猴的组织样本表明,Prrt2基因得到了完全的敲除。这个结果也表明了这套系统在猴子体内的可行性。

▲这只小猴体内的Prrt2基因得到了彻底敲除(图片来源:《Cell Research》)
接下来,研究人员分析了这套系统的脱靶效应。这篇论文提到,利用全基因组测序的手段,他们对活体动物进行了CRISPR潜在脱靶效应的评估。在小鼠的10201个潜在脱靶位点,以及猴子的19447个潜在脱靶位点中,他们发现的插入/删除突变(indels)并不多见。其中有6只小鼠和1只猴子的体内未检测出插入/删除突变。这也在一定程度上,支持了CRISPR技术的安全性。
总结来说,研究人员们表示他们开发了一种全新的策略,能够“一步到位”,在小鼠与猴子体内减少CRISPR编辑中出现的“嵌合现象”。将来,他们希望能测试更多的基因位点,并且研究这套系统在其他物种,比如其他非人灵长类动物里的应用前景。
点击“阅读原文”,即可访问原始论文页面。
参考资料:
[1] One-step generation of complete gene knockout mice and monkeys by CRISPR/Cas9-mediated gene editing with multiple sgRNAs
















