正文
无论从质量还是数量来看,相较于2016年全年的中国制药企业ANDA表现,2017年上半年各上场选手的表现都有过之而无不及。
首先是石药欧意的异军突起。2016年全年,石药欧意仅有一个盐酸二甲双胍片获批ANDA,在从2008年至2015年的八年时间中,石药欧意仅有4个ANDA在美获批。而在2017年上半年,石药欧意便有孟鲁司特钠咀嚼片、硫酸氢氯吡格雷片、孟鲁司特钠片等三个ANDA获批。
其次是江苏恒瑞的重磅来袭。2017年1月份与2月份,江苏恒瑞分别的注射用顺苯磺酸阿曲库铵与多西他赛注射液分别获批,一个是恒瑞的当家重磅产品,2015年国内销售额近10亿元;一个则是临床上最常用的抗肿瘤药之一,在美的市场空间近5亿美元。
而诸如华海、人福、南通联亚等美国ANDA获批名单的常客,2017年自然也不会缺席。华海通过其美国子公司普林斯通共实现三个ANDA批号,适应症范围既包括了其主力战场高血压领域,也开始进一步扩大其精神类产品线;南通联亚的吲哚美辛缓释胶囊顺利获批;人福医药则通过其全资子公司Epic拿到了用于治疗癫痫疾病的加巴喷丁胶囊的ANDA,而该药2016年在美的总销售额也达到2亿美元。
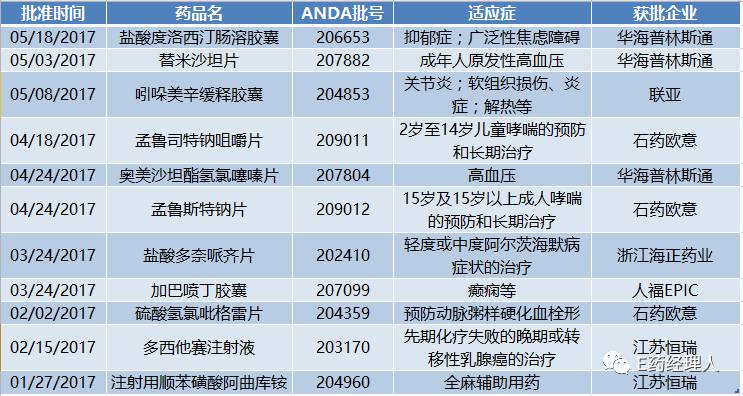
截至2017年6月26日中国制药企业ANDA申请情况
石药欧意:异军突起
2017年上半年,石药欧意在ANDA获批方面的表现是亮点之一。
一方面体现在数量的进步上。随着“创新”与“国际化”正式成为石药集团的两大核心战略,石药集团在国际化的布局方面显然已颇下功夫。据FDA官网信息统计,到目前为止石药集团共有8个ANDA批号,其中3个是于2017年上半年获得。石药集团副总裁张赫明此前在接受媒体采访时表示,目前除已上报美国FDA审批的8个ANDA品种之外,石药集团还有在研品种17个。与此同时,石药集团一类新药丁苯酞软胶囊目前也已经在美国开展II期临床,盐酸米托蒽醌脂质体注射液在美国的新药申请(IND)亦已于2016年3月递交美国FDA。
而另一方面则体现在质量中。此前,石药欧意药业通过ANDA审批的品种盐酸二甲双胍片已经出现在了CDE的拟优先审评名单中,CDE给出的理由是“同一生产线生产,已在美国上市,申请国内上市的仿制药”。按照仿制药质量与疗效一致性评价的相关规定,在中国境内用同一条生产线生产上市并在欧盟、美国或日本获准上市的药品,经一致性评价按公式审核批准后视同通过一致性评价,也就是说,石药集团完全可以凭借在美申请ANDA的优势率先杀回国内抢占市场。
江苏恒瑞:肿瘤药集群已现
将视线回归研发大佬江苏恒瑞的身上。
作为国内最以研发见长的医药公司,恒瑞医药一直以来在ANDA获批的数量上都并不明显,到目前为止,恒瑞医药也仅有7个ANDA批准文号而已。但纵观品种名单便不难发现,恒瑞的特点在于少而精,尽管数量较少,但几乎获批的产品都是能带来大量利润的重磅产品。
2017年1月27日,恒瑞医药的麻醉用药顺苯磺酸阿曲库铵ANDA申请被FDA批准。作为恒瑞医药的当家重磅之一,该药2015年国内销售额近10亿元。而在美国,阿曲库铵现有Abbvie、Sandoz、Fresenius Kabi等三家供应商,市场规模约为5100万美元,而恒瑞医药的产品上市之后,预计销售峰值则可达到1200-1500万美元。尽管相对来说市场体量不大,但该药仍有望在2017年下半年起助力恒瑞的出口业务增长。
另一个获批的多西他赛则是临床上最常用的抗肿瘤用药之一。此前,恒瑞医药在美获批的伊立替康、来曲唑、奥沙利铂、环磷酰胺等均为抗肿瘤药物,因此多西他赛的获批也标志着恒瑞的抗肿瘤梯队进一步丰富,正逐步形成抗肿瘤用药集群。












