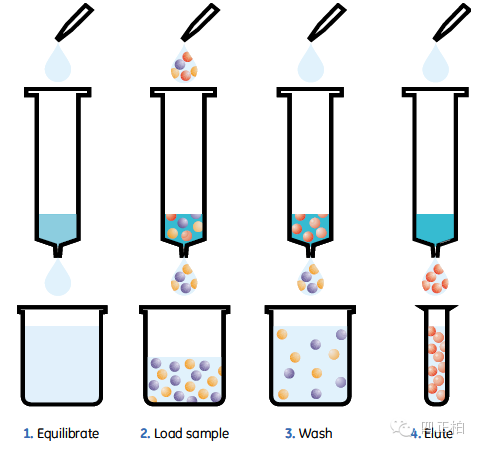
蛋白过镍柱纯化的原理:Ni-NTA
纯化介质纯化带有His6-Tag的融合蛋白是目前蛋白纯化中最常使用的一种方法。
Ni
柱中的氯化镍或者硫酸镍可以与有HIs(组蛋白)标签的碱性蛋
白蛋白
结合,组蛋白标签一般是
6个组氨酸(碱性氨基酸)。在蛋白上样后,带有组氨酸标签的蛋白特异性结合到柱子里,其他的杂蛋白流出。Ni柱中的氯化镍或者硫酸镍也可以与咪唑结合
,采用咪唑洗脱,咪唑竞争性结合到硫酸镍上,目的蛋白就被洗脱了,这时候收集穿出液,里面就是目的蛋白,然后透析掉咪唑即可。上样,清洗,洗脱,基本三个步骤就结束了。

a)可能原因:
超声的功率不对(太大,蛋白炭化,太小,蛋白没有释放)
解决方法:改变超声功率,并在超声前加入溶菌酶
b)可能原因:
样品或者是结合缓冲液不正确:
解决方法:检测pH 及样品和结合缓冲液的组成份。确保在溶液中鳌合剂或强还原剂的浓度及咪唑的浓度不是太高。
c)可能原因:
组氨酸标签暴露不完全
解决方法:在变性条件下( 用4-8 M 脲,或4-6 M 盐酸胍) 进行纯化。
d)可能原因:
His标签丢失
解决方法1:WB 检查His 是否表达,上游构建,改变His-tag 的位置(C-端或N-端),必要时增加His个数。
解决方法2:孵育的时间不够,降低流速和增加孵育的时间。
解决方法3:改变螯合的金属离子,寻找到最佳的结合金属离子。
Ni2+通常是从宿主细胞蛋白中纯化大多数6×His标记的重组蛋白质的首选金属离子。也是一般最常用的离子。蛋白和金属离子之间的结合强度受几种因素影响,包括长度、位置、亲和标记在蛋白的暴露程度、所用离子的类型、以及缓冲液的pH,因此一些蛋白用其他离子可能更容易地进行纯化而不用Ni2+。
a)可能原因:
洗脱条件太温和(组氨酸标记的蛋白质仍然结合在柱上,结合力较强)
解决方法:增加咪唑的梯度洗脱或降低pH 来找出最佳的洗脱条件。
b)可能原因:
降低pH 的方法洗脱的,若pH 低于3.5,会导致镍离子脱落
解决方法:改变洗脱办法,咪唑竞争性洗脱
c)可能原因:
蛋白已沉淀在柱上
解决方法:减少上样量,或使用咪唑的线性梯度而不是分步洗脱以降低蛋白的浓度。试用去污剂或改变NaCl 的浓度,或在变性条件( 去折叠)下洗脱( 用4-8 M 脲,或4-6 M 盐酸胍)。
d)可能原因:
非特异性疏水或其他相互反应
解决方法:加非离子去污剂到洗脱缓冲液(如:2% Triton X-100)或增加NaCl的浓度。
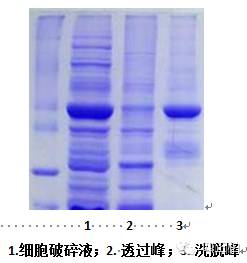
a)可能原因:
蛋白酶部分降解了标签蛋白
解决方法:添加蛋白酶抑制剂。
b)可能原因:
杂质对镍离子有更高的亲和性
解决方法1:咪唑浓度必须优化,以确保高纯度( 宿主细胞蛋白质的低结合) 和高产率( 组氨酸标记的目标蛋白质的强结合) 之间的最佳平衡。分步或者线性洗脱摸索出最优的咪唑结合和清洗浓度;在样品中加入与结合缓冲液同样浓度的咪唑;咪唑的梯度不大(20 个或更多的柱床体积),可能分离出有相似结合强度的蛋白
解决方法2:筛选最适合的缓冲液条件,NaCl 浓度,pH的范围都需要进行筛选。对于单一目标蛋白在进行缓冲液筛选时,将缓冲液、盐、甘油和还原剂设计成不同的混合配方来进行优化。
解决方法3:若以上优化的条件都不能去除杂质蛋白,需要考虑多步纯化的思路,如利用Strep 标签进行两步纯化或采用Subtractive method 进行纯化。
c)可能原因:
杂质和标签蛋白结合在一起
解决方法:在超声破碎细胞之前加入去垢剂或者还原剂;增加去垢剂的浓度( 2% Triton X-100 or 2% Tween 20);或者在Wash buffer 中增加甘油的浓度(50%) 减少非特异性的相互反应;考虑增加咪唑的浓度或者改变金属离子。
d)可能原因:
洗涤不充分
解决方法:增加洗涤的次数,使洗涤充分。
4. 使用几次后Ni柱载量下降,挂柱效率低,如何处理?
可能原因:逐渐积累沉淀,变性或非特异结合的蛋白占据了有效的结合位点,而通过洗脱液无法彻底清洗所致。
较温和的清洗方法:
用2倍柱体积的6M盐酸胍或8M尿素洗涤,然后用5倍体积的缓冲液洗涤,以去除沉淀或变性物质。用2倍柱体积的1% Triton X-100洗涤,然后用5倍柱体积的缓冲液洗涤,以去除疏水结合的物质。若改变不明显,可选择强烈清洗方式。
强烈清洗方式:
首先用5-10倍柱体积的脱镍缓冲液(20 mM 磷酸钠, 0.5 M NaCl, 50 mM EDTA, pH 7.4)洗涤,迚行脱镍操作,然后用5-10倍柱体积的平衡缓冲液冲洗,最后用5-10倍柱体积的双蒸水冲洗;随后进行清洗操作,去除离子型杂蛋白,可以用5倍柱体积的1.5 M NaCl溶液,然后10倍柱体积的双蒸水冲洗;去除沉淀或变性蛋白,可以用1M氢氧化钠溶液,结合1-2小时,然后用10倍柱体积的平衡缓冲液和10倍柱体积的双蒸水迚行冲洗;去除疏水蛋白或者脂蛋白,可以用5-10倍柱体积的30%异丙醇溶液清洗,然后10倍柱体积的双蒸水洗涤;最后进行生镍操作,用0.1M硫酸镍上柱,随后5倍柱体积的双蒸水和平衡缓冲液迚行洗涤,如需保存,保存在20%乙醇溶液。

















