过去几十年,双特异性抗体(BsAbs)已被迅速开发用于血液系统恶性肿瘤的治疗。目前,BsAbs的生产技术有100多种,双特异性T细胞衔接器(BiTE)就是其中一种。基于BiTE技术生产的BsAbs可同时靶向CD3和肿瘤特异性抗原并促进T细胞的细胞毒性。自首个BiTE技术生产的BsAb贝林妥欧单抗(Blinatumomab)获得美国食品药品监督管理局(FDA)批准以来,用于血液系统恶性肿瘤治疗的BsAbs研究进展迅速。
尽管已证明BsAbs在许多复发或难治性血液系统恶性肿瘤中有效,但仍有一部分血液系统恶性肿瘤对BsAbs无反应。为提高BsAbs的疗效,开发新的BsAbs成为专家研究热潮。近日,王欣教授团队发表的一篇综述讨论了BsAbs(表1)在血液系统恶性肿瘤治疗中的研究现状。医脉通将主要内容整理如下,供广大读者参考。
表1 用于治疗血液系统恶性肿瘤的双特异性抗体
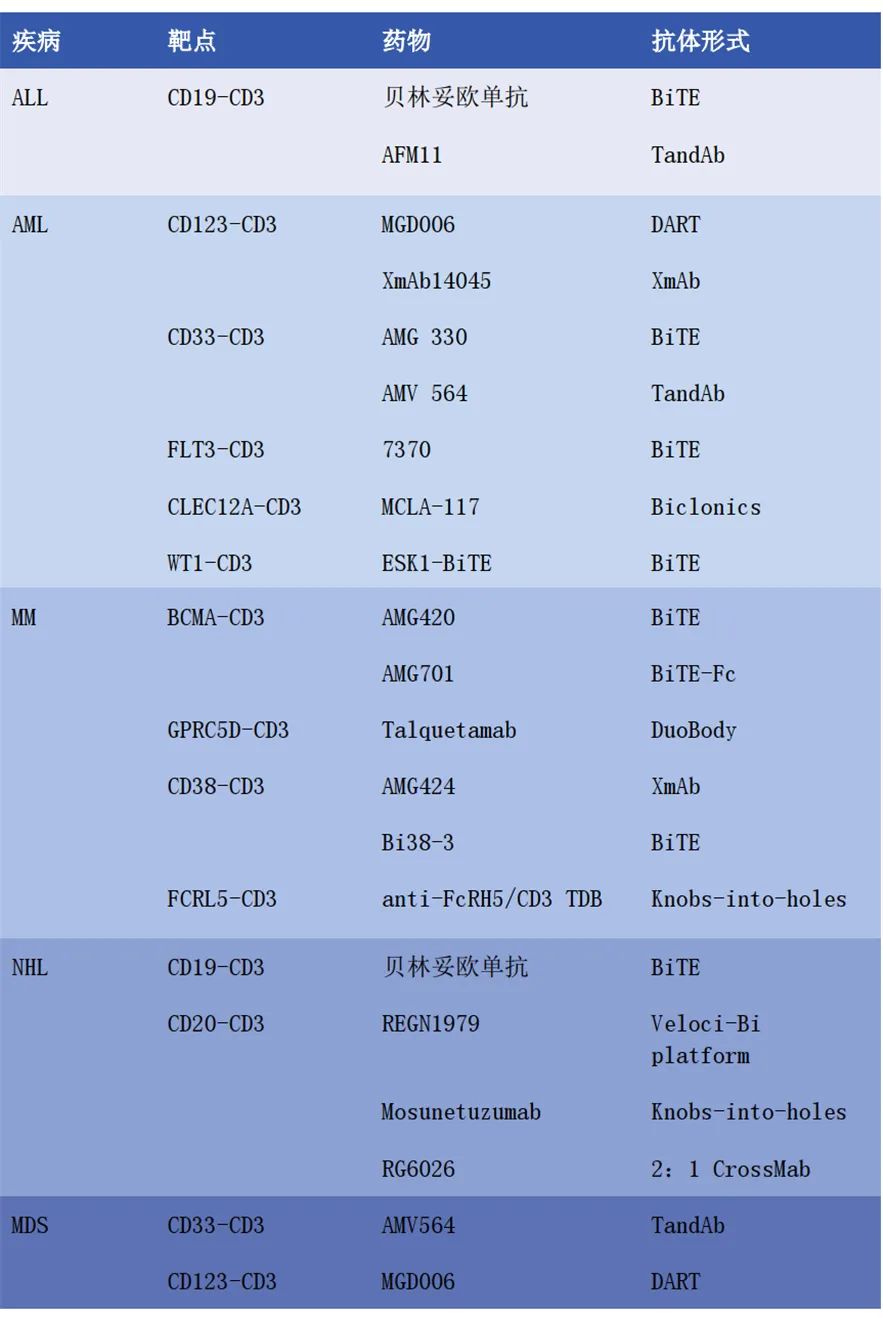
即使经历高强度挽救化疗和造血干细胞移植,复发或难治性(R/R)急性淋巴细胞白血病(ALL)患者的临床结果仍然很差。近年来开发的新靶向药物,如BsAbs,给ALL的治疗带来了希望。由于CD19在ALL细胞中过表达,靶向CD19和CD3的BsAbs,如贝林妥欧单抗和AFM11,成为近年来ALL研究的热点。
贝林妥欧单抗是靶向CD19和CD3的BsAb,目前已被FDA批准用于治疗R/R费城染色体阴性(Ph-)的B-ALL,R/R费城染色体阳性(Ph+)的B-ALL以及微小残留病(MRD)阳性B-ALL患者。研究也证明贝林妥欧单抗是治疗非霍奇金淋巴瘤(NHL)的有效药物。那贝林妥欧单抗的具体疗效如何?怎么给药呢?
(1)治疗R/R Ph- B-ALL
II期研究显示,R/R Ph- ALL患者,经过两个周期的贝林妥欧单抗治疗后,43%的患者实现了完全缓解(CR)或部分血液学改善的完全缓解(CRh)。在同种异体造血干细胞移植后复发的患者中,经两个周期的贝林妥欧单抗治疗后患者的CR/CRh率为45%。这些数据证实贝林妥欧单抗在侵袭性ALL中有显著疗效。此外,在异基因造血干细胞移植前给予贝林妥欧单抗可以提高CR率,这表明贝林妥欧单抗可能是衔接异基因造血干细胞移植的“桥梁”。
(2)治疗Ph+ ALL
自从以伊马替尼为代表的酪氨酸激酶抑制剂出现以来,Ph+ ALL患者的预后得到了极大的改善。但是,对伊马替尼耐药的R/R Ph+ ALL患者仍缺乏有效的治疗方法,而贝林妥欧单抗是解决该问题的可行方案。贝林妥欧单抗与化疗相比,可提高患者CR/CRh率,改善总生存期(OS)。一项II期研究中,伊马替尼不耐受或难治的Ph+ ALL患者,接受两个周期的贝林妥欧单抗单药治疗后,36%的患者达到了CR/CRh。
(3)治疗NHL
一系列评估贝林妥欧单抗对NHL疗效的临床试验显示:贝林妥欧单抗对R/R弥漫性大B细胞淋巴瘤(DLBCL)患者、R/R NHL患者都有效。一项关于R/R NHL患者的I期研究中,贝林妥欧单抗的最大耐受剂量(MTD)为60μg/m
2
/d,接受MTD治疗的患者,总缓解率(ORR)达69%。在另一项II期研究中,R/R DLBCL患者,每天接受112μg的贝林妥欧单抗,ORR和CR率分别为43%和19%。
贝林妥欧单抗的分子量低,半衰期短,通常通过连续静脉输注来维持治疗浓度。贝林妥欧单抗的最佳给药方案为:第一个周期的第一周,以9μg/d的剂量给药,然后在接下来的3周内剂量增加到28μg/d,之后休息2周。在接下来的周期,以28μg/d的剂量连续给药4周,休息2周。6周为一个治疗周期。
在一项针对R/R B-ALL患者的II期研究中,贝林妥欧单抗治疗期间常见的不良事件包括发热、疲劳、头痛、震颤和白细胞减少症。大多数不良事件发生在给药的第一个周期。在一项针对韩国成年Ph- R/R ALL患者的研究中,最常见的副作用包括感染、神经系统不良事件和细胞因子释放综合征(CRS)。另一项关于Ph+ ALL患者的试验中,最常见的3级及以上不良事件包括中性粒细胞减少症、血小板减少症和贫血。
晚期ALL患者的研究报道显示,贝林妥欧单抗组严重不良反应发生率低于化疗组。与CAR-T治疗相比,贝林妥欧单抗的CRS发生率较低。
中断贝林妥欧单抗治疗的主要原因是严重的CRS和神经系统不良事件。严重CRS可以通过预防性地塞米松分步给药预防。停用贝林妥欧单抗后,神经系统症状可控制,另外可以通过预先给予类固醇和密切的临床监测来预防严重的神经系统事件。
AFM11是基于四价双特异性抗体(TandAb)技术开发的,它的半衰期较长,对CD3和CD19的亲和力较优。体外实验证明,AFM11可以激活T细胞并促进慢性淋巴细胞白血病(CLL)和小淋巴细胞淋巴瘤中白血病细胞的凋亡。但是,它的细胞毒性较强于贝林妥欧单抗。一项I期试验评估了AFM11在R/R B-ALL患者中的疗效,然而,在一例神经系统不良事件导致的死亡后,AFM11的研究被中断。
急性髓系白血病(AML)是成人最常见的急性白血病,其发病率随年龄增长而增加。以阿糖胞苷和蒽环类药物为基础的治疗大约可治愈40%-45%的年轻患者和10%-20%的老年患者。但是,R/R AML患者的治愈率低于10%。免疫疗法彻底改变了AML治疗领域。当前,大量关于治疗AML的BsAbs的研究处于临床试验阶段。许多肿瘤表面抗原是BsAbs的潜在靶标,例如CD123、CD33、FLT3、CLEC12A和WT1。
CD123在许多血液系统恶性肿瘤中过表达,主要在CD34+/CD38- AML细胞中过表达,且CD123过表达意味着患者预后不良。目前关于几种CD123/CD3 BsAbs(如MGD006、XmAb14045和JNJ-63709178)治疗AML的临床试验均在进行中。其中关于MGD006和XmAb14045的临床试验的初步结果已发表。
MGD006是使用双亲和重靶向抗体(dual-afnity retargeting antibody ,DART)平台的CD123/CD3 BsAb。与BiTE技术生产的BsAbs相比,它的稳定性更好。且其在AML患者中的安全性和有效性已在I/II期临床试验中得到证明。
在II期研究中,诱导治疗失败/早期复发患者按500 ng/kg/d的剂量给药,CR/CRh率为26.7%,总有效率(CR/CRh/完全缓解伴血细胞计数未完全恢复[CRi])为30.0%。达到CR/CRh的患者的中位OS为10.2个月,6个月和12个月生存率分别为75%和50%。MGD006的半衰期很短,所以需要连续输注。像其他BsAbs一样,MGD006最常见的不良反应是CRS。该试验还在进行中,主要针对诱导治疗失败/早期复发的AML患者。
XmAb14045是通过XmAb技术生产的CD123/CD3 BsAb,其半衰期延长,可间歇使用。已有I期临床试验对XmAb14045进行了研究。在研究的A部分,64名R/R AML患者中有23%通过XmAb14045单药治疗获得CR。接受XmAb1404治疗的R/R AML患者中有77%存在CRS。该临床试验的B部分正在研究最佳给药方案。

















