15日,江苏恒瑞医药股份有限公司发布公告,公司旗下贝伐珠单抗注射液的Ⅲ期临床试验即将开展,至此恒瑞顺利跻身国内贝伐珠单抗生物类似物开发的Ⅲ期临床队列。
目前,国内的制药企业中均无同类产品获批上市。据不完全统计,截至发文日期手握贝伐珠单抗生物类似物临床试验批文的国内制药企业数量超过了20家,其中在研产品已经处于Ⅲ期临床试验阶段的国内制药企业有7家,见下表。

请点击放大
除了嘉和生物药业的Ⅲ期临床试验处于"进行中 (尚未招募)"阶段之外,其他6家的临床试验均处于"进行中(招募中)"的阶段。
-
与标准化疗联合治疗转移性结直肠癌、非小细胞肺癌、恶性经胶质瘤、宫颈癌、复发性卵巢、输卵管或原发性腹膜癌等。
国内外销售情况
贝伐珠单抗为全球首个抗血管生成药物,2004年初通过FDA批准,已经在120多个国家获批用于治疗癌症。2015年全球业绩为70亿美元。2016年H1为36亿美元。汤森路透预计在2021年业绩将下滑到56亿美元。
(
原因推测:
由于生物类似药的研发上市,导致原研药的市场份额被挤占;另外,近年肿瘤免疫疗法迅速发展对于市场冲击也有一定影响
)。
IMS数据显示2014年贝伐珠单抗在中国(不包括港澳台地区)销售额约4.5亿人民币,2015年销售额约5.17亿人民币。
以
Biosimilar
申报策略进行临床试验的要求
 PK,PD,PK/PD,Efficacy有效性,Safety安全性,Immunogenicity免疫原性
PK,PD,PK/PD,Efficacy有效性,Safety安全性,Immunogenicity免疫原性
备注
:
对于生物类似药的临床研究设计是为了证明其临床疗效与原研药的可比性即
相似性
,而不是安全有效性
。
借鉴
Bevacizumab
原研药的临床信息
 参考在中国上市的安维汀说明书内容:
参考在中国上市的安维汀说明书内容:
-
BP20698是一项在患有晚期恶性肿瘤的中国患者上进行的关于贝伐珠单抗安全性及药代动力学特征的I期研究。对贝伐珠单抗的三个剂量水平(5mg/kg, 10mg/kg和15mg/kg)进行评价。比较西方受试者(AVF0737g)与中国受试者(BP20689)间PK结果
,
在5-15mg/kg范围内,贝伐珠单抗为线性药代动力学。
-
贝伐珠单抗多次用药的药代动力学参数与单次用药的相似
。多次用药与单次用药的清除率、中央分布容积、稳态分布容积的参数均值比,5mg/kg分别为0.85, 1.01和1.21;10mg/kg分别为0.97, 1.01和1.02;15mg/kg分别为1.01,1.01和1.01。
-
中国受试者在5mg/kg和10mg/kg贝伐单抗多次给药后,血清贝伐珠单抗的PK参数与在美国进行的3mg/kg和10mg/kg的I期研究(AVF0737g)所获得的
PK参数接近
。
-
根据该药代动力学研究结果和国外临床试验结果的比较,
未发现贝伐珠单抗存在种族差异。
-
对群体药代动力学进行了分析以对人口学特征的影响进行评价。
结果显示,贝伐珠单抗的药代动力学在不同年龄之间没有显著差异。
Bevacizumab
在中国以
Biosimilar
申报策略进行临床试验的设计建议
 PK试验设计建议:
PK试验设计建议:
-
由于半衰期较长,建议平行对照设计:T
1/2
:20 days (11-50days)。
-
目标人群:由于患者的肿瘤负荷很大程度
影响消除,
因此在确保产品安全性的前提下,建议选择健康人群。
-
Dosage:<5mg/kg,保证健康人群的安全性;用药途经:IV 。
-
半衰期20天
,而由于每周用药的累积效应,会抹平或者放大试验用药与对照药之间的差异,因此建议单次用药。
-
主要终点指标:建议AUC。Cmax等可作为次要终点指标。
-
等效性范围:80-125%。
备注
:PK试验设计需要权衡药代动力学实验方法的敏感性、可靠性,以及在人群中的使用情况、安全性等。
临床比对试验设计建议
 临床适应症及治疗方案
临床适应症及治疗方案
国内获批适应症:2010年4月,结直肠癌适应症,Avastin联合以5-氟尿嘧啶为基础的化疗适用于转移性结直肠癌患者的治疗。2015年7月,肺癌适应症,Avastin联合卡铂与紫杉醇用于不可切除的晚期、转移性或复发性非鳞状细胞非小细胞肺癌患者的一线治疗。
关于转移性结直肠癌(mCRC):其等效性试验所需样本量非常大,因此对于该适应症很难进行等效性试验。国内临床适应症一般选择晚期、转移性或复发性非小细胞肺癌(NSCLC),其治疗方案为:贝伐珠单抗与卡铂和紫杉醇联合用药最多6个周期,随后给予贝伐珠单抗治疗,直至疾病进展或出现不可耐受的毒性。贝伐珠单抗的推荐剂量为15mg/kg体重,每3周给药一次(15mg/kg/q3w)。
 参数的选择
参数的选择
-
从统计学性质上看,相比RR和OR,RD更容易受概率事件的变异性影响。
-
RR是更有效的指标,但依赖于研究结果。
-
RD是说明结果的最直接参数。
-
主要终点指标:ORR(ORR指标所需事件最短)。
-
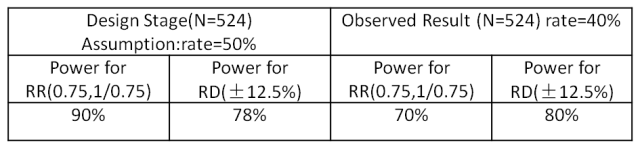
RR及RD的比较:假设Pc=50%,则RR margin=(0.75, 1/0.75),预估RD margin(-12.5%, 15.7%);假设观察到的Pc=40%,则RR margin=(0.75, 1/0.75),实际RD margin(-10%, 13.3%),检验效能如下表:
xamples in china
目前国内正在
进行的
Bevacizumab
临床试验情况
北京天广实生物技术股份有限公司/中国人民解放军军事医学科学院基础医学研究所
2015年12月,北京天广实生物技术股份有限公司(重组抗人血管内皮生长因子人源化单克隆抗体注射液)获得CFDA转移性结直肠癌、及晚期、转移性或复发性费小细胞肺癌的临床试验批件。目标入组人数为国内试验:78(根据中期盲态分析,如CV>25%时,将会入组提到146例)人,第一例受试者于2016年11月08日入组,正在招募患者中。
试验详情:
正在国内开展随机、双盲、单剂量、平行比较MIL60(重组抗人血管内皮生长因子人源化单克隆抗体注射液)与Avastin在健康男性志愿者中药代动力学和安全性的相似性的I期临床研究。主要目的:评价MIL60(重组抗人血管内皮生长因子人源化单克隆抗体注射液)与Avastin在健康男性志愿者单次静脉给药的药代动力学(PK)相似性。次要目的:评价MIL60与Avastin在健康男性志愿者单次静脉给药的药代动力学特征、安全性、耐受性和免疫原性。试验组为MIL60,静脉输注,单次给药,每次3mg/kg;对照组为贝伐珠单抗注射液(Avastin),静脉输注,单次给药,每次3mg/kg。主要终点指标:自给药起71天,AUC
0-t
。
2016年2月,东曜药业TAB008单抗注射液获得CFDA的临床试验批件。目标入组人数为国内试验100人。目前尚未招募患者。
试验详情:
正在开展TAB008单抗注射液和安维汀注射液对于中国健康男性受试者单次给药的随机、双盲、平行对照的PK和安全性的I期研究。主要试验目的:评价单次给药后TAB008单抗注射液和安维汀注射液的主要PK参数、Cmax、AUC
0-t
和AUC
0-∞
的生物相似性;次要试验目的:评价单次给药后TAB008单抗注射液和安维汀注射液的其他PK参数、安全性和免疫原性的生物相似性。试验组为贝伐珠单抗注射液,静脉注射(IV),单次给药,在第一天给药,每次1mg/kg;对照组为安维汀, Avastin,静脉注射(IV),单次给药,在第一天给药,每次1mg/kg。主要终点指标:给药后至试验结束,单次给药血TAB008单抗或安维汀的Cmax、AUC
0-t
和AUC
0-∞
。
2015年10月, 齐鲁制药有限公司的重组抗VEGF人源化单克隆抗体注射液获得CFDA转移性结直肠癌的临床试验批件。该项目正在招募患者,目标入组84人,第一例受试者于2016年03月21日入组。
试验详情:
正在国内开展随机双盲单次给药平行两组重组抗VEGF人源化单克隆抗体与安维汀健康志愿者中药代动力学和安全性比对研究。主要目的:评价健康志愿者单次静脉注射重组抗VEGF人源化单克隆抗体注射液和安维汀的药代动力学的相似性;次要目的:评价健康志愿者单次静脉注射重组抗VEGF人源化单克隆抗体注射液和安维汀的临床安全性、免疫原性的相似性。试验药是重组抗VEGF人源化单克隆抗体注射液,静脉滴注,每天一次,每次3mg/kg ;用药时程:给药1次。对照药是贝伐珠单抗注射液,静脉滴注,每天一次,每次3mg/kg;用药时程:给药1次。主要终点指标为给药后至第85天的药动学评价指标:AUC
0-inf
; AUC
0-t
;Cmax;Tmax;T1/2;Vz:CL。
2016年5月,信达生物制药(苏州)有限公司的IBI305(重组抗VEGF人源化单克隆抗体注射液)获得CFDA晚期或复发性非鳞状细胞非小细胞肺癌的临床试验批件。IBI305的这项III期随机、双盲研究8月9日获得中山大学肿瘤防治中心伦理委员会审查通过,计划在30家国内机构招募436例晚期或复发性非鳞状NSCLC患者。目前的状态是“进行中,尚未招募”。
试验详情:
在国内开展随机双盲平行分组的,在非小细胞肺癌受试者中比较IBI305联合紫杉醇/卡铂与贝伐珠单抗联合紫杉醇/卡铂有效性和安全性的III期研究。主要目的:比较IBI305联合紫杉醇/卡铂相对于贝伐珠单抗联合紫杉醇/卡铂用于晚期或复发性非鳞状细胞NSCLC的ORR。次要目的:1.比较IBI305联合紫杉醇/卡铂相对于贝伐珠单抗联合紫杉醇/卡铂用于晚期或复发性非鳞状细胞NSCLC治疗的DOR、PFS、DCR和OS及安全性和免疫原性
探索性目的:1)比较IBI305和贝伐珠单抗在晚期或复发性非鳞状细胞NSCLC受试者中的PK特征及PD特征。试验药:IBI305,静脉滴注,每3周一个治疗周期,每周期第一天给药,与化疗药联合(最多6个周期)时15mg/Kg,单药维持时7.5mg/kg,直至PD、无法接受的毒性反应、撤回知情同意、研究结束、失访或死亡,以先发生者为准。对照药:贝伐珠单抗(安维汀Avastin),静脉滴注,每3周一个治疗周期,每周期第一天给药,与化疗药联合(最多6个周期)时15mg/kg,单药维持时7.5mg/kg,直至PD、无法接受的毒性反应、撤回知情同意、研究结束、失访或死亡,以先发生者为准。主要终点指标:本研究主要疗效终点评估的截止日期为受试者随机化后6个月的客观缓解率(ORR)(根据RECIST v1.1标准评价ORR,其定义为肿瘤体积缩小达到预先规定值并能维持最低时限要求的受试者比例,包含完全缓解(CR)和部分缓解(PR)的病例。)










