
11 月 29 日,罗氏宣布,与 FDA 协商后撤回了 PD-L1 抗体阿替利珠单抗(Tecentriq )
一线治疗晚期或转移性尿路上皮癌的适应症
。
罗氏表示,这一决定不会影响
Tecentriq 在美国的其他适应症。
尿路上皮癌:
Tecentriq 全线撤回、
Keytruda 正式批准
此前,罗氏已在去年 3 月撤回了
Tecentriq 用于尿路上皮癌的二线治疗
。至此,罗氏已全线撤回了
Tecentriq 在
尿路上皮癌领域的应用。
两次撤回的原因一致,都是因为阿替利珠单抗
未能通过 FDA 的验证性临床研究。
2016 年 5 月,Tecentriq 基于 II 期临床 IMvigor210 的积极结果获 FDA 加速批准上市,用于铂类药物化疗后疾病进展或术前/术后接受铂类药物化疗 12 个月内疾病恶化的局部晚期或转移性尿路上皮癌。并于 2017 年 4 月,获批扩展适应症用于无法进行常规顺铂化疗的局部晚期或转移性尿路上皮癌的一线治疗。
然而,两项验证性试验
IMvigor 211、
IMvigor130 III 期研究中均宣告
失败。
在 I
Mvigor211 研究中未能达到 OS 终点:
PD-L1 组与化疗组的中位 OS 为 11.1 个月 vs 10.6 个月(HR=0.87,P=0.41),无显著差异。
而在
IMvigor130 研究结果则
限制了 Tecentriq 的适用人群为 PD-L1 表达阳性患者。
值得一提的是,针对此次撤回的适应症,在去年 FDA 召集的肿瘤药物咨询专家委员会上曾获得 10: 1 的赞成票,同意留市。
对于此次罗氏自主撤回,具体愿意暂未可知。
针对同一适应症,
此前同样深陷撤回风波的 K 药已于去年「转正」。
去年 8月,
默沙东宣布,FDA 已将帕博利珠单抗(Keytruda)一线治疗晚期尿路上皮癌(mUC)的
加速批准转为正式批准
。不过,FDA 修订了该标签,
用于治疗含铂化疗不耐受的局部晚期或转移性尿路上皮癌患者。
2017 年 5 月,Keytruda 获 FDA 加速批准一线治疗不适合接受含顺铂化疗的PD-L1阳性局部晚期或转移性尿路上皮癌患者,或不适合接受任何含铂化疗(无论PD-L1状态如何)的患者。
遗憾的是,后续的确证性 3 期临床
KEYNOTE-361(登记号:
NCT02853305
)
未能达到总生存期(OS)和无进展生存期(PFS)的双重主要终点。
KEYNOTE-361 试验结果

来自:Insight 数据库网页版 (http://db.dxy.cn/v5/home/)
不过,在去年 4 月份的投票表决中,咨询委员会仍然以 5 : 3 给与了支持,同年 8 月,FDA 也作出积极回应,将加速批准转变为了完全批准。
从修订适应症的行为来看,小编
大胆猜测,此次能转为正式批准的原因之一,或许是因为 3 期确证性临床的具体结果,让 FDA 看到了 K 药可一定程度上满足当前某些新确诊且不适合接受含铂化疗的晚期尿路上皮癌
患者的需求。当然,同领域治疗手段的缺乏想必也是原因之一。
PD-(L)1 肿瘤免疫疗法
BMS、默沙东、百济、君实…争夺市场
尿路上皮癌(UC)是起源于尿路上皮的一种多源性恶性肿瘤,包括肾盂癌、输尿管癌、膀胱癌以及尿道癌。
据弗若斯特沙利文数据显示,2020 年
全球新增尿路上皮癌病例
约为 51.6 万例,预计
2025 年将达到约 58.6 万例
,2020-2025 年复合年增长率为 2.6%;而在中国,预计于 2025 年将达到约 9.1 万例,2020-2025 年复合年增长率为 3.4%。
从药物市场规模来看,根据弗若斯特沙利文数据显示,预计 2025 年全球尿路上皮癌治疗药物的市场规模将增至 69 亿美元
,2020-2025 年复合年增长率为 21.2%;在中国,预计 2025 年将增至 9.0 亿美元,2020-2025 年复合年增长率为 39.7%。
相对于乳腺癌、非小细胞肺癌等大适应症,目前尿路上皮细胞癌的市场竞争比较缓和。
针对尿路上皮癌适应症,据 Insight 数据库显示,包括 Tecentriq 在内,此前全球共有 7 款 PD-(L)1 肿瘤免疫疗法获批上市,
不过阿斯利康在去年 2 月自主撤回了 Imfinzi 在美国二线用药的适应症。
由此在该领域少了两个玩家,当前还有 5 位玩家争夺该市场。其中,百济替雷利珠单抗和君实特瑞普利单抗目前仅在国内获批上市。
7 款 PD-(L)1 肿瘤免疫疗法
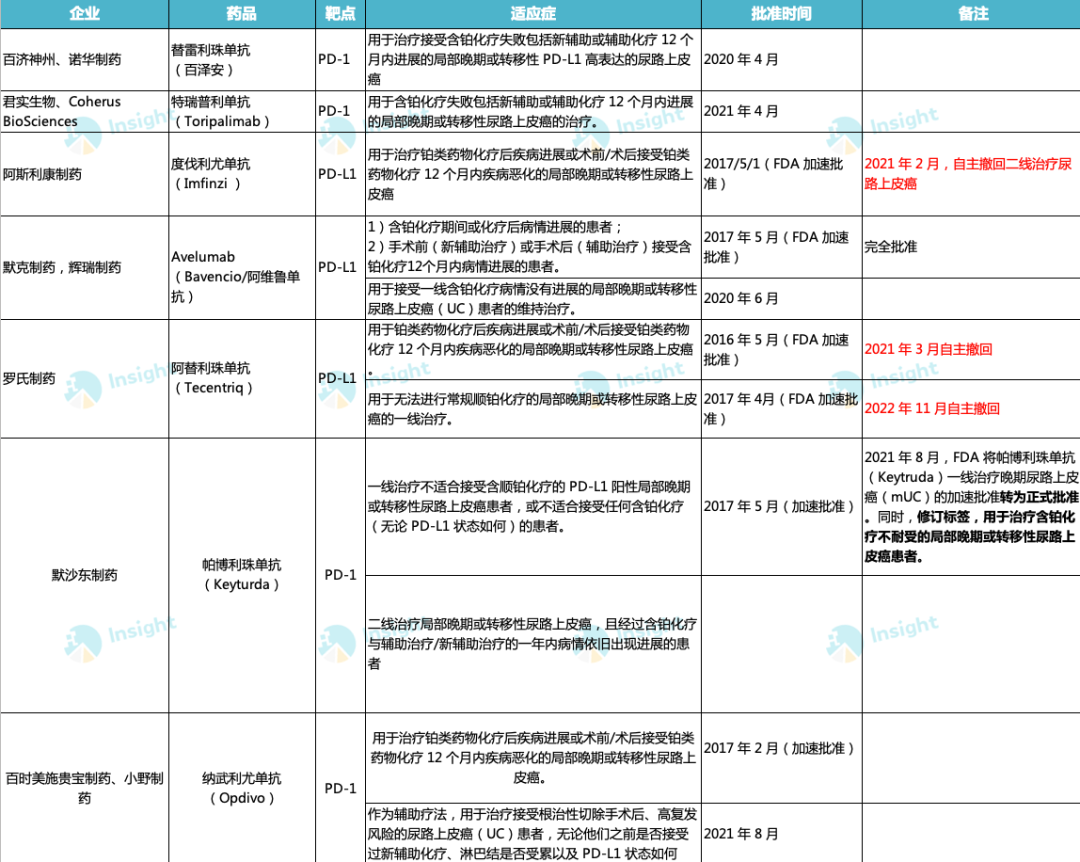
来自:Insight 人工整理(不完全统计;如有纰漏请指正)
其他几位玩家,也有各自的一些差异化。如,Bavencio 为 FDA 批准的首个在一线维持治疗 UC III 期临床试验中被证实具有显著总生存期(OS)益处的免疫疗法。III 期 JAVELIN Bladder 100 研究结果显示,与标准护理相比,Bavencio联合标准护理一线维持治疗将中位 OS 延长了 50%(21.4 个月 vs 14.3 个月)。此外,纳武单抗在二线治疗外,还获批了辅助疗法。
探索之路:
ADC、「靶向+免疫」联合疗法
在肿瘤免疫疗法之外,也有玩家开始探索其他方向,比如,当前已获得一定成果的
靶向治疗领域
。
2019 年 FDA 加速批准了厄达替尼用于存在 FGFR3 或 FGFR2 易感型基因改变的局部进展或转移的晚期尿路上皮癌,由此开启了尿路上皮癌靶向治疗时代。
据此前披露的 BLC2001 Ⅱ 期研究数据显示,使用 8 mg/日的厄达替尼治疗存在 FGFR 基因改变的晚期尿路上皮癌患者的疗效显著:中位疗效随访 24.0 个月,研究者评估的 ORR 为 40%(95% CI : 30-49),mPFS 为 5.5个月,mOS 为11.3 个月,12 个月生存率为 49%,24 个月的则为31%。相关数据结果已于今年 2 月在 Lancet Oncol. 期刊上发表。
说到靶向治疗
,不得不提首款获批上市用于尿路上皮癌的
HER2 ADC 维迪西妥单抗/RC48
。
在今年的 ASCO 会议中,荣昌生物公布的 RC48 用于尿路上皮癌患者的临床数据表明,
RC48 显示出优异的疗效,且安全性可控。
在 HER2 阴性(HER2 IHC1+或0)局部晚期或转移性尿路上皮癌患者中,
RC48 总体的中位 OS 为 16.4 个月,ORR 为26.3%。
NCT04073602 试验结果

来自:Insight 数据库网页版















