正文
BioArt按
:
Wnt/β-catenin信号通路的异常活化是人类结直肠癌发生的重要原因之一。β-catenin的核内累积是Wnt信号通路活化的重要标志。尽管β-catenin的入核与出核过程已被广泛研究,但关于β-catenin的核内滞留机制目前仍知之甚少。8月22日,来自浙江大学医学院的
周天华
研究小组在
Cell Research
杂志发表了题为“Twa1/Gid8 is a β-catenin nuclear retention factor in Wnt signaling and colorectal tumorigenesis”的研究论文。
该研究通过整合生物信息学、分子细胞生物学、发育生物学、癌生物学和临床调查等手段系统地鉴定了一个经典Wnt信号通路的新成员Twa1,并证实Twa1通过促进β-catenin的核内滞留而提高β-catenin的核内水平,进而增强Wnt信号通路,在斑马鱼胚胎早期发育及结直肠癌的发生和发展过程中发挥重要功能。该研究表明Twa1是近二十年来Wnt信号通路研究中新发现的重要成员,为人们进一步认识Wnt信号通路及其分子调控机理提供了新思路,有助于深入了解与Wnt信号通路异常相关的人类疾病的发生机理
。

论文解读
:
经典Wnt信号通路(又称Wnt/β-catenin信号通路)是一类由分泌型糖蛋白Wnt介导的信号转导途径,在动物胚胎早期发育中参与调节细胞增殖与分化、背腹体轴建立、组织和器官形成等一系列生理过程,其功能异常与发育缺陷及恶性肿瘤等人类疾病密切相关【1,2】。Wnt信号通路的主要成员
APC
(adenomatous polyposis coli)基因的突变被认为是结直肠癌产生的重要原因【3】。因此,
深入研究经典Wnt信号通路的分子调控机理,对人类结直肠癌的诊治具有重要的理论意义和潜在的临床应用价值。
经典Wnt信号通路主要是细胞外Wnt配体与细胞膜上的受体结合,提高细胞质内β-catenin蛋白的稳定性,促进其移位至细胞核,激活下游靶基因的表达(
下图1
)【1,2】。当细胞没有接收Wnt信号时,细胞质中的β-catenin被Axin介导的降解复合物(主要由支架蛋白Axin和APC,蛋白激酶GSK3和CK1等组成)捕获,并经蛋白酶体途径降解。因此,β-catenin无法进入细胞核激活Wnt靶基因的表达。当细胞外存在较高浓度的Wnt配体时,Wnt结合细胞膜上的受体Frizzled和共受体LRP5/6(low-density lipoprotein receptor-related protein 5/6),在Dvl(dishevelled)的帮助下招募Axin移位至细胞膜,使得Axin复合物失活。因此,β-catenin不再受到Axin复合物的调控,其在细胞质中的蛋白浓度升高,并进入细胞核,结合转录因子TCF(T cell factor),激活下游Wnt靶基因的表达。由此可见,
β-catenin在细胞核内的累积(nuclear accumulation)是Wnt信号通路的关键事件之一
。
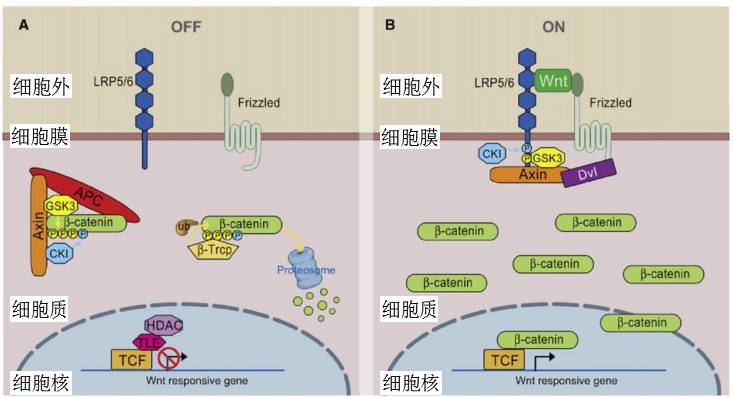
图1,经典Wnt信号通路示意图(根据参考文献[2]做适当修改)
近来研究发现,FoxM1(forkhead box protein M1)、mucin-1、IRS-1(insulin receptor substrate-1)、BCL9(B-cell lymphoma 9)等蛋白能够与β-catenin结合并促进其入核,而RanBP3(Ran binding protein 3)、Chibby、APC、Axin等蛋白可与β-catenin作用而促进其出核【4】。这些研究表明,
β-catenin在细胞核内的累积受到其蛋白稳定性、入核、出核等多个层面的调控
。
然而,是否存在核内滞留(nuclear retention)这一机制参与调控Wnt信号诱导的β-catenin核内累积,Wnt信号又是如何促进β-catenin核内滞留而提高β-catenin的核内水平,这些问题目前并不清楚。
在周天华课题组的这项研究中,研究人员发现
Twa1
(two hybrid-associated protein no.1 with RanBPM,亦命名为
Gid8
)是一个β-catenin的核内滞留因子,通过促进β-catenin的核内滞留而提高β-catenin的核内水平,进而促进Wnt信号通路和结直肠癌的发生和发展。Twa1是一个进化上高度保守的蛋白,早期研究发现其能够与RanBPM(Ran-binding protein M)蛋白相互作用,但Twa1蛋白的生化特性及其生物学功能并不清楚【5,6】。
为了研究结直肠癌发生和发展的分子机制,研究人员在癌症公共数据库
Oncomine
和
TCGA
中,通过生物信息学方法分析在结直肠癌组织和癌旁对照组织中差异表达的基因,发现其中一个功能未知的基因Twa1在结直肠癌组织中高表达(
另外找到的几个基因例如
FoxQ1、c-Myc、DNMT1、LGR5
等大都是功能明确,并且已有许多相关研究报道
)。于是研究人员收集临床组织样本,证实Twa1的确在结直肠癌组织中表达上升,提示Twa1可能与结直肠癌的发生和发展相关。
考虑到细胞信号通路异常与癌症的发生发展密切相关,研究人员又通过一系列监测细胞信号通路活性的报告基因实验进行筛选,发现
Twa1是Wnt信号通路的正向调节因子
。进一步机制研究表明在Wnt信号未激活时,Twa1与β-catenin一同被Axin复合物降解。当Wnt信号激活时,Wnt信号能够抑制Axin复合物,促进Twa1的核内累积,Twa1结合β-catenin并将β-catenin滞留于核内,从而提高β-catenin的核内水平,增强Wnt靶基因的表达(
下图2
)。
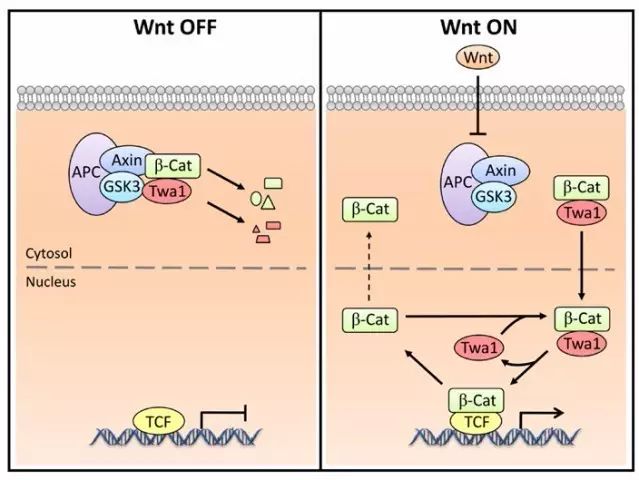
图2,Twa1通过促进β-catenin核内滞留而增强Wnt信号通路
此外,Twa1对于与Wnt通路相关的斑马鱼背部结构发育以及结直肠癌细胞的生长都是至关重要的。更重要的是,Twa1在人类结直肠癌组织的细胞核组分中高表达,并与β-catenin的表达水平以及结直肠癌患者的不良预后呈正相关,这提示Twa1可能是一个潜在的结直肠癌的治疗靶标。尽管Twa1与β-catenin在核内结合,但Twa1并不与TCF4及Wnt靶基因结合,这提示
一种染色体非依赖性的核内滞留(chromatin-independent retention)机制对于β-catenin的核内累积以及Wnt信号通路的激活至关重要
。
综上所述,该研究发现Twa1是经典Wnt信号通路的一个新成员,通过促进β-catenin核内滞留而增强Wnt信号通路,进而在斑马鱼胚胎发育及结直肠癌的发生和发展中发挥重要作用,为人们进一步认识Wnt信号通路及其分子调控机理提供了新思路,有助于深入了解与Wnt信号通路异常相关的人类疾病的发生机理。
据悉,此项工作主要是由周天华教授课题组博士后
卢毅
、博士生
谢珊珊
、助理研究员
张
雯
等合作完成。该研究项目得到了国家科技部、国家自然科学基金、教育部、浙江省自然科学基金等的资助,同时还受到了普林斯顿大学
康毅滨
教授,浙大医学院
刘伟
教授,
王福俤
教授,
吴希美
教授和浙大生科院
黄晓
副教授的帮助。
参考文献
1.
Clevers H, Nusse R. Wnt/β-catenin signaling and disease.
Cell
2012; 149:1192-1205.
2.
MacDonald BT, Tamai K, He X. Wnt/β-catenin signaling: components, mechanisms, and diseases.
Dev Cell
2009; 17:9-26.
3.
Anastas JN, Moon RT. WNT signalling pathways as therapeutic targets in cancer.
Nat Rev Cancer
2013; 13:11-26.
4.
Jamieson C, Sharma M, Henderson BR. Targeting the β-catenin nuclear transport pathway in cancer.
Semin Cancer Biol
2014; 27:20-29.
5.
Umeda M, Nishitani H, Nishimoto T. A novel nuclear protein, Twa1, and Muskelin comprise a complex with RanBPM.
Gene
2003; 303:47-54.
6.
Kobayashi N, Yang J, Ueda A et al. RanBPM, Muskelin, p48EMLP, p44CTLH, and the armadillo-repeat proteins ARMC8α and ARMC8β are components of the CTLH complex.
Gene
2007; 396:236-247.

周天华
,博士,浙江大学求是特聘教授、博士生导师,国家杰出青年科学基金获得者,国家“万人计划”科技创新领军人才,科技部“中青年科技创新领军人才”,教育部“新世纪优秀人才支持计划”获得者,浙江省“钱江人才计划”获得者,浙江省重点科技创新团队(胃肠疾病诊治新技术创新团队)首席科学家,浙江省151人才工程第一层次培养人员,教育部高等教育出版社“高等学校基础医学类精品资源共享课”《医学细胞生物学》共同主编,国家卫生与计划生育委员会规划教材《细胞生物学》(长学制临床医学专业)副主编。现任浙江大学研究生院学科建设处处长、学位办公室主任、医学院细胞生物学与遗传学系主任、分子医学研究中心主任、疾病模型与模拟交叉研究中心主任,
Cell Research
和
Journal of Experimental Clinical Cancer Research
等多个SCI国际刊物编委,中国细胞生物学学会青年工作委员会副主任委员、细胞结构与细胞行为分会副会长、中国细胞生物学学会理事等。曾任浙江大学实验动物中心主任、基础医学院副院长、医学院副院长、医学部副主任等职务。1993年、1996年在浙江大学医学院分别获医学学士学位和医学硕士学位,1999年毕业于中科院上海细胞生物学研究所(裴钢院士实验室)获理学博士学位。2000年赴美国哈佛大学分子细胞生物学系Ray Erikson教授(Lasker奖获得者、美国科学院院士)实验室进行博士后训练,于2005年回国任教于浙江大学医学院,其在肿瘤分子细胞生物学研究领域具有扎实的理论知识和较好的实践基础,已在多种国际著名学术期刊发表40多篇原始学术论文,其中作为通讯作者的文章包括
Developmental Cell、Cell Research
和
PNAS
等,平均影响因子超过8。其研究成果受到包括诺贝尔奖获得者在内的国际同行们的关注,已被引用了1600多次,国际权威杂志
Nature Reviews Molecular Cell Biology
曾经以新闻的方式报道过其工作,由世界知名生物医学科学家组成的独立同行评议服务机构Faculty of 1000,专门推荐其研究成果。曾获荣誉包括:浙江省科技进步一等奖、中华医学科技奖三等奖、浙江省医药卫生科技创新奖一等奖等各一项、美国专利一项、中国专利一项(排名均为前三),浙江省第六届青年教师教学技能比赛一等奖(浙江省青年教师大会特邀报告)、浙江大学青年教师教学技能比赛一等奖等。受到国家自然科学基金、973计划、863计划、教育部、浙江省自然科学基金和省卫生厅等项目的资助。培养的学生已在国外一流大学深造,其中包括英国牛津大学、德国马普学会、美国哈佛大学、普林斯顿大学、康奈尔大学、耶鲁大学等。主要研究领域为肿瘤分子细胞生物学,主攻方向为细胞运动和细胞周期的分子调控机理及其在胃肠癌发生发展中的作用。
近年来代表性论文:
1.
Lu Y,# Xie S,# Zhang W,# Zhang C, Gao C, Sun Q, Cai Y, Xu Z, Xiao M, Xu Y, Huang X, Wu X, Liu W, Wang F, Kang Y and Zhou T*. (2017). Twa1/Gid8 is a β-catenin nuclear retention factor in Wnt signaling and colorectal tumorigenesis.
Cell Research
(accepted).
2.















