

肝内胆汁瘀积(intrahepatic cholestasis)是指各种原因包括遗传性、感染性、药物性、酒精性、自身免疫性、妊娠性和手术后等引起的肝细胞和(或)毛细胆管内胆汁形成、分泌和(或)排泄异常,临床可表现为瘙痒、疲劳、尿色加深和黄疸等,早期常无症状,仅表现为血清碱性磷酸酶(alkaline phosphatase,ALP)和γ-谷氨酰转肽酶(gamma- glutamyl transferase,GGT)水平升高,若不及时干预,病情进展后可出现高胆红素血症,损伤肝脏细胞组织,并逐渐演变为肝硬化、肝功能衰竭甚至肝癌[1-2]。目前,对于胆汁瘀积的发病机制研究表明,胆汁生成障碍和胆汁流动障碍是胆汁瘀积的重要因素[3],这个过程受到一系列核受体、膜受体及其转录因子的调控,与分布在肝细胞膜上的胆汁酸转运蛋白密切相关[4]。
核受体(nuclear receptors,NRs)是一类配体依赖性转录因子超家族,通过内源性或外源性配体物质激活调控靶基因的转录,在机体生长发育、新陈代谢以及病理生理过程中发挥着重要的作用[5]。核受体对胆汁酸稳态的调控研究不仅阐明了越来越多的胆汁酸合成、代谢与转运方面的分子调控机制,同时也使得一些核受体成为有应用前景的胆汁瘀积治疗药物靶标,其中的代表性核受体就是法尼醇X受体(farnesoid X receptor,FXR)。
中药治疗胆汁瘀积历史悠久。此病属于中医“黄疸”的范畴,以身黄、目黄、小便黄为主症,尤以目睛黄染为特征。大多医家认为湿、热、瘀、毒为本病的病理因素,其病机演变多由湿热熏蒸,蕴结肝胆,瘀阻血络,脉道不通而致胆汁不循常道;或因热毒入侵,耗伤营血,熏灼肝胆,胆液渗溢于肌肤,发为黄疸[6]。中药可以通过多靶点、多途径作用,针对主要发病机制的同时,兼顾次要发病机制,相互协同,从而可以在肝内胆汁瘀积的治疗方面取得显著疗效。本文对基于调控FXR的中药治疗肝内胆汁瘀积的研究进展进行综述,以期为中药新药的开发提供参考。
1 胆汁酸的合成、转运和排泄
胆汁酸(bile acids)是胆汁的主要成分,是由胆固醇在肝脏中合成的一大类胆烷酸的总称,常以钠盐或钾盐的形式存在。胆汁酸参与调节体内的多个生物过程,包括刺激肝脏胆汁分泌和促进小肠吸收脂肪及脂溶性维生素,通过激活特异性受体和信号通路调节三酰甘油、胆固醇和葡萄糖的稳态平衡等[7-8]。胆汁酸的代谢主要包括胆汁酸的生物合成、跨膜转运和肠肝循环。
肝脏是合成胆汁酸的唯一器官,肝细胞以胆固醇为原料,通过复杂而有序的酶促反应,最终合成胆汁酸。合成途径包括胆固醇7α-羟化酶(cholesterol7α-hydroxylase,CYP7A1)介导的经典途径和甾醇27α羟化酶(sterol 27α-hydroxylase,CYP27A1)、甾醇12α羟化酶(sterol 12α-hydroxylase,CYP7B1)介导的替代途径。经典途径主要合成胆酸(cholic acid,CA)和鹅脱氧胆酸(chenodeoxycholic acid,CDCA)2种初级胆汁酸(primary bile acids),旁路途径主要合成CDCA。胆汁酸合成后,需经过胆小管侧胆盐外排泵(bile saltexport pump,BSEP)、基底侧多药耐药相关蛋白2(multidrug resistance- associatedprotein 2,MRP2)和多药耐药性蛋白3(multidrug resistance protein 3,MDR3)等泵入胆小管,随胆汁进入小肠[9-11]。其中BSEP主要运输单价胆汁酸,MRP2主要运输2价胆汁酸,MDR3主要运输胆汁酸与胆固醇的混合微胶粒。在小肠中,甘氨酸(glycine,G)或牛磺酸(taurine,T)结合的CA(G/T-CA)和CDCA(G/T-CDCA)被肠道菌群分解,在脱羟基酶的作用下脱掉1个7α-羟基形成二级胆酸(secondary bileacids),如脱氧胆酸(deoxycholicacid,DCA)、石胆酸(lithocholicacid,LCA)和酮基石胆酸(ketonelithocholic acid,KLCA)[12]。脂类和脂溶性维生素在回肠被吸收之后,大部分初级胆汁酸通过小肠刷状缘钠盐依赖的胆汁酸转运蛋白(apical sodium-dependent bile acid transporter,ASBT)从肠腔吸收至肠壁细胞[13]。在回肠细胞,胆汁酸可能结合于回肠胆汁酸结合蛋白(ileum bile acid binding protein,IBABP),然后从肠细胞底外侧部分通过有机溶质转运蛋白α/β(organicsolute transporter alpha and beta,OSTα/β)排泄入门静脉。在肝脏,肝细胞通过基底侧膜上的钠离子/牛磺胆酸共转运体(Na+-taurocholateco-transporter,NTCP)以钠依赖性方式或有机阴离子转运蛋白(organic aniontransporting protein,OATP)介导的非钠依赖性方式重新摄取肝血窦血浆中的胆汁酸,完成胆汁酸的肠肝循环[14]。肠肝循环中胆汁酸有95%被重吸收,5%随粪便排出丢失,丢失的胆汁酸再通过胆汁酸的合成得到补充。除了初级胆汁酸和次级胆汁酸外,三级胆汁酸(tertiary bile acids)包括磺基石胆酸(sulfonated lithocholic acid,SLCA)和熊脱氧胆酸(ursodeoxycholicacid,UDCA),是次级胆汁酸经过重新吸收后在肝脏及肠道的代谢产物。胆汁酸的代谢示意图见图1。
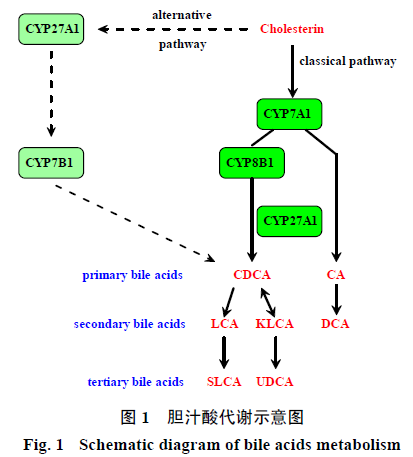
正常的胆汁流动取决于胆汁生成、分泌及排泄等过程中的所有结构、形态和功能的完整性,当这种完整性受到影响,即损害了其中的任何一个环节时都可能引起一系列继发反应导致胆汁生成和排泄的障碍,从而出现胆汁瘀积。
2 FXR在肝内胆汁瘀积治疗中的作用
FXR具有典型的核受体结构,由于能被超生理浓度的法尼醇激活,故以其命名。FXR广泛分布在肝、肾、小肠等富含胆汁酸的器官中,在心脏、脂
肪组织、血管以及胰岛β细胞中也发现了FXR的存在。FXR具有典型的核受体结构,包括氨基末端高度保守的结合区(DBD)、羧基末端配体结合区(LBD)、氨基末端的配体非依赖性转录激活功能区(AF-1)和羧基端1个配体依赖性激活功能区(AF-2)等。利用不同的启动子和mRNA选择性剪切,FXR编码产生4个FXRα亚型,即FXRα1、FXRα2、FXRα3和FXRα4[15]。FXR和配体结合后可以被激活或抑制,从而促进下游基因的高表达或抑制下游基因的表达。到目前为止,研究表明FXR是一个多功能的核受体,其在维持胆汁酸代谢[16]、脂质和糖稳态[17]上扮演了重要的角色。此外,FXR的一些新功能也被不断发现,包括肠道屏障保护作用、对先天性免疫的调节,以及在肿瘤发生中的调节作用等[18]。
FXR作为胆汁酸感受器,CDCA、LCA、DCA和CA都是FXR有效的内源性配体,其中以CDCA的激活作用最为明显。FXR通过调控一系列基因的表达,减少胆汁成分的摄入,减少肝脏中胆汁酸的合成,增加其亲水性代谢及转运外排,对胆汁酸的代谢进行调控,在维持胆汁酸稳态方面具有举足轻重的作用[19]。如图2所示,在胆汁酸的摄入、合成、外排、代谢与转运过程中,FXR具有多方面的作用。
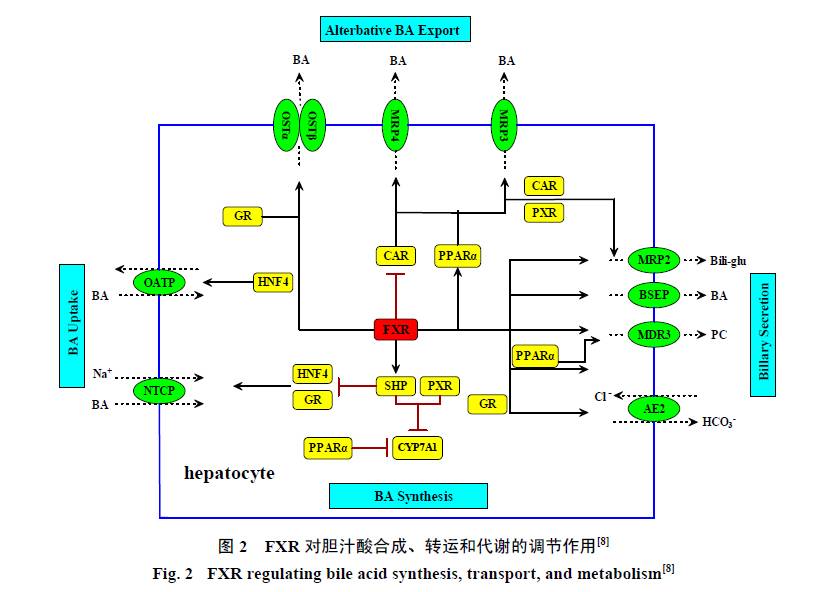
大量胆固醇转化为胆汁酸后,激活FXR,继而诱导小异源二聚体伴侣(smallheterodimer partner,SHP)的表达,负反馈调节胆汁酸合成限速酶CYP7A1的活性,抑制胆汁酸的进一步合成[20]。除SHP途径外,近年研究还发现FXR激活后可诱导人成纤维细胞生长因子19(fibroblast growth factor,FGF19)的表达,FGF19可激活肝FGF受体4(FGFR4),启动c-Jun氨基末端激酶(c-Jun N- terminal kinase,JNK)和细胞外调节蛋白激酶(extracellularregulated protein kinases,ERK)信号通路,导致CYP7A1基因表达下调,从而抑制胆汁酸的合成[21]。
激活FXR,能够上调BSEP和MRP2表达,下调NTCP表达,促进胆汁酸的外排,抑制胆汁酸的重吸收[22-23]。FXR还能通过上调MDR3的表达来增加胆小管侧的磷脂(phosphatidylcholine,PC)外排[24],促进IBABP的表达,影响胆汁酸在肠上皮细胞的转运[25],抑制肝细胞核因子4(hepatocyte nuclear factor 4,HNF4),减少OATP家族的表达,从而抑制胆汁酸的吸收[26]。FXR可以上调原发性胆汁性肝硬化患者和胆管结扎大鼠和小鼠OSTα/β的表达,此种作用可能是肝细胞胆汁瘀积时胆汁酸排出的一种代偿性反应[27]。胆汁酸具有潜在的毒性,解毒过程包括胆汁酸的氧化、硫酸盐化和糖苷化,其中关键酶如细胞色素P450 3A4(cytochrome P450 3A4,CYP3A4)、磺酸基转移酶2A1(sulfotransferase 2A1,SULT2A1)和葡萄糖醛酸转移酶2B4(UDP- glucuronyl transferases,UGT2B4)等都是FXR的靶基因,可以促进硫酸盐化和糖苷化的胆汁酸分泌进入胆汁[28]。
激活的FXR也可激活另一核受体,孕烷X受体(pregnane Xreceptor,PXR)的基因转录,PXR能诱导增强胆汁酸降解的基因,以保护肝脏免受高水平胆汁酸的损伤,同时FXR又能抑制组成型雄烷受体(constitutiveandrostane receptor,CAR)的表达,降低血浆中胆汁酸的量[29]。FXR被激活后,可以激活糖皮质激素受体(glucocorticoidreceptor,GR),GR能够进一步调控人胆汁酸转运体,如NTCP、OSTα/β的表达;GR被激活后,还能调控其他核受体的功能,如能上调PXR mRNA以及蛋白的表达;GR在调控转运体中的另一个重要效应是激活阴离子交换蛋白(anionexchanger 2,AE2)的表达,从而增加胆管上皮细胞碳酸氢盐(HCO3−)的分泌[30]。
炎症反应会抑制多种参与维持胆汁酸相关转运体基因表达的核转录调节因子的表达和活性,FXR能够诱导过氧化物酶体增殖物激活受体(peroxisome proliferator-activated receptor gamma,PPARγ)的表达,抑制肝星状细胞(hepatic stellate cell,HSC)的活化[31-32],抑制白细胞介素-6(interleukin-6,IL-6)、诱导型一氧化氮合成酶(inducible nitric oxide synthase,iNOS)、核转录因子-κB(nuclear factor-κB,NF-κB)、环氧化酶2(cyclooxygenase2,COX-2)等多种炎症因子的表达[33],减轻炎症反应,改善和恢复相关转运体的活性。肝纤维化是多种慢性肝病的共同病理过程,是肝脏损伤后自我修复的代偿性反应,多种致病因素如肝内胆汁瘀积等均可导致肝纤维化的发生。体内研究发现,激活FXR能明显降低肝纤维化标志基因α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)、转化生长因子β1(transforminggrowth factor β1,TGF-β1)的表达,同时减轻胆管结扎致大鼠肝纤维化的程度[34-35]。
综上所述,FXR的主要靶基因包括CYP3A4、SHP、NTCP、BSEP、MRP2、MDR3、ASBT、IBABP、SULT2A1、UGT2B4、UGT2B7、OATP1B3、OSTα/β等。通过调控上述关键酶和靶基因的表达,FXR参与胆汁酸的摄入、合成、外排、代谢与转运调节,是胆汁酸合成和转运的关键调节因子,其高表达对于维持胆汁酸的内环境稳态、降低胆汁酸对肝脏的毒性具有重要意义。因此,FXR很有希望成为治疗肝内胆汁瘀积性疾病的药物靶点[36]。
3 基于FXR的中药影响肝内胆汁瘀积的研究
3.1 基于FXR的中药治疗肝内胆汁瘀积的研究
由于肝内胆汁瘀积发病机制复杂,相关治疗药物的研究非常缓慢,UDCA和Ocaliva(obeticholic acid,奥贝胆酸)是目前FDA批准的仅有的2个用于治疗胆汁瘀积的药物。UDCA是FXR的配体,可下调CYP7A1的表达从而抑制胆酸内源性合成,上调BSEP和MRP的表达,减轻肝内胆酸负担,同时还兼具抗凋亡和抗纤维化的作用[37]。但由于UDCA与FXR的亲和力较低,在临床上有30%~50%的胆汁瘀积患者对UDCA治疗无应答反应。时隔近20年后,FDA于2016年5月27日批准了美国Intercept药业公司的Ocaliva用于治疗成人原发性胆汁性胆管炎(primary biliary cholangitis,PBC)。Ocaliva可与UDCA联合用药,适用于对UDCA反应不足的患者,如果患者对UDCA不耐受,也可以单独用药。II、III期临床试验的结果表明,作为新型FXR激动剂,Ocaliva通过激动FXR,调节相关基因,影响胆汁酸的合成、分泌、转运和吸收,对UDCA不能完全耐受的患者,通过服用Ocaliva能够明显改善ALP和血清胆红素的水平,Ocaliva可能会成为未来治疗PBC和非酒精性脂肪肝的首选药物[38-39]。
我国是中药资源大国,随着中医药越来越被世人所认可,国内外科学工作者对中药的研究亦显示了浓厚的兴趣。针对FXR这一治疗肝内胆汁瘀积性疾病最有前景的药物靶点,众多研究者采用α-萘异硫氰酸酯(alpha-naphthylisothiocyanate,ANIT)诱发或胆管结扎(bile-duct ligation,BDL)造成胆汁瘀积性肝损伤动物模型,利用现代分子生物学手段,研究用于肝内胆汁瘀积治疗的中药及其提取物或有效成分,阐明其作用机制和靶点,为中药治疗肝内胆汁瘀积提供科学依据,也为中药新药的研发提供新的思路和契机。
茵栀黄注射液和茵栀黄口服液源于汉代张仲景所著《伤寒论》中的茵陈蒿汤,由茵陈、栀子、金银花、黄芩4味中药组成,具有清热、解毒、利湿、退黄疸和降低转氨酶的作用,临床上广泛用于治疗胆汁瘀积[40-41]。吴海滨等[42-44]根据肝内胆汁瘀积湿热证的中西医理论,在长夏湿热季节将大鼠置放于湿热造模箱内,喂饲葡萄糖和猪油脂混合液,之后一次性ig ANIT造成急性药物性肝内胆汁瘀积动物模型。通过研究茵栀黄注射液对肝内胆汁瘀积湿热证大鼠血清生化指标、肝脏组织病理的变化,以及对FXR、BSEP、NTCP基因和蛋白表达的影响,明确了茵栀黄注射液通过干预FXR,上调BESP的表达来治疗肝内胆汁瘀积。张双金等[45-47]也研究发现茵栀黄水提物对ANIT或雌激素诱导的胆汁瘀积小鼠具有治疗作用,可能与其增加肝转运体NTCP、BSEP、MRP2、MRP4表达以及肾转运体OATP2和OATP3的表达有关。此外,谭桢等[48]研究了茵栀黄中的主要成分绿原酸(chlorogenic acid)、栀子苷(geniposide)、黄芩苷(baicalin)和滨蒿内酯(wogonoside)等对ANIT诱导的胆汁瘀积大鼠模型的治疗作用以及对胆汁酸代谢相关转运体CYP7A1、CYP8B1、CYP27A1、MRP2、MRP3、MRP4、BSEP、OATP1和OATP2表达的影响,发现茵栀黄中的绿原酸和栀子苷能有效改善胆汁瘀积、肝功能及肝脏病理性损伤,并逆转ANIT引起的胆汁酸代谢相关基因mRNA的变化,从而起到肝保护作用。
溪黄草Rabdosia serra (Maxim.) Hara为唇形科香茶菜属植物。现代研究显示,溪黄草具有保肝、利胆、增强免疫、抗炎等功效,我国岭南地区的居民有将溪黄草制作为茶饮治疗肝胆湿热的传统[49]。闵剑斌等[50-51]通过研究发现溪黄草水提液及其主要活性成分迷迭香酸(rosmarinic acid,RosA)能较明显地改善ANIT诱发的胆汁瘀积性肝损伤大鼠血清中肝功能生化指标[丙氨酸转氨酶(ALT)、天冬氨酸转氨酶(AST)、碱性磷酸酶(ALP)、总胆固醇(TC)、直接胆红素(DBIL)、总胆红素(TBIL)、总胆汁酸(TBA)],改善肝组织中抗氧化酶指标[丙二醛(MDA)、超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)],改善胆汁中成分(TBIL、TBA)的量、胆汁的分泌,同时抑制肝细胞炎症状态,保护肝细胞结构(如线粒体等重要细胞器),而且这种保肝利胆的作用机制可能是通过上调核受体FXR的基因转录和蛋白表达,然后进一步上调BSEP和MRP2的基因转录和蛋白表达而发挥保肝利胆、抗胆汁瘀积的作用。
蒲公英Taraxaci Hebra为菊科植物蒲公英Taraxacum mongolicum Hand. -Mazz.、碱地蒲公英Taraxacum borealisinense Kitam. 或同属数种植物的干燥全草。蒲公英富含黄酮类、多糖类、有机酸类等生理活性成分,有利尿、缓泻、退黄疸、利胆等功效[52]。吕渭升[53]研究了蒲公英醋酸乙酯提取物(TEE)及其活性成分咖啡酸(caffeic acid)通过FXR及其靶基因CYP7A1、BSEP对ANIT诱导的急性肝内胆汁瘀积模型大鼠的护肝利胆作用及其机制。TEE和咖啡酸能不同程度地缓解ANIT导致的胆汁异常蓄积和返流入血的病变,从而减少黄疸,改善肝功能;刺激FXR表达的上调,反馈性抑制胆汁酸合成酶CYP7A1的表达,减少胆汁酸的合成;激活肝细胞膜上BSEP的转录,加速胆汁酸从肝细胞向胆小管的外排转运,从而表现出保肝利胆、抗胆汁郁积的作用。
龙胆Gentianae Radix et Rhizoma为龙胆科植物条叶龙胆Gentiana manshuricaKitag.、龙胆Gentiana scabra Bge.、三花龙胆Gentiana triflora Pall. 或坚龙胆Gewhawa rigescens Franch. 的干燥根和根茎。在各种关于龙胆的研究中发现,龙胆具有多种药理作用,如保肝、利胆、抗炎、抗病毒等,临床应用价值颇高[54]。徐美丽[55]从胆汁酸自身反馈调节角度探讨龙胆水提物通过FXR及其靶基因SHP、NTCP、MRP2、BSEP和CYP7Al对ANIT诱导的急性肝内胆汁瘀积模型大鼠护肝利胆的作用,证实了FXR调控胆汁酸的合成和代谢是其利胆护肝的作用机制之一。
大黄Rhei Radix et Rhizoma是我国最为常用的中药材之一,中药制剂中含有大黄的有800多种。《中国药典》2015年版规定的大黄是以掌叶大黄Rheum palmatum L.、唐古特大黄R. tanguticum Maxim. exBalf. 或药用大黄R. officinale Baill. 的干燥根及根茎入药。大黄具有治疗胆汁瘀积的作用,在临床上有着广泛的应用[56]。张国强[57]采用sc炔雌醇(ethinylestradiol,EE)建立大鼠肝内胆汁瘀积模型,发现大黄能明显缓解EE诱导的大鼠胆汁瘀积,且能下调肝细胞核受体CAR的表达,但对FXR的表达无影响。大黄素(emodin)是从大黄中提取的一种蒽醌类衍生物,是大黄的主要有效单体,具有广泛的药理学作用,如抗炎、抗病毒、抑菌、免疫调节和肝保护等[58]。周方等[59-60]采用RT-PCR检测BSEP、MRP2、MRP3、NTCP、MDR2、MDR1a、MDR1b和FXR mRNA的水平,Western blotting法检测肝脏P-糖蛋白(P-glycoprotein,P-gp)的变化。发现大黄素能上调肝脏中与胆汁酸代谢相关的转运蛋白MRP3和P-gp的表达以减少胆汁酸及其他有毒化合物在肝脏中的蓄积,这可能为其退黄、恢复肝脏功能的作用机制之一。丁艳等[61]在研究中也发现大黄素可显著降低ANIT诱导的瘀胆型肝炎大鼠血清中TB、DB、ALT、TBA水平,其作用机制可能与促进FXR表达有关。此外,尚振中[62]采用人正常肝细胞株LO2对大黄素的FXR-BSEP通路干预机制进行了研究。
赤芍Paeoniae Rubra Radix为毛茛科植物芍药Paeonia lactiflora Pall. 或川赤芍Paeonia veitchii Lynch的干燥根。药理及临床研究结果显示,赤芍具有保肝、抗凝血、抗血栓、抗炎及多途径抑制自身免疫反应等多种药理作用,在临床上用于治疗胆汁瘀积型肝炎尤其是重度黄疸的疗效显著[63]。方晶[64]研究了不同剂量赤芍对ANIT诱导的肝内胆汁瘀积大鼠模型肝细胞膜蛋白NTCP、BSEP的影响,Zhao等[65-66]的研究也证实对胆汁酸转运体的干预是赤芍发挥保肝利胆作用的可能机制。周厚琴等[67]采用Autodock软件模拟预测赤芍中4种主要成分芍药苷(paeoniflorin)、芍药内酯苷(albiflorin)、芍药花苷(paeonin)、丹皮酚(paeonol)与FXR的相互作用,提示赤芍治疗胆汁瘀积型肝炎的作用机制可能为其主要成分与FXR受体蛋白具有较强结合作用,引起FXR调节其相应靶基因的表达,从而调控胆汁酸的合成和代谢,以达到保肝利胆的作用。
泽泻Alismatis Rhizoma为泽泻科植物泽泻Alisma orientate(Sam.) Juzep. 的干燥块茎,是传统中药之一。近年研究表明,泽泻除具有明显的利尿作用外,还具有抗血栓形成、调血脂、抑制动脉粥样硬化斑块形成、保肝、抗炎、免疫调节等多种作用[68],诸多著名中药复方制剂如龙胆泻肝丸、泽泻汤、六味地黄丸、猪苓汤等都含有泽泻。泽泻醇B 23-乙酸酯(alisol B23-acetate,AB23A)是一种存在于泽泻根茎中的天然三萜类化合物,已报道其具有抗肝炎、抗菌及肝保护等作用。孟强等[69-70]以小鼠部分肝切除模型为基础,考察了AB23A的促肝再生作用;采用ANIT和EE所致胆汁瘀积模型,研究了AB23A抗胆汁瘀积和肝保护的作用机制;以CCl4诱导的急性肝损伤模型探讨了AB23A的肝修复作用机制。结果表明,AB23A通过激活FXR信号通路,促进了正常肝细胞增殖、调控了胆汁酸体内平衡,从而发挥促肝再生、抗胆汁瘀积和肝保护作用。
川西獐牙菜Swertia mussotii Franch. 是生长于高原地区的珍贵中药,系龙胆科獐牙菜属植物,具有清肝利胆、祛热退黄之功效,是我国治疗各种肝病的传统药材。藏医里常常以其单方治疗肝脏和胆囊疾病,临床上多用于治疗急、慢性黄疸性肝炎[71]。刘畅[72]通过川西獐牙菜醇提取物体外刺激HepG2细胞,观测其对MRP3和BSEP的影响,发现川西獐牙菜醇提取物可刺激HepG2细胞膜转运蛋白MRP3在mRNA和蛋白水平的表达,且其表达水平升高可能与核转录因子SP1及核受体PXR、CAR表达上调密切相关。高宇等[73]发现川西獐牙菜醇提取物能明显减轻内毒素(lipopolysaccharide,LPS)诱导的大鼠胆汁瘀积性肝损伤,这种保护作用可能与上调肝细胞胆酸转运蛋白BSEP的表达有关,而且BSEP表达的上调可能是通过转录后水平调节的。杜晓煌[74]分别在mRNA和蛋白水平检测肝细胞胆酸转运蛋白MRP3、MRP4、MRP2、MDR1、MDR2、OSTα、OSTβ,核转录因子NRF2、LRH1及核受体RXRα、RARα、VDR、PXR、CAR等的表达变化,研究发现川西獐牙菜醇提取物对BDL大鼠胆汁瘀积模型保护作用的分子机制可能是通过核转录因子NRF2调节MRP4的表达上调,从而发挥减轻胆汁瘀积大鼠肝脏损伤的作用。
3.2 基于FXR的中药肝毒性研究
安全、有效和质量可控是药物的三大基本要求,中药也不例外,如何科学合理地评价中药尤其是复方中药的安全性,已成为中药研发的一个关键问题[75]。肝脏在药物代谢中发挥着重要的作用,容易受到药物的损伤,因此中药潜在肝毒性及其毒性成分研究已经成为中药安全性研究的基本领域之一。目前,肝细胞系、亚细胞、三维培养、模式动物等体内外模型在中药肝毒性的筛选中发挥着重要作用。随着现代系统观和整体论的引入,基因组学、蛋白质组学、代谢组学以及网络毒理学等新方法也开始逐步应用于中药肝毒性标志物挖掘和肝毒性预警等方面[76]。FXR不但是中药治疗肝内胆汁瘀积的重要研究方向,对其的抑制也可能是中药肝毒性的潜在原因。
乳香Olibanum和没药Myrrha作为中药能够发挥诸多功效,具有活血止痛及消肿生肌的作用,临床经常将2种药物作为对药联合使用,能够有效增强临床治疗效果。但是药物使用后,患者临床通常会表现出一系列的不良反应,这与药物自身的毒性作用密切相关[77]。朱桃桃等[78]连续ig给予Wistar大鼠乳香、没药及乳香-没药2周,末次给药后收集胆汁,HPLC检测胆汁中TBA和GSH的量,Western blotting法检测FXR和BSEP的蛋白表达。研究发现给药后,虽然大鼠的胆汁流量增加,但排入胆管的TBA量减少,且乳香对胆汁流量及TBA分泌量的影响强于没药。胆汁分泌的TBA量减少会导致TBA在肝细胞内过度蓄积,可能是乳香、没药引起肝损伤的原因之一。
何首乌Polygoni Multiflori Radix为寥科植物何首乌Polygonum multijiorum Thunb. 的干燥块根。现代研究表明何首乌具有延缓衰老、调节血脂、抗动脉粥样硬化、提高记忆等作用,因此何首乌在中药处方、已上市中成药及保健产品中应用广泛[79]。但近年来国内外陆续出现因服用何首乌或含何首乌制剂引起肝损伤的病例报道,且以急性肝细胞损伤型为主[80]。王涛等[81]发现何首乌水提物可明显损伤大鼠胆管上皮细胞和干扰肝细胞功能,明显改变大鼠胆汁成分,在不诱发严重肝脏损伤前提下即可引起大鼠胆汁瘀积相关指标的改变。检测肝脏MRP3、MRP2、BSEP、FXR、CYP7A1等分子的mRNA和蛋白表达水平,何首乌水提物使FXR表达下降,MRP3表达上调,大鼠具有胆汁瘀积特征。
补骨脂Psoralea corylifolia L. 是一种重要的药用植物,具有抗菌、抗肿瘤、抗氧化、抗炎和免疫调节等活性,其植物体内含有多种化学成分,包括补骨脂素(psoralen)、异补骨脂素(isopsoralen)、补骨脂酚(bakuchiol)等[82]。近年来补骨脂的肝脏毒性开始受到重视,相继有补骨脂肝毒性的临床和实验研究报道[83-88]。研究发现补骨脂水提物可显著降低小鼠肝脏中BSEP蛋白水平,降低了胆汁酸排出肝细胞的能力,引起肝细胞中胆汁酸浓度的升高,导致肝细胞损伤[83-84]。周昆等[85]观察了异补骨脂素体外对HepG2的细胞毒性和细胞内胆汁酸浓度的影响,并考察其对胆汁酸合成转运的影响,包括肝细胞中转运体BSEP、MRP2、MRP3、OATP2、NTCP、OSTα,合成酶CYP7A1、CYP27A1和受体FXR、PXR的mRNA转录水平。发现异补骨脂素可引起HepG2细胞内胆汁酸升高和细胞毒性,其机制可能与抑制MRP2和MRP3有关。其他类似研究也表明,补骨脂素[86]、补骨脂酚[87-88]的肝细胞毒性可能也与其影响胆汁酸转运体有关。
4 基于FXR对胆汁酸转运体/合成酶的调控探讨黄蜀葵花总黄酮改善肝内胆汁瘀积的分子机制实例研究
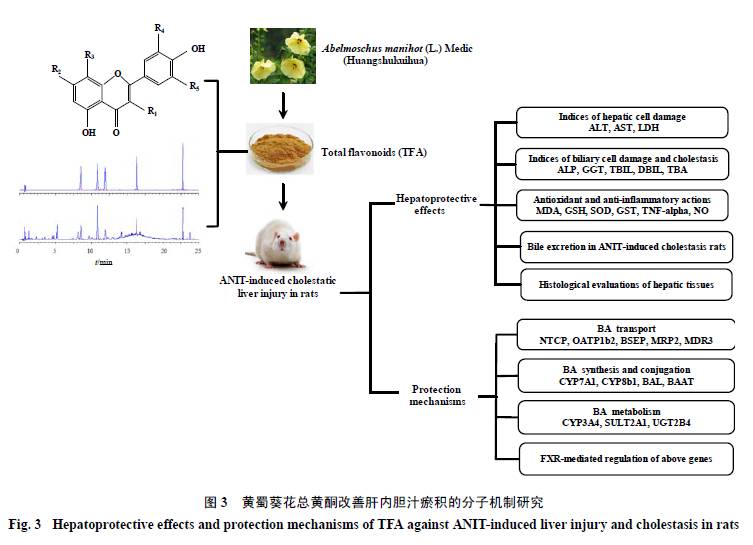
黄蜀葵花Abelmoschi Corolla为锦葵科植物黄蜀葵Abelmoschus manihot(L.) Medic的干燥花冠。现代研究表明,黄蜀葵花具有显著的药理活性,如抗炎、抗氧化、抗凝血、抗病毒、抗心肌缺血和保护缺血性脑损伤等[89]。化学成分研究发现,黄蜀葵花中主要含有黄酮类、还原糖类、鞣酸类和长链烃类等成分,其中黄酮类化合物(黄蜀葵花总黄酮,total flavoneof Abelmoschus manihot,TFA)是黄蜀葵花的主要成分,也是其主要的活性物质。目前对黄蜀葵花的化学成分和药理学研究也主要集中于TFA及其单体[90-94]。本课题组通过前期的研究,获得了成熟的TFA提取工艺,并进一步分离、纯化和鉴定了TFA中多种黄酮类单体化合物。在此基础上,利用CCl4诱导培养肝细胞损伤和大鼠肝损伤2种模型观察TFA的保肝作用,结果表明TFA能通过抗氧化应激与抗炎作用保护CCl4诱导的肝(细胞)损伤[95]。同时,在TFA对ANIT诱导的肝内胆汁瘀积大鼠保护作用的研究中,也发现TFA能够减轻ANIT导致的胆管损伤、胆汁瘀积和肝细胞受损,TFA各剂量组大鼠的胆汁平均流量均有所增加,血清生化学指标有所改善,并呈剂量依赖性,而且TFA的保肝利胆作用与其对BSEP、MRP2和NTCP的调控有关[96-97]。为了进一步探讨TFA对ANIT诱导的肝内胆汁瘀积大鼠的保护作用,本课题组将继续研究TFA对胆汁酸合成酶CYP7A1、CYP8b1及2种胆汁酸结合酶——胆汁酸-Co A连接酶(bile acid-CoA ligase,BAL)和胆汁酸-Co A: 氨基酸N-乙酰转移酶(bile acid-Co A: aminoacid N-acetyltransferase,BAAT)的影响,揭示TFA对胆汁酸合成及结合的作用机制;测定肝脏中,介导胆汁酸解毒的关键酶CYP3A4、SULT2A1和UGT2B4的表达,揭示TFA对胆汁酸代谢的作用机制。为了验证TFA是通过激活FXR进而调控参与胆汁酸体内平衡的基因表达这一推测,计划采用FXR拮抗剂木苦甾酮(guggulsterone,GS)阻断FXR信号通路,评价TFA降低肝内胆汁酸及肝保护作用是否与激活FXR有关。基于FXR对胆汁酸转运体/合成酶的调控探讨TFA改善肝内胆汁瘀积的分子机制研究方案见图3。通过研究,科学阐明TFA治疗肝内胆汁瘀积的分子机制和作用靶点,为进一步研究和开发TFA提供理论基础。
5 结语
肝内胆汁瘀积发生、发展是一个较为复杂的过程,目前尚不能完全明确其发病机制。FXR是胆汁酸合成和转运的关键调节因子,以FXR为靶点治疗胆汁瘀积性疾病具有广阔的研究前景和重要的临床价值。中药的有效成分复杂,具有多靶点、多层次、多环节综合作用的药效特点,在针对主要发病机制的同时,可以兼顾次要发病机制,多途径协同作用,这可能是中医药治疗肝内胆汁瘀积疗效的原因所在。已有研究发现FXR是多种中药及其提取物或有效成分治疗肝内胆汁瘀积的作用机制和靶点,为中药治疗此病提供了科学依据,也为中药新药的开发提供了参考。
参考文献(略)
来 源:艾 国,颜耀东,黄正明. 基于调控法尼醇X受体的中药治疗肝内胆汁瘀积的研究进展 [J]. 中草药, 2017, 48(19):4077-4088.

















