在2017年“全球渐冻人日”之前,美国FDA日批准了田边三菱公司的依达拉奉(Edaravone),用于治疗肌萎缩侧索硬化症,即渐冻人症。这是22年来首个批准的肌萎缩侧索硬化(ALS)的新药,商品名Radicava。2015年日本和韩国已首次批准依达拉奉治疗ALS;用药后可以延缓ALS患者身体机能下降。
渐冻人症属于中老年性疾病,国外也称卢伽雷氏症;是累及上下运动神经元的神经系统变性疾病;被世界卫生组织列为五大绝症之一。其主要表现为进行性延髓,四肢以及胸腰部肌肉的萎缩;是一组表现为肌无力、肌萎缩、肌束震颤和锥体束征的累及上、下两级运动神经元的神经系统退行性疾病,。
渐冻人症是一种罕见的未知病因的渐进神经退行性疾病,患者神经细胞受损逐渐加重,侵犯大脑和脊髓,部分病人发生认知障碍及额颞叶痴呆;导致特定肌肉及组织器官失控。渐冻人症最初的症状容易被忽视,大部分患者会在症状产生后的3~5年内发生呼吸衰竭,或导致完全瘫痪和死亡;是最著名的神经肌肉疾病之一。
数据显示,全球范围内的发病率约为2/10万,高发年龄为47-63岁,每年全世界出现12万例,推算我国约有10多万患者。2009年美国神经病学学院制定了《肌萎缩侧索硬化临床指南》;2012《中国肌萎缩侧索硬化诊断和治疗指南》问世。渐冻人症不是常见的疾病,除了对症治疗和支持综合治疗外,主要是通过神经保护修复,延缓病情发展。
目前尚无治疗本病的特效药物,美国FDA批准的第一个药物是利鲁唑,也只能减轻症状,却无法阻止病情的发展;神经营养剂鼠神经生长因子、单唾液酸四己糖神经节苷脂钠也是用于渐冻人的药物。依达拉奉虽然在我国已上市,目前适应症治疗脑梗塞引起的神经病变,扩大适应症仍需经过临床试验和审批。
依达拉奉是一种脑保护剂(自由基清除剂)。临床上多用于阻止脑梗塞的进展,缓解其伴随的神经症状,抑制迟发性神经元死亡和脂质过氧化,清除自由基,从而抑制脑细胞、血管内皮细胞、神经细胞的氧化损伤。
依达拉奉是2001年日本三菱制药公司研制上市的新药。2003年美国《缺血性脑卒中患者的早期处理指南》和2004年日本的《脑卒中治疗指导原则》确认是唯一经大规模临床试验证实有效的的神经保护剂。
2017年5月5日,美国FDA批准了田边三菱的依达拉奉用于治疗肌萎缩侧索硬化症,即渐冻人症。是22年来首个批准的肌萎缩侧索硬化(ALS)的新药,用药后可以延缓渐冻人身体机能下降。
数据显示,2010年全球日本三菱的依达拉奉市场达到顶峰的3.52亿美元,随后几年的销售额一直为1亿多美元。美国FDA批准用于渐冻人治疗后,将提升依达拉奉市场地位.
2003年新型的自由基清除型脑保护剂依达拉奉由先声药业率先研发成功,商品名必存,适用于改善急性脑梗塞所致的神经症状、日常生活活动能力和功能障碍。迄今为止,CFDA颁发了15家原料12家注射剂生产批文。数据显示,2016年国内重点城市公立医院依达拉奉销售额6.85亿元,同比上一年增长了15.08%。市场领先的前五家,南京先声的必存占据49.87%,吉林博大的易达生占据14.82%,国药国瑞瑞的依达占据了7.27%,昆明积大的积华尤敏占据了7.10%,吉林辉南长龙生化的清通占据了5.64%。2017年仍有多家依达拉奉处于审评中,后来者正在努力分得一杯羹。
鼠神经生长因子注射剂是国家Ⅰ类生物制品。2002年后,国内对鼠神经生长因子的研制有了长足迈进。截至2014年9月,我国已批准舒泰神(北京)生物制药股份、厦门未名生物医药、武汉海特生物制药股份、丽珠集团丽珠制药厂等4家企业生产注射用鼠神经生长因子。
鼠神经生长因子对脑血管疾病,以及头颅、脊髓损伤、神经变性性疾病和神经系统发育障碍有较好疗效;对促进神经再生修复、增强内源性神经营养活性的作用更突出,也是用于渐冻人的治疗药物。数据显示,2016年国内重点城市公立医院鼠神经生长因子用药为9.69亿元,同比上一年增长16.03%。
迄今为止,鼠神经生长因子由四家垄断市场;北京舒泰神的“苏肽生”占据了41.71%;厦门未名的“恩经复”占据了28.06%;武汉海特的金路捷占据了21.26%;广东丽珠的“丽康乐”占据了8.97%。
我国属于脑卒中高发性国家,脑卒中的死亡率五倍于心肌梗塞,发病后的及时抢救使死亡率逐年下降,而神经功能的缺损和患者不良预后使人困惑。此外,老年性视神经和听力神经的药物治疗已受到重视,加大脑神经保护类药物的开发,修复受损的中枢神经及周围神经。已成为推动了这一类药物市场的快速发展的强大推动力。
神经节苷酯(Ganglioside)是一类含有唾液酸的糖神经鞘脂,是哺乳类动物(包括人类)细胞膜的组成成分,在神经系统中含量尤其丰富。通用名为单唾液酸四己糖神经节苷脂(GM-1)。主要用于中枢神经系统创伤性或血管性病变,如脑损伤、脊髓损伤、缺血性及出血性脑血管意外和帕金森氏病的治疗,是用于渐冻人的治疗药物之一。
20世纪80年代,神经节苷酯制剂首先在意大利上市, 1984年我国参与了WHO组织的“复合型神经节苷酯治疗周围神经病变”临床研究。1996年这一药物已进入我国临床使用,我国先后批准进口了阿根廷TRB Pharma S.A.公司和巴西TRB Pharma Ind Quimica E Farmaceutica Ltda公司的神经节苷酯钠注射液,分别以商品名“施捷因”和“重塑杰”上市。2004年11月,齐鲁制药开发的神经节苷酯率先获得注册生产;目前CFDA已批准7家制剂上市。国产神经节苷酯上市后,改善了神经系统药物市场的产品结构,替代了进口药物,加快了产品的增长速度。
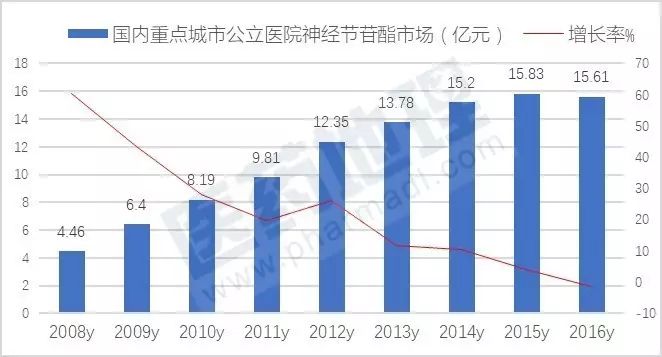
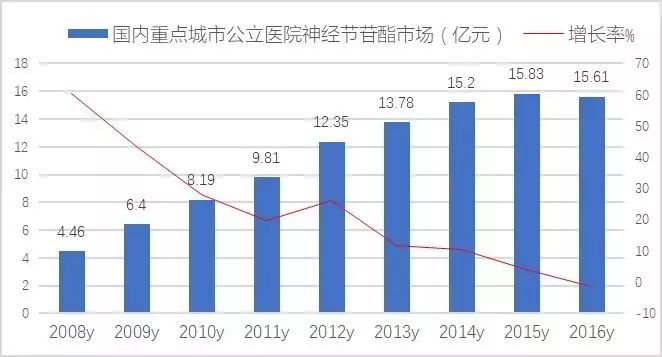
数据显示,2016年国内重点城市公立医院神经节苷酯用药为15.61亿元,同比上一年基本持平。TOP5厂商中,齐鲁制药的申捷占据了62.25%,哈尔滨医大药业的博司捷占据了9.37%,北京赛升药业的赛典占据了8.49%,长春翔通的神经节苷酯注射液占据了5.75%,西南药业的赛捷康占据了5.1%
近两年,随后市场强劲发展,用药量和销售金额一路上扬;在脑卒中、小儿脑瘫、老年痴呆症、脊髓损伤及肌萎缩侧索硬化广泛使用,进一步带动了医院市场的快速增长。
利鲁唑是法国安万特公司开发的药物,1996年FDA批准上市,商品名Rilutek。1999年安万特的利鲁唑在中国上市,商品名力如太。利鲁唑是是第一个获美国FDA和欧盟批准用于治疗ALS的药物。也是目前唯一公认对缓解ALS进展有效的药物,可改善病人生存状态,却无法阻止病情的发展。
利鲁唑通过抑制脑内神经递质(谷氨酸及天冬氨酸)的释放,抑制兴奋性氨基酸的活性及稳定电压依赖性钠通道的失活状态来表现其神经保护作用,研究证明利鲁唑可减少兴奋性递质的毒性作用,增加细胞的存活率来达到治疗的目的。
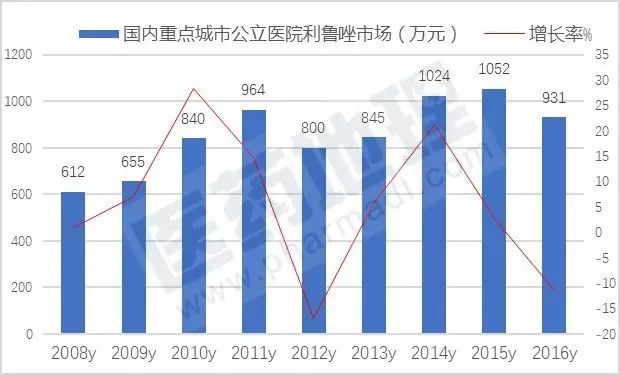
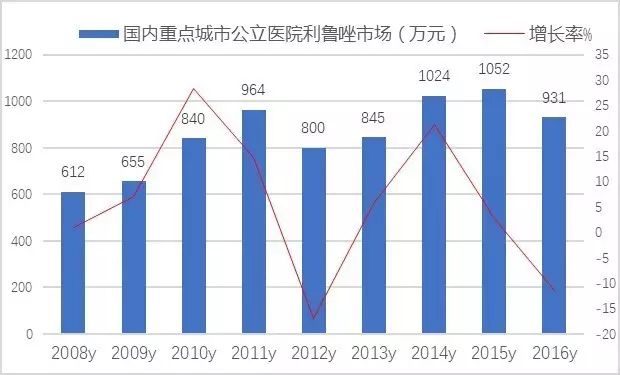
国产利鲁唑由鲁南贝特、江苏恩华、万特(海南)等三家生产,构成了四家垄断市场的格局。数据显示,2016年国内重点城市公立医院利鲁唑用药为931万元,同比上一年下滑了10%。其中Aventis Pharma公司的力如太占据了81.10%,鲁南贝特的协一力占据了15.90%,江苏恩华的利鲁唑片占据了2.99%,万特(海南)的万全力太所占份额较少。
报名参加2017年(第34届)全国医药工业信息年会请扫二维码!

















