
作者|刘冬,哈莉莉,李芳,安娜,刘意林,杨进波(CDE)
内容来源|中国临床药理学杂志 2019.12
整理排版|药研
为有序推进仿制药一致性评价提供科学依据与参考。通过近2年来化学仿制药参比制剂遴选申请平台数据,从具体品种、剂型、备案机构和适应证等多个维度,分析化学仿制药参比制剂遴选申请平台备案信息情况及其主要特征。化学仿制药参比制剂遴选申请平台提出申请的品种均具有较大市场规模,自2019年1月起呈现逐月显著上升的态势,参比制剂申请机构主要集中在东南部沿海省份,备案剂型中注射剂超过50%,备案较为集中的品种适应证以抗感染、消化系统药物占比最高。参比制剂为化学仿制药研发过程中关键因素之一,建议研发机构在充分调研的前提下及时提出备案申请。
参比制剂是指用于仿制药开发的对照药品,通常作为被仿制的对象,一般采用境内外首个获批上市且具有完整和充分安全性、有效性数据的原研药品或在美国、日本或欧盟等批准上市并获得参比制剂地位的国际公认同种药品。参比制剂的遴选应以为公众提供高质量的仿制药品为目标[1-2]。参比制剂是仿制药研发过程中的关键因素之一,也是有效开展仿制药一致性评价工作的重要先决条件。2016年3月,国务院办公厅发布《国务院办公厅关于开展仿制药质量和疗效一致性评价的意见》(国办发[2016]8号)[3],自此拉开了一致性评价参比制剂遴选的序幕;同年,原国家食品药品监督管理总局发布《关于发布仿制药质量和疗效一致性评价参比制剂备案与推荐程序的公告》(2016年第99号)[4],标志着参比制剂备案资料提交程序开始正式运行。2017年12月,药审中心发布《关于开通仿制药质量和疗效一致性评价专栏的通知》[5],药审中心参比制剂遴选申请平台正式开通。2019年3月,国家药品监督管理局发布《关于发布化学仿制药参比制剂遴选与确定程序的公告》(2019年第25号)[2],进一步明确了化学仿制药参比制剂遴选与确定程序,明确了遴选原则、遴选路径以及确定程序。本研究通过对2017年12月至2019年9月化学仿制药参比制剂遴选申请平台备案信息的梳理,分析近2年参比制剂备案信息的主要特征,结合参比制剂遴选过程中遇到的多种情况提出一般考虑,为有序推进仿制药一致性评价提供科学依据与参考。1 数据来源与研究方法
本研究数据提取自国家药品监督管理局药品审评中心“参比制剂遴选申请平台”(以下简称平台,网址:https://wbca.cde.org.cn/wbca)数据库[6],选取信息的时间段为2017.12.08--2019.09.30,包括药品生产及研发企业申请和行业协会推荐作为参比制剂的全部数据信息,以药品通用名、剂型、备案机构名称、申请时间等多个维度进行全面梳理。本研究采用描述性统计分析方法,以申请品种的药品通用名、剂型、备案机构名称、适应证和年度市场销售额等为关键指标,分析近2年我国化学仿制药参比制剂申请情况。2 平台数据情况及统计分析
截至2019-09-30,平台共收到企业申请和行业协会推荐其他药品作为参比制剂信息2537条,本文分析的信息来源为已完成平台申请的全部信息。2. 1 年度新增信息分布情况
经对各年度信息进行统计,平台数量呈逐年递增趋势。特别是2019年度,虽只有1月至9月的数据,但其数量已占平台近2年总量的70%以上,见表1。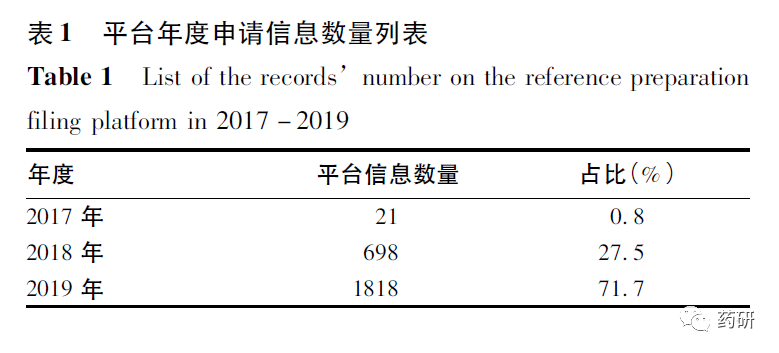
2019年1月至9月,平台月度申请信息数量持续增长,自3月份开始逐月的新申请数量均超过140条,见图1。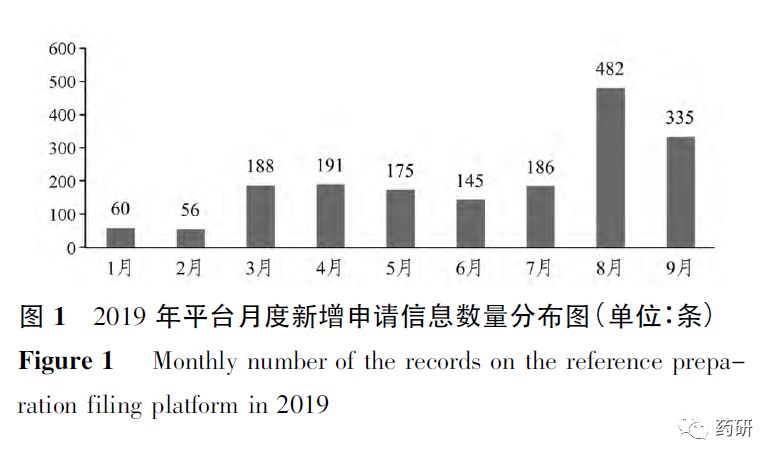
2. 2 月度新增信息分布情况
2018年,平台月度申请信息数量基本保持稳定,各月新增申请均在80条以下,见图2。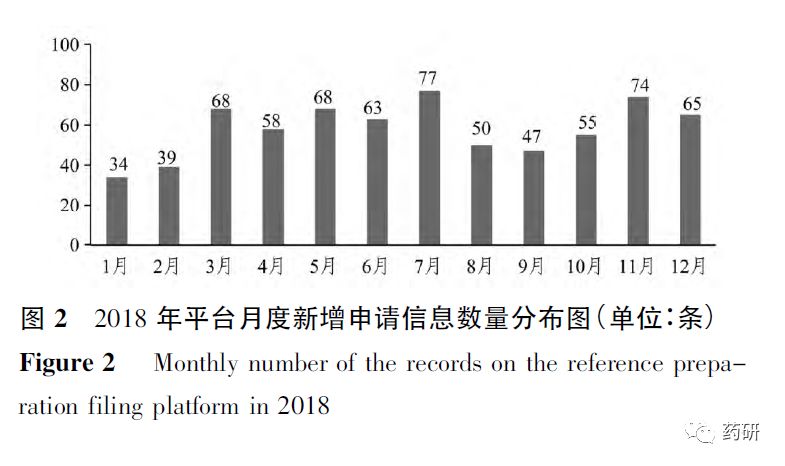
于2019-08-05,国家药品监督管理局药品审评中心网站发布《关于在审化学仿制药参比制剂有关事宜的通知》[7],目前在审评的注册分类3,4,5.2及化学仿制药一致性评价的品种中,存在所选用的参比制剂尚不在国家药品监督管理局发布的参比制剂目录中的情况,为优化审评与参比制剂遴选工作的衔接流程,提高审评效率,建议申请人尽早通过参比制剂平台提出参比制剂遴选申请。通知发布后,平台申请数量呈现明显上升,仅2019年8月新增申请信息数量达482条,是2018年平均月度新增申请信息数量的8倍以上。2. 3 参比制剂备案申请情况分析
2. 3. 1 备案品种剂型分布情况
根据平台提交的参比制剂申请信息,从剂型角度可见注射剂约占55%,为目前主要申请剂型,片剂、胶囊剂约占30%,对于目前仿制药开发技术壁垒较高的吸入制剂、膜剂等新兴剂型也有部分品种提出申请,具体剂型分布情况见表2。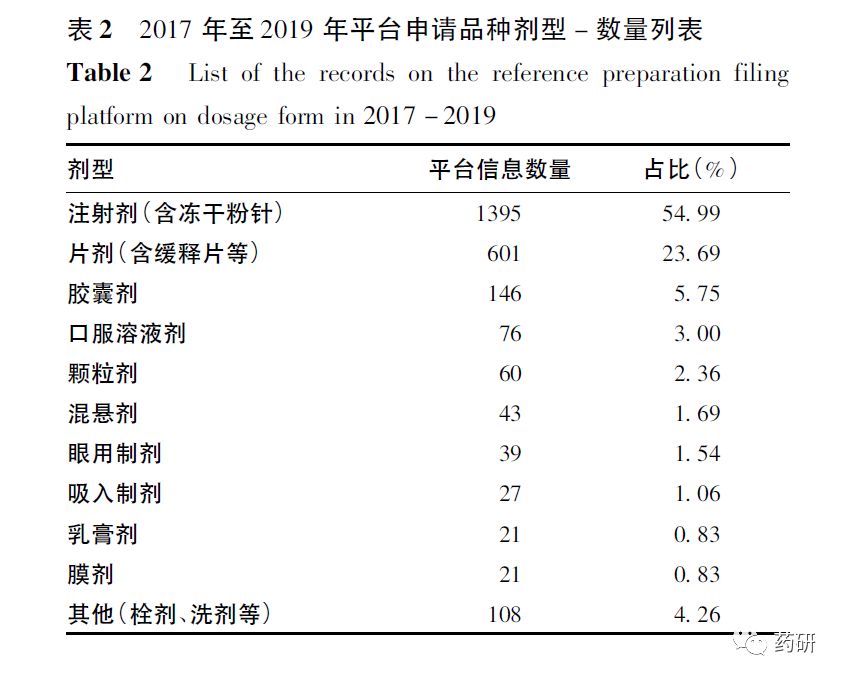
平台完成申请的2537条信息中,共涉及约1100个品种(区分不同剂型),主要品种分布情况,见表3。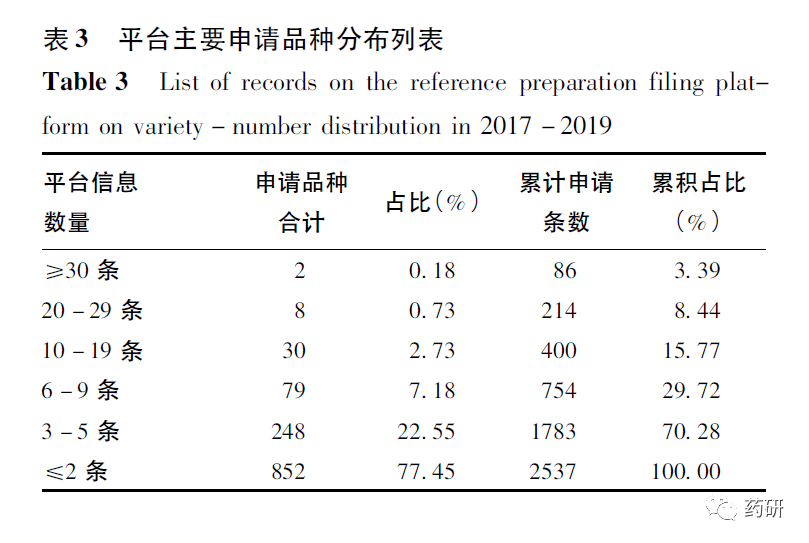
从品种分布情况可见:申请品种相对较为分散,≤2条申请信息的品种约占总申请品种数量的77.5%,≤5条备案信息的品种约占申请信息条数的70.3%;而相对集中的8个品种申请条数为214条(约占全部信息条数的8.5%)。参比制剂申请信息条数≥15条的12个具体品种、适应证及市场规模情况,见表4。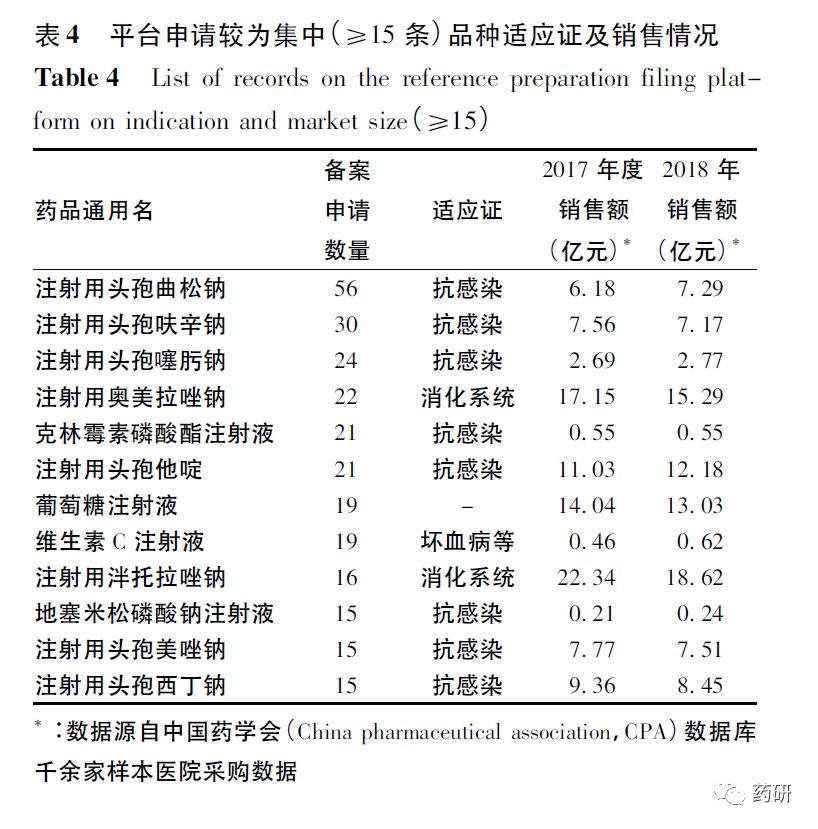
平台申请较为集中的品种可见,多为抗感染、消化系统疾病治疗药物,均为注射途径给药。2017年和2018年样本医院市场销售额均接近或超过亿元,其中注射用泮托拉唑钠、注射用奥美拉唑钠、注射用头孢他啶等品种年销售额均大于10亿元。平台申请信息≥15条的12个品种中,6个品种为头孢菌素类抗生素。经统计,平台中共671个机构提出申请,≥25条申请信息的12个机构共提交505条申请信息,约占全部申请信息的20%,其地域性分布多为东南沿海省份,见表5。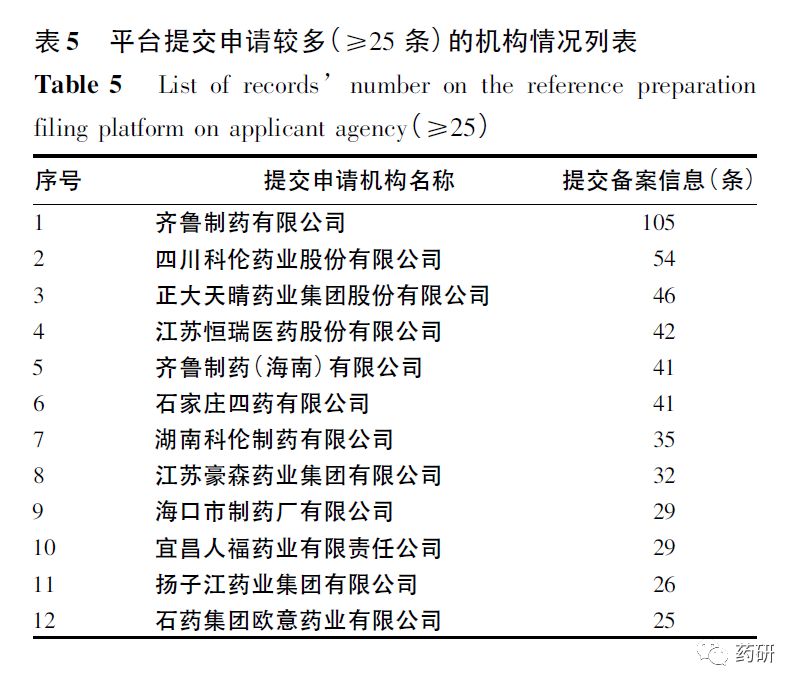
3 讨论与思考
3. 1 参比制剂遴选和发布情况
截至2019年10月8日,国家药品监督管理局已发布化学仿制药参比制剂目录累计22批次,共涉及1899个品规,其中涉及注射剂402个品规(约占已发布参比制剂的21.2%);药审中心网站已完成第23、24批参比制剂目录的公开征求意见,两批目录涉及529个品规。已公布的仿制药参比制剂目录采取滚动更新,如遇部分品种持证商发生变更、国内注册证过期、销售状况发生调整等情况,将根据具体情况于后续发布的参比制剂目录中予以更新、勘误,截至2019年10月,已发布勘误17条。在对平台中提出申请的资料审核中,存在部分资料调研不够充分,未提供证明材料或提供不全等情况,对所申请品种参比制剂的遴选工作造成滞后或延误,具体表现在以下几个方面:①申请品种全球最早上市时间以及所提供信息不足,如欧洲各国(含欧盟国家)批准情况调研不充分,且未能提供相关证明;②美国、日本、欧盟或其他国家原研或国际公认产品上市后的安全性、有效性研究情况调研不够充分;③备案品种参比制剂上市国以及相关国家市场销售情况未能提供或数据不完整;④基于品种开发等原因仅提供部分国家获批信息,对参比制剂遴选造成误导;⑤未提供真实性证明以及提交电子申请资料附件无法打开等。按照《关于发布化学仿制药参比制剂遴选与确定程序的公告》(2019年第25号)中的明确要求,药审中心参照遴选程序组织召开专家委员会审议,并在60个工作日内予以答复。由于平台提交申请品种近期增加较为明显,对于60个工作日内已完成遴选的品种,将直接在参比制剂目录征求意见稿和正式稿中予以公布。后续药审中心将进一步完善参比制剂遴选申请平台功能、加强与申请人的互动,继续做好参比制剂申请相关工作指导与服务。对于在公示期间收到异议或存疑反馈的参比制剂品种,将根据具体品种情况在时限内予以答复、反馈;若未收到回复的申请机构,可参照25号公告中相关内容,采用邮件、申请人之窗等多种形式在时限结束后予以询问。随着药用辅料以及制剂水平的逐年上升,部分较早获批上市的原研或具有国际公认地位的产品,其处方或制备工艺等方面尚劣于现市面销售的仿制药,如:注射剂中含有苯甲醇、EDTA等辅料的使用,更优的给药装置使用等情况。一方面,参比制剂遴选过程中监管机构将进一步关注此类产品参比制剂的选择;另一方面,建议研发机构在提交参比制剂申请时提供更多可参考的依据,便于遴选出最优的参比制剂。因国内原研进口品种获批较晚、采用中外双报等原因,部分品种可能采用国外具有参比制剂地位的原研产品作为参比制剂,自第22批参比制剂目录发布起,已启动部分品种参比制剂的增补与修订工作,建议研发机构在品种研发阶段开展较为全面的调研,在平台中提出申请,并提交明确的增补说明。------------THE END------------
声明:药研对本文观点保持中立,不对文章可靠性提供任何保证。文章仅供交流学习使用,版权归原作者所有,如遇版权问题请与我们联系(Email:[email protected])
药研论坛:药研公众号自2016年成立以来持续为业内提供药物研发、生产和注册相关信息,目前制药领域关注用户近5万人!药研主导的培训已筹办多期,截至2019年10月已为包括扬子江药业集团、石药集团、华北制药、华海药业、恒瑞医药、科伦药业、丽珠集团、香港澳美、东阳光、中国医学科学院、中国科学院、亚宝药业、上海强生、阿斯利康、山德士、远大集团、正大天晴、豪森药业、海正药业、天士力、以岭药业、成都倍特、陕西步长、北京协和、华润紫竹、华润双鹤、北京泰德制药、江苏先声药业、山东齐鲁、山东绿叶、仙琚制药等知名企业在内的900+企业和CRO提供了高质量的专业化培训,均收到良好效果,会后获得参会企业一致好评。已成为制药领域货真价实的高端培训品牌!











