
原文链接
:
https://www.nature.com/articles/s41389-019-0150-2
上皮性卵巢癌(OC)最常见的类型是浆液性卵巢癌(SOC),约占卵巢癌病例的90%。另一方面,边缘性卵巢癌(BOC)的预后较好,约占所有卵巢肿瘤的15-20%。然而,由于缺乏早期诊断、预后、治疗和反应性生物标志物,SOC是最致命的妇科肿瘤。大约70%的病例是在晚期诊断的,此时疾病已经扩散,存活率很低。因此,寻找新的癌症生物标志物是OC研究的主要目标之一。
在这方面,有一种蛋白质因其作为生物标志物的潜在用途而引起了人们的兴趣,它是印迹位点调控因子(BORIS)的兄弟。BORIS是由CTCFL基因编码的转录因子,CTCFL基因是CTCF的一个分支。目前还没有全基因组的BORIS活性研究来了解这种蛋白对卵巢癌转录和致癌过程的影响及其程度。因此, BORIS调控功能的识别和理解有助于预测新的药物靶点或将其作为卵巢癌患者预后的生物标志物。因此,本研究旨在利用基因表达微阵列和生物信息学分析卵巢癌细胞系和患者样本,从全基因组的角度研究BORIS在卵巢癌中的调控作用。
1.
在卵巢癌细胞系和BORIS缺陷细胞中BORIS表达的表征
鉴于与其他类型的肿瘤相比,CTCFL (BORIS)被发现主要在卵巢癌样本中下调。本研究旨在探讨BORIS在卵巢癌基因调控中的作用。这项工作是通过两种不同的实验方法完成的:在体外使用卵巢癌细胞系、分子生物学技术和生物信息学工具;以及一种体外方法来评估BORIS在卵巢癌患者样本、GEO数据库公开提供的样本和卵巢癌新鲜组织样本中的临床相关性(图1 a)。
作为第一个方法,我们评估了BORIS在三种卵巢癌细胞系中的转录本和蛋白水平(OVCAR3、SKOV3和SW626),
选择最合适的细胞模型进行如下实验(图1b)。先前已在HeLa中报道了BORIS的表达,因此我们使用该细胞系作为阳性对照。我们使用位于其所有剪接变体共有的区域中的寡核苷酸评估了所有BORIS转录报告。此外,第二对引物仅用于扩增剪接变体的BORIS亚家族1 (sf1),因为它编码canonic蛋白。我们观察到,与HeLa相比,OVCAR3和SKOV3细胞系具有更高的BORIS表达水平。此外,sf1在OVCAR3细胞中的表达水平高于HeLa和其他卵巢癌衍生细胞(图1b)。此外,我们通过western blot检测不同细胞系中BORIS的丰度,并与HeLa进行比较(图1c)。在细胞系的BORIS中,我们没有观察到显著差异。
考虑到我们对BORIS表达缺乏及其与卵巢癌的关系评估很感兴趣,我们选择OVCAR3进行后续实验。
为了评估要评估与BORIS相关的表达谱,我们获得了两种水平下降的细胞模型:一种通过siRNAs转染(KD),第二个是CRISPR / Cas9系统(KO)。然后,我们比较了KD和KO细胞的内源蛋白水平(对照)。KD细胞效率下降40-90%(图1d), KO细胞效率下降50%(图1e)。
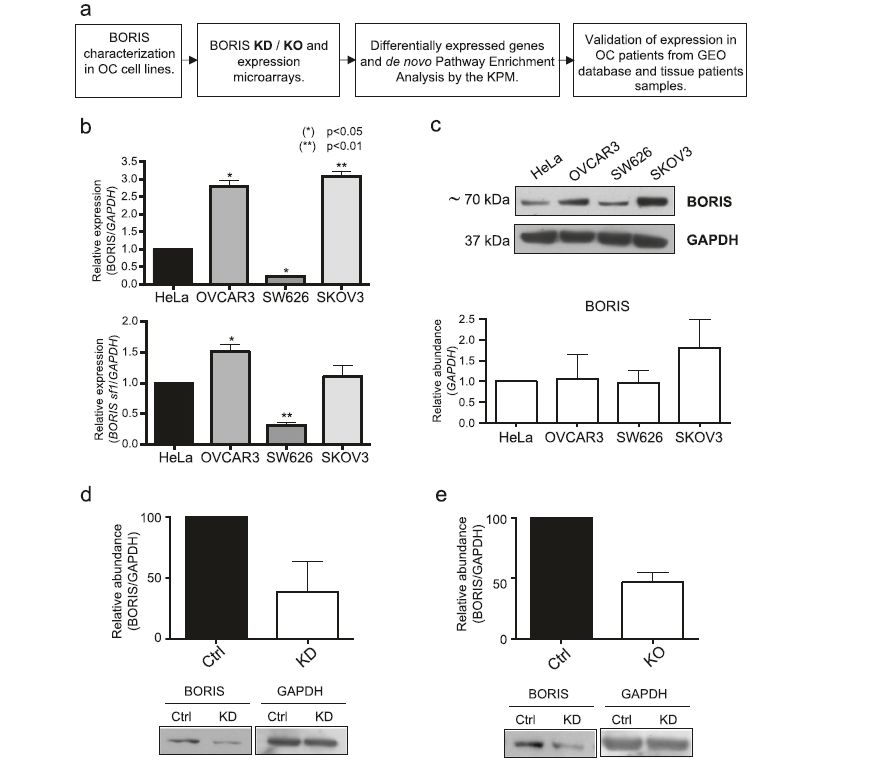
图1 BORIS在卵巢癌衍生细胞系中的表达特征
2.
KD
和KO细胞表达谱分析
这项目工作的第一个目标是其确定在卵巢癌中由BORIS调控的新基因;然后,用表达微阵列获得KD和KO细胞相对于对照组的表达谱。选择KD/对照组和KO/对照组差异表达基因(DEG), FDR p值< 0.1 (图2a)。我们观察到在KD细胞系中的DEG数为299,在KO细胞系中的DEG数为418。对两种条件进行了GO-term富集分析。此外,我们发现在这两种细胞模型中有130个基因是一致的,其中87个基因过表达,43个基因低表达(图2b)。一般来说,我们发现BORIS在两种模型(KD和KO)中的减少对应与DEG的63%的过表达和36%的低表达,表明BORIS可能主要作为一个转录抑制因子(图2c)。令人惊讶的是,我们观察到一组非编码基因(SNORDs)在KD和KO后表现出主要的表达变化(图2d)。利用KD和KO细胞的DEG,我们只选择了两种实验策略中发现的基因。这样做是为了排除这些基因是由于试验技术导致的,而不是由于BORIS的减少。我们在两个细胞模型中都鉴定了130 DEG,接下来的研究基于这些基因(图2b, e)。
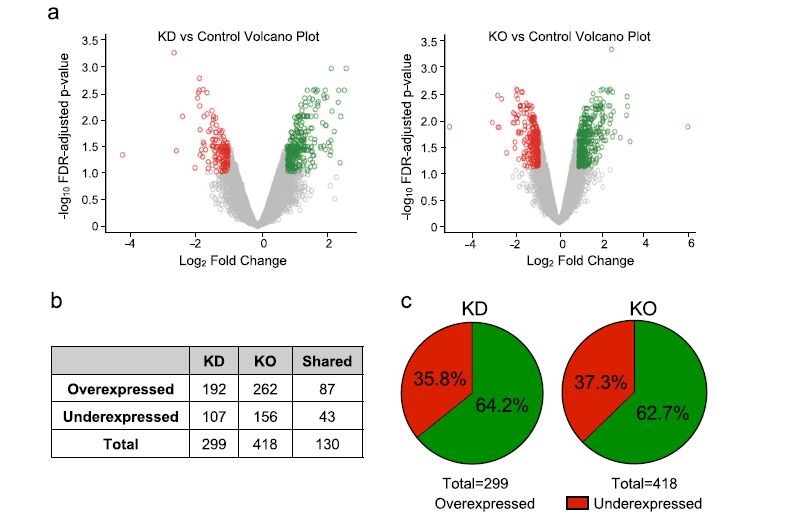
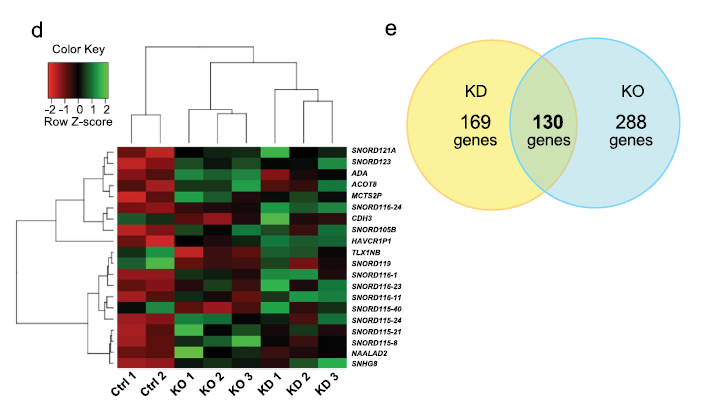
图2 OVCAR3对照、OVCAR3 BORIS KD和OVCAR3 BORIS KO的差异表达微阵列分析
3.
在KD和KO细胞中识别与BORIS相关的网络
为了确定一个BORIS相关的调控网络,我们使用了KD和KO细胞中发现的130 DEG,该网络为我们提供了卵巢癌BORIS的潜在新靶点,同时用KeyPathwayMiner (KPM)进行了de novo pathway的富集分析。在生物网络和一系列表达研究的基础上,KPM提取了富含差异表达基因(DEG)的子网络。该方法通过从HTRIdb中提取BORIS相关网络,可以发现以前未被描述的调控网络,一个大型的经实验验证的人类基因调控相互作用数据库。
我们的结果表明,AR基因在BORIS耗竭后改变其表达,是调控网络的主要转录因子(图3a)。此外,以前与卵巢癌相关的基因,如FN1、FAM129A和CD97,被确定为AR靶点。不过,目前还不清楚BORIS是直接监管AR还是间接监管AR。因此,我们在AR启动子中使用抗BORIS抗体进行染色质免疫沉淀试验(ChIP)。我们观察到BORIS位于AR基因启动子处(图3b)。最后,为了验证BORIS相关网络,我们通过qRT-PCR对KD和KO细胞的表达变化进行了评估。我们的结果表明,AR、FN1、FAM129A和CD97基因在BORIS降低后确实改变了它们的表达水平(图4a, b)。根据我们的研究结果,来自癌症细胞系百科全书的表达数据显示,约82%的卵巢癌来源细胞系对FN1、FAM129A和CD97基因再现了相同的现象。后者认为BORIS是AR、FN1、FAM129A和CD97基因的转录抑制因子,不仅在OVCAR3中,而且在一组更大的卵巢癌衍生细胞系中,这表明这种现象可能与卵巢癌生物学有关。
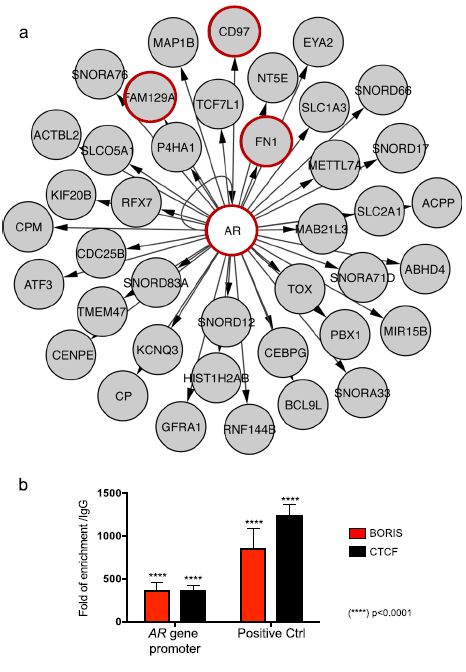
图3 AR作为靶基因在BORIS
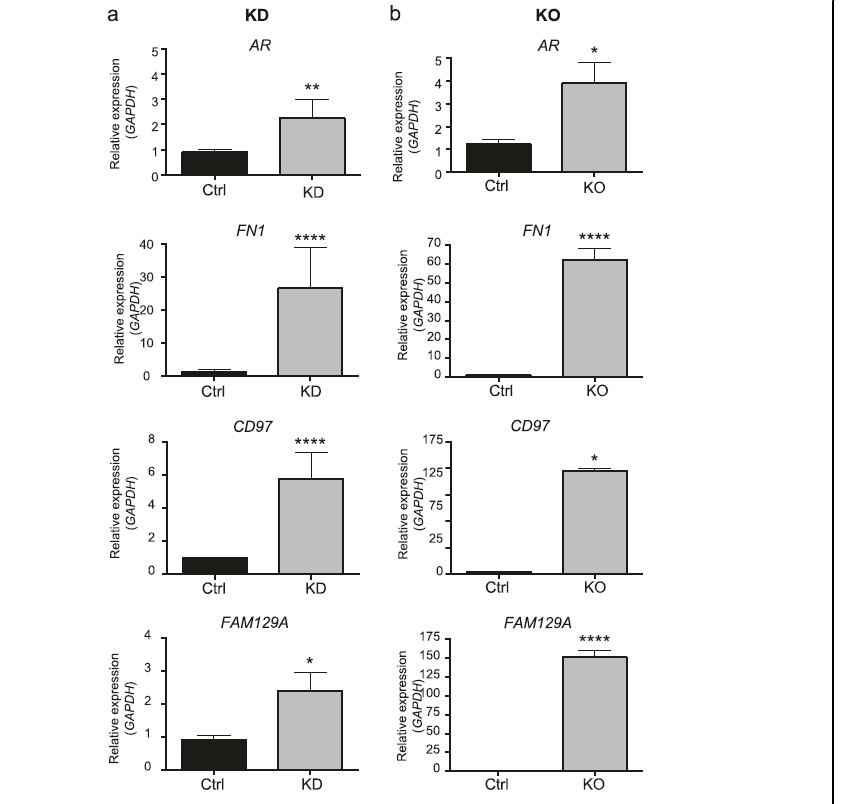
图4
BORIS
相关转录调控网络的验证
相关转录调控网络中的识别与验证
4.
CTCFL (BORIS)
、AR、FN1、FAM129A和CD97基因在浆液性卵巢癌、交界性卵巢癌和非肿瘤性卵巢癌中的表达分析
之前,我们发现高水平的AR、FN1、FAM129A和CD97转录本与卵巢癌细
胞系BORIS表达的降低有关。因此,为了确定这种表达模式在卵巢癌样本中是否相似,我们分析了来自GEO数据库的343个表达微阵列(43个非肿瘤性、288个浆液性卵巢癌和12个交界性卵巢癌样本)。
我们提取了BORIS、AR、FN1、FAM129A和CD97基因的表达值,并绘制了非肿瘤性、浆液性卵巢癌和交界性卵巢癌样本的热图(图5a)。我们的数据显示了正常和癌症样本之间的广泛异质性。首先,我们在浆液性卵巢癌样本中观察到两个主要的树状图分支:BORIS阳性(红色)和BORIS阴性(绿色),与非肿瘤性和交界性卵巢癌样本相比,BORIS的水平较低。浆液性卵巢癌患者的一个重要子集表现出高水平的BORIS(42-47%;图5a)。此外,在本组患者中,我们还可以发现不同的AR、FN1、FAM129A、CD91的表达组合;然而,一组重要的BORIS样本也显示低水平的AR(28%的样本)和低水平的FN1(13%;图5b),与我们的体外研究结果一致,暗示这两个基因在浆液性卵巢癌种可能都起着重要作用。
此外,由于浆液性卵巢癌患者的发病率较低,我们旨在根据这些基因的表达模式将这类卵巢癌分为簇(图5a, c)。我们在2号和6号簇中发现了一个清晰的表达模式,这与之前在体外OVCAR3细胞系中描述的现象相一致(图3),其中BORIS的存在与低水平的AR,FN1,FAM129A和CD97(簇2)相关,而BORIS的缺失具有相反的行为(簇6;补充图S5,S6)。
此外,我们评估了患者样本组织中的BORIS,AR,FN1,CD97和FAM129A,以评估其临床价值。例如,我们想知道这些基因的表达是否与临床特征有关。因此,我们获得了在第二个队列中11个浆液性卵巢癌,10个边缘卵巢癌和8个非肿瘤患者中这些基因的相对表达水平。我们针对临床变量对结果进行了测试,发现BORIS和AR基因与CA-125表达、肿瘤大小和FIGO分期无关(表1)。然而,我们发现BORIS与恶性肿瘤有关;或者,与交界性卵巢癌和非肿瘤性样本相比,浆液性卵巢肿瘤患者BORIS的水平显著升高(p = 0.017),与之前在GEO数据库中大样本研究中的发现一致。后来提出,BORIS是卵巢癌尤其是浆液性卵巢癌种相关的下调基因。其中一部分患者显示出BORIS和AR表达之间负相关,与肿瘤恶性程度相关。
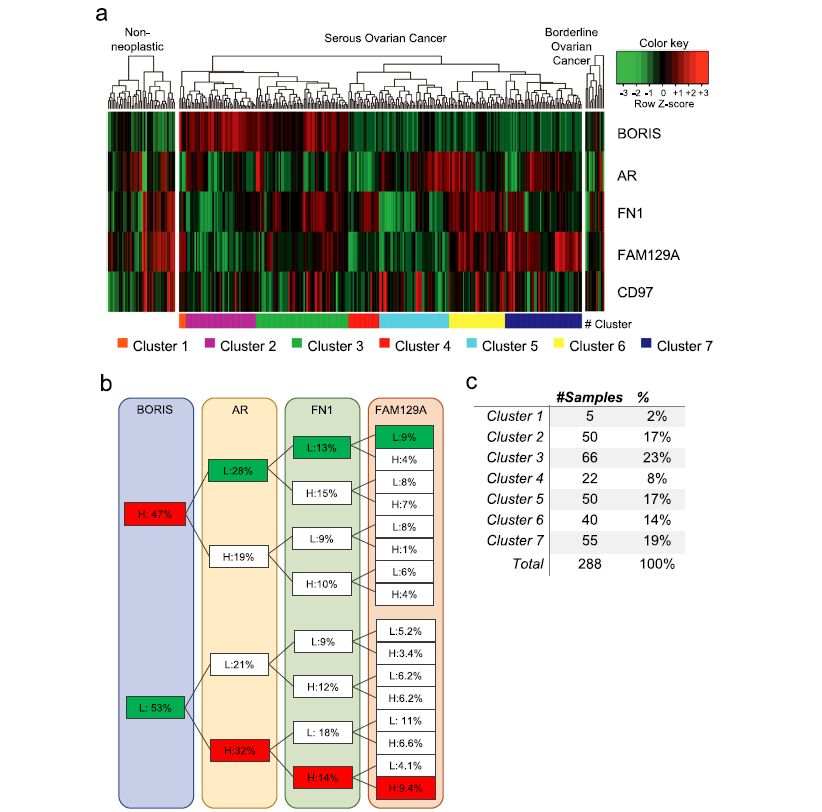
图5
从
GEO
数据库中选择的卵巢癌样品中
BORIS
、
AR
、
FN1
、
FAM129A
和
CD97
基因的表达谱
综上所述,我们的研究结果表明BORIS与AR基因启动子结合,并作为AR的转录抑制因子。此外,BORIS水平的降低与FN1、FAM129A和CD97基因表达的增加有关(图6a)。此外,在卵巢癌患者中,BORIS在47%的浆液性卵巢癌样本中过表达,在交界性和非肿瘤性样本中表达下调,因此与恶性肿瘤显著相关。我们的数据还表明,具有BORIS过表达的一部分浆液性卵巢癌样本中也存在AR的低表达(28%)和过表达(19%),表明在卵巢癌样本中,在OVCAR3细胞系中,BORIS 和AR的关系不一定发生在所有卵巢癌样本中(图 6b)。然而,我们仍然忽略了BORIS和AR表达水平的不同组合是否与特定的结果相关,以及它们作为预后生物标志物的联合使用是否对浆液性卵巢癌患者有益。因此,BORIS和AR是否可以同时作为卵巢癌的预后生物标志物还需要进一步的研究。
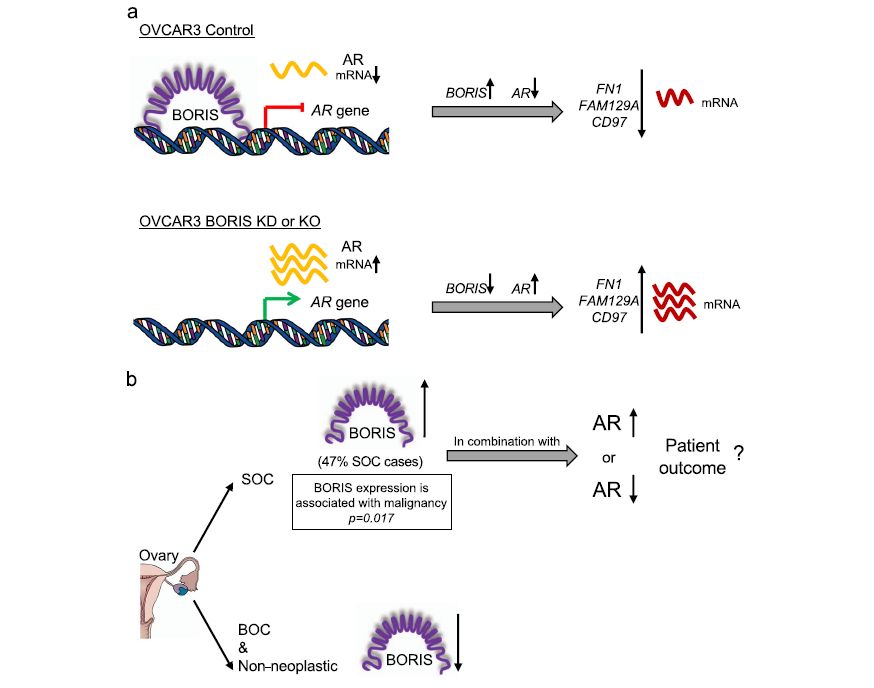
图6 BORIS介导的AR转录抑制示意图模型及其在卵巢癌患者中的临床意义
以前,一些研究表明,BORIS的减少与细胞增殖和细胞活力的降低有关。因此,我们的目的是识别受BORIS调控的基因,这为卵巢癌的生物学研究提供了一定的思路。差异表达分析表明,在BORIS缺失的情况下,几种核小RNA和核仁小分子RNA是受影响最大的基因。为了从系统的角度理解BORIS的功能,我们应用KPM将我们的表达研究与已知的基因调控相互作用相结合,以提取新的疾病通路和潜在的药物靶点。通过对130 DEG的富集,我们鉴定并实验验证了AR基因是BORIS相关调控网络的主要调控因子之一。这种类型的分析可能表明BORIS可能通过与AR启动子结合来改变AR的水平,从而对转录调控产生影响。我们的数据显示了生物学和治疗相关性,因为AR已被用作不同肿瘤的生物标志物,如前列腺癌,是一个重要的药物靶点。由于卵巢也负责AR的合成,因此寻找与AR蛋白相关的生物标志物具有重要意义。有趣的是,我们从KPM得到的结果表明,BORIS在一定程度上负责调控AR基因的表达,反过来,AR与FN1、CD97和FAM129A等基因建立了一个基因调控网络,这与与包括卵巢癌在内的多种癌症的预后不良、耐药和转移有关。以前的研究仅限于通过增加或降低BORIS水平评估基因表达的变化来鉴定可能的靶基因;
然而,我们的de novo通路富集分析使我们能够对与癌症相关的潜在基因进行新的选择(基于公共数据库中提供的数百个实验数据),这些基因通过AR和BORIS密切相关。总之,我们发现在BORIS KD和KO模型中,BORIS调节几种基因,主要作为转录抑制因子起作用。值得注意的是,BORIS是AR基因的转录抑制因子,并与AR基因的启动子结合。我们的研究结果表明,BORIS还可以调控卵巢癌中涉及的其他基因,如FN1、FAM129A和
CD97。最后,我们发现浆液性卵巢癌患者的一个子集显示BORIS过表达,这与恶性肿瘤显著相关。
总之,我们的体外研究证实BORIS有潜力作为浆液性卵巢癌的预后生物标志物,并在BORIS控制的调控网络中产生新的药物靶点。
细胞系培养
癌细胞株OVCAR3、SKOV3、SW626和 HeLa取自ATCC (Manassas, VA, USA),按供方描述进行继代培养。后续进行Knockdown 和Knockout分析,Western blot分析和ChIP等。














