癌症免疫疗法领域中的基础科学进步在临床上产生了多个取得成功的疗法。这些疗法中的很多需要将基因插入细胞中以直接杀死它们或是重新指导宿主细胞以诱导有效的免疫反应。其他类似的疗法工作还有通过改造效应细胞以提高靶向性以及加强对肿瘤细胞的杀伤。最初使用γ-反转录病毒进行的研究结果前景可观,但是集中于可能发生插入突变的安全性问题凸显了对于发展其他备选的基因载体的需求。已经确认了慢病毒载体(LVs)可能时更有效和更安全的备选运输载体。LV现在被用于包括癌症在内的多种不同类型的内生和获得性疾病的临床试验中。本综述会讨论关于LV的只是和以这种病毒载体为基础的运输载体在癌症免疫治疗中的应用。
癌症免疫疗法指的是为了根除肿瘤细胞而利用免疫系统的疗法。体内的免疫细胞本来就有识别和攻击恶性细胞的机制;但是,肿瘤细胞经常会采取针对这些机制的反制措施来使其失效。免疫疗法旨在通过多种不同方法来加强和补充这些自然反应,其中包括抗体和细胞因子疗法、癌症疫苗和过激细胞输注。这些疗法中的一些需要对病人的细胞进行基因改造,或者直接杀伤肿瘤细胞或者诱导免疫反应或提高其靶向和细胞毒性。为了能将这些基因疗法应用于临床,一个能安全而有效的导入转基因的可靠方法至关重要;到目前为止已经研究并检测了很多方法。
使用γ-反转录病毒(又名肿瘤病毒)将特异性的T细胞受体输送到淋巴细胞以治疗黑色素瘤是第一个将经过基因改造的免疫细胞用于癌症免疫疗法的临床试验。在这项公布于2006年的工作之后,很多不同的癌症免疫疗法方案应用了多种基因传输方法。应用了包括病毒和非病毒的多个系统。重组γ-反转录病毒仍然是一个流行的选择;但是,慢病毒载体(LV)已经成为另一个潜在的更为安全和有效的选择。到2014年为止,19.2%的基因疗法试验中使用了γ-反转录病毒。使用LV的目前仅占到公开和历史试验的3.5%,但是,这个数字正在增长。
其他常用的病毒基因传输的选择包括重组腺病毒(Ad)以及腺相关病毒(AAV)。Ad载体可以产生很高的滴度,但是他们会引发多余的免疫反应并且由于不能整合进宿主基因组而限制了持久的转基因表达。已知野生型AVV优先整合于基因组的一个位点,但是重组版本的AAV整合的频率不高。除此之外,AAV的包装容量较小,限制其可携带的转基因的大小。γ-反转录病毒和LV都能有效的将其DNA插入到宿主基因组中,因而可以进行转基因产物稳定和长期的表达,而这也是为何这些载体会经常被选来应用在直接针对癌症免疫疗法中。
LV属于反转录病毒科。但是其具有比γ-反转录病毒更为复杂的基因组。所有的反转录病毒都含有病毒感染和复制所必须的基础基因。这其中包括编码结构蛋白的
gag
基因,编码酶蛋白的
pol
基因以及编码包膜糖蛋白的
env
基因。LV还具有病毒复制必需的
rev
和
tat
基因以及附加基因
vif
,
vpr
,
vpu
和
nef
。Malim和Emerman对这些附加基因的功能进行了综述。结构蛋白对于病毒核心内RNA周围的结构包装至关重要。病毒核心内含有两个拷贝的相同RNA以及和核衣壳蛋白结合在一起的整合酶、反转录酶以及蛋白酶。核心的外部,存在一层能与外层脂膜相互作用的基质蛋白。由
env
编码的糖蛋白镶嵌于此外层中。
病毒的感染起始于由env编码的糖蛋白与细胞膜受体结合之时。以LV为载体的基因疗法中应用最广泛的包膜蛋白取自水泡口炎性病毒,使得病毒通过与LDL受体和类似的家族成员结合而具有广泛的亲嗜性。结合事件的发生使得病毒与细胞发生融合。在结合之后,病毒内容物被传输进细胞。一旦进入细胞,病毒就解包装并将核心组分释放进胞浆。这其中包括单链RNA基因组,它会被转化为cDNA并被运输进细胞核。而另一方面,LV还具有其他特性,包括核心DNA摆动和其他未定因素,使其DNA可以通过完整的核膜。γ-反转录病毒和LV都将其DNA(这时都是双链)整合进宿主基因组,然后利用宿主的机制将其基因转录回RNA。一旦完成复制并回到胞浆,来自野生型反转录病毒的病毒RNA被翻译并被包装进一个新的病毒颗粒中,然后以出芽方式离开细胞完成生命周期。
为了能被应用于基因疗法中,对LV基因组进行了几项改变以最大化安全性。这些改变被归纳为三次更新换代。在最新的第三代系统中,病毒基因组组分被分装进一个包装质粒、一个传输质粒以及一个包膜质粒,然后被转染进HEK293T细胞(主要)进行复制。包装质粒中含有所有病毒复制中需要的反式作用因子。这其中包括结构和酶蛋白的基因
gag
和
pol
,还有病毒调节基因
rev
。或者,可以用第二个包装质粒表达rev,这就生成了一个4质粒系统。传输质粒包含感兴趣的转基因以及必需的顺式作用元件,诸如psi (Ψ) RNA包装信号,以及3’端和经过改造的5’端LTR元素。经过改造的5’LTR用一个组成型激活的不依赖于
tat
的启动子替换了内源性的HIV启动子,从而使得包装质粒中可以不必携带
tat
基因。编码包膜的蛋白由一个单独的质粒表达,并可以通过一个被称为假型的过程改变病毒的亲嗜性。这个多质粒体系确保了只有转基因和顺式作用元件被转导。非必要的病毒蛋白,诸如附加蛋白都被省略,这降低了免疫原性并且删除这些编码序列进一步降低了会产生具有复制能力的慢病毒的重组的发生可能性。
在第二和第三代系统中,又做出了进一步提升安全性的改变,其中包括会自我失活的传输载体的发展。这是通过切除传输载体3’端LTR中的U3区域,这个区域会在反转录之后迁移到5’端并发生整合,这样就有效的把LTR启动子活性最小化了。这项切除不会显著病毒滴度,并且这项切除减小了启动子的干扰从而避免因此造成不希望发生的转基因沉默。将病毒基因分割进不同的质粒,以及实用自我失活的传输载体,进一步降低了产生具有复制能力的慢病毒的可能性。
除此之外还进行了其他优化载体系统的改造。这其中包括加入一个中心嘌呤带,这可以提高整合前复合物向核内的转运;而一个土拨鼠乙型肝炎转录后调节元件可以起到加强转基因表达的作用。这些特性的同时作用提高了转导效率以及转基因表达。细胞特异性或可诱导的启动子的使用也能成为一个有效的工具。细胞或组织特异性的启动子试图将转基因靶向到特异组织进行转录,例如肿瘤细胞,其目的在于减少脱靶效应。可诱导启动子的加入使得我们可以通过给予诸如四环素之类抗生素来在必要时打开和关闭基因的表达。在癌症的免疫疗法中,这使得带有整合了前病毒的免疫细胞在必要时提供抗癌治疗,而减少永久性的转基因表达,后者会带来希望之外的副作用。
尽管对这个传输系统进行了改变和优化,对于LV的安全性的担忧始终存在。其主要原因就是潜在的插入突变。第一个使用γ-反转录病毒具有明确疗效的基因疗法是一种针对儿童X1型严重联合性免疫缺陷症的疗法。不幸的是,在治疗后,有几位病人因为基因治疗而患上白血病。反转录病毒生命周期中的基因组整合步骤是一种非靶向插入,因此存在整合进生产调节位点的可能性。已经确认了一系列前病毒可能插入的“热点”。已经测定γ-反转录病毒的插入大约有21%的可能性发生在“热点”,而这些位点集中于原癌基因和生长控制基因中。而LV被发现“热点”插入较少,大约为8%,并且除此之外,这些热点并不富集在影响原癌基因和生长控制基因的位点。LV转导进骨髓细胞和肝细胞的体内研究表明插入主要发生在活性基因中,并不集中发生于与生长有关的基因中。除此之外,LV感染后没有观察到克隆扩增,表明载体诱导的的肿瘤风险较低。这些工作直到目前都肯定了相较于改造过的γ-反转录病毒,重组基因的LV是一种更为安全的替代品。
现在开发的另一个处理插入突变潜在问题的方案是发展非整合慢病毒载体(NILV)。在这种载体中,整合酶基因中进行了点突变从而阻止了基因组整合;取而代之的是,含有转基因的质粒在细胞核内保持游离。已发现这个策略与整合载体相比转基因表达水平较低并且仅能短暂表达转基因。对这个技术作进一步发展,通过使用锌指核酶(ZFN)使得NILV DNA能在特异性的靶点进行同源重组,后者会在双链上产生缺口以启动同源定向的修复途径。这个方法可以对基因序列进行靶向修复,降低插入突变的风险。转录激活样效应因子核酶(TALEN)在功能上与ZFN相似,但是其DNA识别结构域的设计更为简单和灵活。最近公开了一项研究的报告,针对编码人体蛋白的基因构建了18740个TALEN。在临床前研究中,现已表明NILV在癌症免疫疗法中有效。它们可以被单独使用,诸如在一个研究中NILV作为癌症疫苗被使用,也可以和设计者核酶一起使用,已表明将其和ZFN一起使用在破坏内源性TCR基因同时表达肿瘤特异性的TCR以提高有效性和安全性。
利用CRISPR/Cas系统的基因组编辑是一项新近发展用来产生位点特异性双链缺口的方法,此系统使用RNA分子来识别切割位点并用一个Cas核酶来产生切口。一项使用LV和CRISPR系统进行位点指向性突变的在小鼠胚胎干细胞中进行的功能缺失筛查表明,这套组合能比RNAi更有效的抑制基因表达。一项由Gilbert等在2013年进行的使用LV和人体细胞的研究中,失活的Cas9和调节性蛋白融合并并能在RNA的引导下进行基因的定向抑制或失活。已发现CRISPR/Cas在转导后14天内能持续稳定的表达。
尽管前述技术很有前景而可以做进一步开发,仍需要克服一些问题。由于相同或同源DNA序列造成的脱靶突变是ZEN和TALEN系统的一个风险,也许其风险还高于CRISPR/Cas系统。认真的选择靶位点,控制CRISPR/Cas的剂量可以有益于减少风险,为了解决这一问题还开发了另外的选择,诸如将Cas9更换为切口酶。ZFN切口酶的开发已经得到解决。这些系统的效率已经得到优化,至于CRISPR/Cas,对于下游原间隔连接花式的要求限制了可以作为靶点的位点,而因此不依赖于原间隔连接花式的系统会有所裨益。这些系统在原代细胞中的效率是阻碍其被广泛应用的另一个障碍。最终这些系统的转运模式还在发展之中。这些转基因的大小是可插入片段大小有限的病毒转运载体的一个限制因素。LV是ZFN和CRISPR/Cas系统的一个切实可行的选择,但是已表明TALEN系统可能由于转基因运输后高度重复的TALEN序列具有发生重排的倾向而与LV无法兼容,因此对于转运技术的进一步发展至关重要。
细胞命运控制(又名“自杀”)元素为减缓细胞和基因疗法产品给药后可能发生的不良事件提供了途径。这个方法包括使用可以在为病人给药后选择性根除被转导细胞的转基因序列。这些系统经常是建立在一种酶的特异性突变形式的基础上的,将其转基因序列和治疗部分一起转导进细胞。这些经过改造的酶赋予细胞将无毒的前药转化为细胞毒化合物的能力,最终清除掉该靶细胞。
经典的单纯疱疹病毒胸苷激酶(HSV-TK)cDNA是一个被广泛使用的自杀系统,它可以将前药更昔洛韦(GCV)转化为具有细胞毒性的GCV-三磷酸。此系统被成功应用于临床实验中,但是已发现对于靶细胞的清除并非总是完全有效。这可能是由于GVC-TP的细胞毒性是细胞周期依赖性的,因此对非分裂细胞无影响。还有一种可能就是该通路的下一个酶(鸟苷酸激酶)的底物动力学很差和/或限速步骤有问题妨碍了对靶细胞完全清除。这种不完全的清除使病人承受了残留的不良效应。此外,GCV常被用于干细胞移植病人以预防和治疗巨细胞病毒感染,因此要从包含此安全性系统的删除方案中排除一些病人。
针对与HSV-TK有关的缺陷,本实验室发展了两种细胞命运控制系统。即所谓的TMPK和dCK细胞命运控制系统。两个系统都建立在对人体酶的极小修改基础上,预计对于病人仅有很低的抗原性。除此之外,它们所激活的前药的安全性和药代动力学状况都很好。经过改造的TMPK能激活前药叠氮胸苷成为具有细胞毒性的叠氮胸苷三磷酸,造成细胞凋亡。这是通过在表达TMPK突变体的细胞中线粒体内膜的电势差缺失以及半光天冬酶-3的激活造成。此外,我们最近还表明了TNPK突变体可以有效的和细胞表面标记在结构上融合,因此直接将载体滴度和次方法的清除功能联系在一起。本实验室发展的第二个系统是以人dCK为基础的。此酶是核酸合成补救通路的关键激酶。dCK的结构上设计了多个活性位点,使其可以激活多个临床上相关的前药,但是我们的工作主要集中在两个药上:BVdU和LdT。这个系统具有高度选择性,因为野生型dCK无法快速转化这些化合物。由于有多个前药可供选择,可以在根据病人个体设计的基础上选择效应分子化合物。
对免疫系统的控制还有细胞免疫的特异性,正在成为对抗癌症的重要策略。回顾这一治疗/研究领域的多变历史,最近正在发生认知和事实双重意义上的复兴。通常成功的治疗方案中包含两个方面:提供一个与肿瘤相关的靶点让免疫系统识别并且建立方法来激活或重新定向宿主免疫反应。在这里我们会总结为了启动和促进癌症免疫疗法,LV是如何被用来对癌细胞和免疫细胞进行基因工程改造的。
多种策略都被用来开发抗癌症疫苗。它们的目标在于刺激包括细胞毒性T淋巴细胞(CTL)在内的Th1反应,来选择性靶向并消除癌症。有一种细胞被专门用来促进抗癌疫苗疗法的细胞,那就是树突状细胞(DC)。DC是一种职业APC,它获取、处理并通过MHC I和II类分子向T细胞进行抗原递呈。在进行这些时,DC能诱导包括CTL在内的Th1反应。当受到炎症信号刺激时,DC快速成熟、处理和递呈抗原并迁移到次级淋巴器官中以诱导免疫反应。一些披露的研究中,疫苗的制备包括从病人身上获得DC,然后在体外让这些DC携带肿瘤相关抗原(TAA)。经过操作的细胞被会回给病人。这些荷载了的DC能向T细胞递呈经过处理的TAA,因而诱导针对表达TAA的细胞的Th1反应(见图1D)。实际上,目前为止仅有一个被FDA批准的由细胞介导的免疫疗法就是一个DC癌症疫苗,Sipuleucel-T。Sipuleucel-T疗法通过向病人的DC导入前列腺酸性磷酸酶(一种前列腺癌TAA)肽和GM-CSF来发挥作用。GM-CSF是一种刺激巨噬细胞产生和DC浸润的炎症性细胞因子。这一组合成功的诱导了免疫反应,表现出中位数为4个月的生命延长。
但是荷载了肽的DC疫苗疗法面临几个障碍。只能在在MHC上进行短暂的外源性肿瘤抗原递呈,这妨碍了长期的免疫效果。除此之外,反应是MHC单倍型依赖的,因此每个病人需要个体化定制产品。还有就是选择用于MHC复合物的荷载肽比较困难,在这个领域需要做进一步研究以优化方法。有一种可以越过多个障碍的方法就是用带有完整的TAA cDNA的病毒载体转到DC。现已证明该方法可以提供更为稳定的肿瘤蛋白表达,使得DC可以在很长一段时间内处理并以更为自然的方式向免疫系统递呈抗原。
如前所述,DC通过MHC和T细胞的TCR之间的作用来向T细胞展示经过处理的抗原肽而完成递呈。但是,此信号可能还不足以诱导T细胞反应。相反的,现已表明仅有此相互作用会导致T细胞无能化并死亡。在此相互作用的基础上,需要在激活条件下的免疫突触中更多的共刺激信号来诱导并优化细胞毒T细胞反应。细胞因子则作为刺激和极化T细胞反应的第三信号。现已使用LV来对DC进行基因工程改造以使其表达利于激活和/或释放特异性细胞因子以极化T细胞。还有研究表明可以使用LV来沉默以PD-L1为代表的表达于DC的T细胞抑制性共刺激结构域,可以加速抗肿瘤免疫反应。此外,对能释放可溶性PD-1或可溶性PD-L1对免疫突触进行干扰的DC进行改造可以使一种激活性的共刺激结构域——CD80表达上调,并且显著促进细胞因子中TNF-α和IL-10的组成。还有研究表明阻断T细胞抑制性共刺激结构域的PD-1抑制剂还能加速激活的DC中的抗肿瘤免疫反应。另一个策略是利用LV调整胞内通路。利用LV基因工程组成型表达p38 MAPK通路中德活性蛋白成功的加强了抗肿瘤T细胞反应并延长了肿瘤小鼠的生存时间。该研究中作者表明p38的激活导致CD80、CD40和ICAM-I的上调,协助了DC诱导抗肿瘤的T细胞反应。这些是一些被开发用来加强DC疫苗抗肿瘤活性的策略。
病毒载体还能将来自病毒蛋白的共刺激信号导入细胞。这些共刺激信号可以帮助诱导免疫反应。例如本组的研究已表明与由腺病毒转导的DC相比,由LV转导的DC能引发不同的免疫反应,虽然两者都通过基因工程表达了抗原HER-2。已表明由腺病毒转导的DC刺激产生了CD4
+
和CD8
+
T细胞反应,以及更为耐用的体液反应。相反的,LV转导的DC诱导以CD4+T细胞为主的反应,伴随着更高浓度的IFN-γ分泌以及较低的体液免疫。这表明了病毒载体的选择也对DC疫苗诱导的反应具有影响。因此,重要的不仅是选择一个可用的TAA,还需要考虑针对每一个特异性的案例选择最佳的运送载体。
LV的独具特性使之成为一个具有吸引力的用于DC细胞转导的病毒载体系统。如前所述,它们能在分裂细胞和非分裂细胞中提供稳定的转基因表达并且基因毒性发生率较低。现已表明,并非依赖于假病毒的包膜而是依赖于进入细胞,LV转导激活了DC释放1型干扰素并干预了针对所携带抗原的免疫原性。进一步研究表明此效应的机制是TLR依赖性的。已经在临床前小鼠模型中检测了用LV转导多种TAA的DC激发免疫反应的能力。某些TAA能诱导出较为持久的免疫反应,其中包括黑色素瘤抗原mTRP-2和MART-1,对包括Sca-2、GP38和细胞RABP1在内的多种肝癌TAA进行研究。TAA erbB2和PSCA被用来作为针对前列腺癌的靶标。所有这些由LV转导的TAA都能帮助指导DC诱导出特异性的免疫反应,从而产生显著的肿瘤抑制。
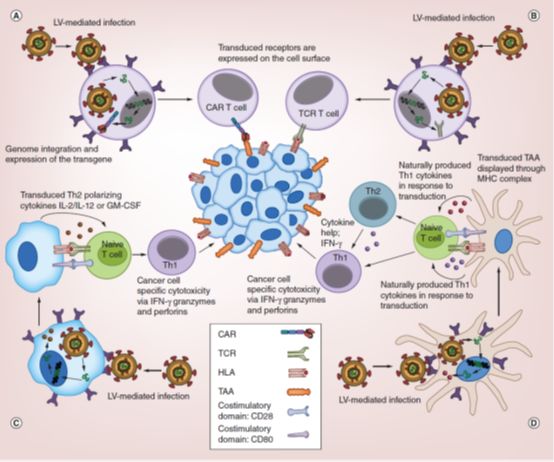
图1、肿瘤免疫疗法中慢病毒载体的应用
CAR:嵌合抗原受体;LV:慢病毒载体;TAA:肿瘤相关抗原;TCR:T细胞受体
尽管这类治疗提供了潜在的收益,但是DC疫苗仍然有障碍需要克服。以DC为基础的疫苗通常是自体来源的:在治疗前需要从病人个体中获取DC。但是,外周血中的DC数量有限。针对这一障碍的一个解决方法CD14
+
的单核DC前体细胞和CD34
+
的血或骨髓DC前体细胞,然后通过加入细胞因子和生长因子将其分为成熟DC。自从开发了这种方案,许多实验室已经成功的用LV向CD14
+
和CD34
+
来源的DC中进行了转导并产生了很高的转基因表达。另外一个探索中的策略是使用由人诱导多能干细胞(iPSC)和胚胎干细胞诱导而生的DC。通过LV转导的
OCT3/4
、
SOX2
、
c-MYC
和
Klf4
对取自供体的真皮成纤维细胞的人iPSC进行改造。然后这些多能和自我更新的iPSC分化成具有所需表达谱、形态学以及细胞因子分泌的功能性DC,使其具有诱导抗原特异性T细胞反应的能力。这些DC的功能性来源使得供临床使用的大规模生产成为可能并能帮助规避不同病人之间的差异和复原等现有问题。
此治疗模式所面临的其他挑战还包括体外制备疫苗的可用时间窗口有限。动力学研究表明携带抗原的DC寿命很短,这使得很难有效达成处理、抗原摄取和成熟。通过使用LV向DC转导
c-FLIPS
、
c-FLIPL
、
Bcl-XL
和
M11L
的cDNA已经成功延长了DC的生存时间。这些基因编码关于生存的因子,作用于内源性和外源性的凋亡通路。使用LV的优点在于会有助于提高DC疫苗的收益并产生更为持久的免疫反应而进一步延长患者的生存。
体外免疫接种研究的成功鼓舞了对直接接种携带编码TAA cDNA的LV进行评价。对小鼠皮下注射LV导致对皮肤来源的DC进行直接转导。这些DC随后被运送到淋巴结以诱导T细胞反应并提供长期的抗肿瘤免疫。现已表明对小鼠的肌肉内和腹腔内注射可以导致有效的免疫反应。直接接种LV这一策略与前述体外转导相比在概念上而言有更大的致突变风险,但是可以规避掉DC疫苗在运输上的限制,包括针对每个病人都进行细胞的分离和扩增。对于直接注射LV进行肿瘤免疫接种的策略还需要进行更多的研究以评价其疗效和安全性。
人造APC(aAPC)是另一种可以利用LV作为转基因载体的癌症免疫疗法形式。这些aAPC是用来加强T细胞的体外扩增的。aAPC通常通过细胞或磁珠表面表达的共刺激结构域和TAA来发挥作用。可以利用LV向白血病细胞转导共刺激分子或细胞因子而将其转变为aAPC。由于白血病细胞表面已经存在多种TAA,可以设计具有特异性分子的aAPC以便于优化T细胞激活和扩增。
通过利用LV转导CD80和/或4-1BBL将白血病细胞系K562转化为aAPC。这些aAPC能支持T细胞在不需要外源性细胞因子的条件下体外生长和长期扩增。在激活的APC、B细胞和单核细胞表面都发现了CD80,它为T细胞提供了一种共刺激信号,促进其激活和生存。4-1BBL则见于DC表面,是促进T细胞增殖、分泌细胞因子和细胞毒能力的共刺激结构域。作者进一步表明其K562来源的CD80
+
4-1BBL
+
aAPC能在体外将T细胞扩增约10000倍,其中包括基因改造过的T细胞。此法超过了其他体外扩增方法,诸如通过磁珠和其他aAPC,10倍以上。此法有助于克服自体T细胞疗法所面临的最大问题:靶效应细胞的体外扩增受限。值得注意的是,该方法还造成T细胞的多克隆扩增,这对于希望效应细胞的功能和特异性保持平衡的过继免疫疗法很重要。
由于最近在临床上取得的一系列成功,过继传输经过基因工程的T细胞已经被推到癌症免疫疗法的前沿。T细胞疗法一个超过其他免疫疗法的优点在于其能归巢到肿瘤位点的能力。一旦它们抵达肿瘤位点并受到TAA的特异性刺激,就能增殖、存活并攻击肿瘤。自体T细胞疗法包括从病人身上获取T细胞并选取在抗原选择上具有良好亲和力的高度抗原特异性的T细胞。然后这些细胞被激活、扩增并回输给病人。尽管有记录表明达成了目的临床反应,这类疗法仍然面临着包括自然产生的抗原特异性T细胞的相对缺乏,T细胞突破耐受的能力不足以及将这些T细胞扩增至足够数量。现已采用转基因改造的T细胞来解决这些问题。T细胞经过改造以提高其识别、增殖以及杀伤特异肿瘤细胞的能力。此章节会涉及使用重组LV为载体进行基因改造的T细胞,其中包含的基因有异源性的TCR和嵌合抗原受体(CAR)。















