摘要
溶出度测定在目前仿制药研究领域中具有重要作用,溶出数据的可靠性与溶出方法的耐用性息息相关。本文对溶出方法的耐用性进行阐述,表明影响溶出方法耐用性的因素。
溶出是唯一的能监测体外药物释放的速率和程度的批次释放测试,并且该测试通常用作确保替代物体内性能一致已被广泛接受。溶出度测试已经从作为最终产品常规和简单测试演变为开发人员可以在产品生命周期的各个阶段都起作用的重要工具,目前有溶出方法普遍认为有三种:QC溶出方法、生物相关溶出方法、临床相关溶出方法。
QC溶出方法的目的是检测常规产品制造期间的变化和/或产品存储期间可能对产品性能产生负面影响的变化。生物相关溶出方法的目的是尝试模拟药物在胃肠道内将经历的不同生理环境,其总体目标是指导制剂选择和优化,但这并不一定能推断该方法可以预测临床结果。临床相关溶出方法是通过将任何特定方法获得的体外溶出数据与体内PK性能数据相关联,建立临床相关的溶出方法,产生体外体内相关性或关系(IVIVC或IVIVR)。目前在仿制药开发过程中溶出方法都希望是后续两个方法,但实际上在没有体内数据和生物相关介质高昂成本下还是QC溶出方法居多。下文中讨论的主要是QC溶出方法。
开发QC溶出度测试的重点是获得可接受的可变性同时在一定程度上实现对工艺参数变化的一些区分。如果批次的药品在选定的溶出实验中显示“相同”,它们将产生与临床研究中使用的批次相似的体内性能,从而保持与安全性和有效性的联系。例如,QC溶出方法应该能够识别制粒不够或过度制粒,硬度不够或硬度过大的产品,或者其中API的关键属性发生有重大变化的产品(例如,颗粒形态)或者关键赋形剂,例如表面活性剂,制粒助剂,崩解剂,润滑剂发生变化的产品。在这个目的下,溶出度方法应该具有一定的区分性。而区分性不应有溶出自身方法耐用性不良造成数据波动引起。因此溶出方法本身应具良好的耐用性。
二、耐用性
按照ICHQ2,分析方法的耐用性是指在实验参数被故意的发生细小改变时,检测不受影响的能力,用于说明正常使用时的柔韧性。
溶出度实验是性能实验和检测方法的综合,是指由溶出装置,溶出介质和测试条件,共同组成一个方法,这个方法能够反应产品的关键属性变化,同时能够运用于日常操作,并且能够进行实验室之间的转移。理想的溶出方法不会有不可接受的变异性,并且能够将不会贡献一个不可接受的程度的变异。因此溶出度实验的耐用性包括检测方法耐用性和溶出性能实验的耐用性。
三、检测方法耐用性
中国药典2020年版《9101分析方法验证指导原则》征求意见稿中含量测定及溶出量测定需要进行耐用性检测。
ICHQ2中耐用性取决于研究条件下分析方法的类型,对于方法参数的有意变动,分析方法应显示可靠性。耐用性评价的一个结果是建立一系列系统适用性参数来确保分析方法不管在什么用都是有效的。
溶出检测分析方法目前较为主流的是紫外分光光度法和高效液相色谱法。两者各有利弊,耐用性所做项目不同。对于紫外分光光度法来说,主要耐用性考察不同检测波长(±2nm)。
高效液相色谱法分析参数包括流动相成分(有机相的百分比、缓冲液浓度、pH)、流速、波长、柱温、同一类型的多根色谱柱等。
耐用性实验除了在标准介质中需要进行,在其他介质中同样需要进行验证。笔者有做过一个项目,不同介质间由于pH差异对API性质有比较大的影响,标准介质中无异常现象,在其他介质中则验证通不过,后发现其他介质样品需要调节至标准介质pH值才解决问题。
四、溶出实验的耐用性
溶出性能实验包括溶出装置、溶出介质和测试条件,因此影响耐用性也包括这些方面,且溶出性能测试耐用性需要在初始溶出度方法开发阶段就需要考察。
溶出装置根据剂型和各国药典有不同类型,常用的为桨法、篮法、流通池法。根据不同方法耐用性有所不同。
对笔者而言,溶出性能实验耐用性更像溶出方法的筛选、确认过程。正如上文所说,溶出性能实验包括溶出装置(主要讨论第一法和第二法)、溶出介质和测试条件,耐用性实验也围绕这些展开。
1、仪器装置
在目前的法规条件下,溶出仪装置都需要做机械校正。因此溶出方法应在不同的溶出仪之间无明显差异。按照2016年第120号通告附件《化学药品仿制药口服固体制剂质量和疗效一致性评价申报资料要求(试行)》规定:在耐用性实验中,应考察溶出曲线测定方法在不同溶出仪器上的差异。列表表示同一批样品在不同溶出仪上的溶出数据,并比较溶出曲线的差异。示例如下:
表xx:
耐用性结果
在该申报资料中需比较溶出度各个时间点的差异,但未规定差异多大符合要求,笔者认为各个时间点的差异不应大于10。
在比较不同溶出仪差异时,如果实验室有手动取样和自动取样溶出仪,那么手动取样和自动取样之间的差异需要重点关注,自动取样由于管路材质、泵系统(柱塞还是蠕动,柱体及活塞的材质)、阀切换系统等的复杂性使过程中出现异常概率较大,由于其装置的复杂性与手动取样有所差异,需要进行考察。
某些样品如果对金属离子比较敏感,如苯磺酸氨氯地平在盐酸介质中不锈钢桨会使其降解,则对溶出的杆/桨需要有特殊的要求,如采用特氟龙涂层,在方法前期摸索和确认过程中需要对异常数据关注,后期在整个研发和生产过程中都需特别说明。
2、溶出介质
溶出介质是溶出性能实验的核心部分,溶出方法的筛选、耐用性实验大部分集中在此。溶出介质包括试剂来源、pH、介质摩尔浓度、表面活性剂浓度、介质脱气与否等。
2.1、试剂来源
试剂中影响较大的可能为水,不同来源的水可能会对溶出数据有不同的影响。在其他试剂中,常用的缓冲盐影响不大,影响较大可能为表面活性剂来源。不同来源的表面活性剂纯度、杂质、增溶能力不同,甚至于同一厂家的不同批号之间也有差异,因此实验结果也会不同。笔者就此有过教训,在筛选吐温80时,国产吐温与进口吐温无差异,使用国产吐温一段时间后发现不同批号差异很大,最后浪费了较长时间。因此在确认表面活性剂时需要考察不同厂家、不同批号之间的差异。
2.2、pH
pH对于某些药物的溶出影响非常大,特别是pH溶解依赖型药物。在药事纵横公众号中Herman翻译过一篇文章《看明白新药如何开发溶出方法,才能做好仿制药》详细阐述了pH耐用性的重要性。在此笔者不展开分析,只截取一段表明pH耐用性的重要性:当pH增加0.2时,每个点的溶出约降低10%。pH的微小改变导致溶出较大的改变,表明依赖于的溶出方法耐用性不佳。在介质pH(pH4.0)确定后,同样进行了pH耐用性考察,见下表:
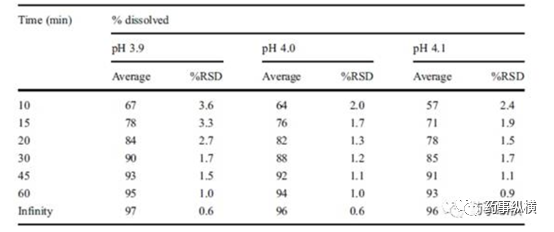
从上文可以看出,介质pH的选择对溶出影响较大,特别是pH-依耐性溶解的药物,在pH选择上更要慎重。
2.3、介质摩尔浓度
不同的离子浓度对某些药物的溶出释放有显著作用。研如玉公众号有篇《评估溶出介质的组成和离子强度对商业化生产的阿司匹林速释制剂和肠溶片释放的影响》详细介绍了离子种类和浓度的影响。值得注意的是日本药典和我国目前使用的pH6.8介质离子浓度有差异。对笔者而言,介质摩尔离子浓度不会太关注,如果一开始使用的就是该浓度,在整个研究过程一致即可。
2.4、表面活性剂浓度
表面活性剂种类和浓度都需要进行筛选。同样是《看明白新药如何开发溶出方法,才能做好仿制药》中提到了:在不同pH介质中加入SLS,会导致达沙替尼相变,最终形成一种粘性的非晶相。这说明SLS不合适。筛选其他几个非离子型表面活性剂包括泊洛沙姆、溴化十六烷基三甲基铵、TritonX-100。最终选择TritonX-100,因为其使用方便,易于获得。因此表面活性种类需要进行筛选。而在确认使用TritonX-100后,其浓度耐用性同样进行验证:体积比分别为0.5%、0.75、1.25%。图7表明使用0.75、1.25%,与1%的溶出曲线的相比,计算f2因子,分别为72、68,表明在±0.25%范围内,耐用性良好。表面活性剂±2.5mL/L是可以接受的。
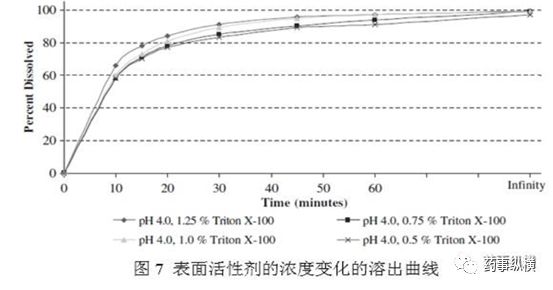
通过上述案例可以看出,对于使用表面活性剂的溶出性能方法,表面活性剂的种类、厂家、批号、浓度等都属于耐用性影响因素范畴。表面活性剂的浓度需根据溶解度数据和溶出数据确认。对笔者而言,表面活性剂浓度耐用性会控制在±5%的波动。
2.5.介质脱气
介质中气体在某些情况下对药物溶出影响较大,特别是篮法或者某些缓释药物。目前,《中国药典》对溶出实验中所使用的溶出介质已明确提出了脱气的要求。但如果研发过程中由于脱气机普及性可证明脱气与不脱气区别,没有影响的可不脱气。
3、测试条件
测试条件包括转速、温度、取样时间等。目前对溶出仪的机械校准有转速(±4%)、温度(37℃±0.5℃)的要求。因此对于已确定溶出方法的转速耐用性则不需要进行。温度在常规操作条件下也不需要进行耐用性考察,但是余力老师在一次同写意培训课上讲过某个产品复核时37℃数据在边缘区,厂家过来将温度调节至37.5℃数据符合要求。因此个人认为如果遇到这种对温度波动异常敏感的除了在每次实验前对每个溶出杯的杯温测试外,还应对溶出方法进行一定的耐用性考察和优化。
















