

虹膜角膜内皮综合征(iridocorneal endothelial syndrome,ICE综合征)是一组疾病的总称,具有慢性、进行性的特点,晚期可以虹膜粘连导致继发性青光眼,造成患者严重的视功能损害。因此,眼科医生一直致力于寻找最佳的治疗方案。
温州医科大学附属眼视光医院和青光眼研究所的梁远波教授在该方面颇有研究,在“中国医疗保健国际交流促进会眼科学分会第二届眼科学术年会暨国际眼科论坛、2018年福建新桥人才联谊会、福建省第十七次眼科学术会议暨眼科新进展学习班”,三会一体的盛会上,梁教授发表了《ICE综合征继发青光眼治疗方案的新探索》的讲题,分享了其研发的并获得美国专利的穿透性粘小管成形术,为我们带来了ICE综合征诊疗方面的新启示。
疾病简介与起源
ICE综合征是一组累及虹膜、角膜、前房角的致盲性疾病,临床上分为原发性进行性虹膜萎缩(PIA)、Chandler综合征、Cogan-Reese综合征。多单眼发病,极少数为双眼。是表现为角膜内皮异常、进行性虹膜基质萎缩、周边虹膜前粘连、房角关闭及继发性青光眼的一组疾病。

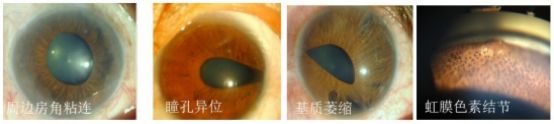
人们对ICE综合征的认识经历了一个漫长的过程。1903年, Harms 首次报道单侧青光眼合并虹膜萎缩和虹膜裂孔——进行性虹膜萎缩。1956年,Chandler报道一组病例,与进行性虹膜萎缩相似,以角膜内皮营养不良和角膜水肿为主要特征,虹膜萎缩轻,无虹膜裂孔,伴瞳孔移位,无或轻度眼压升高,命名为“Chandler综合征”。1969年,Cogan和Reese报道一组病例,与进行性虹膜萎缩及Chandler综合征相似,所不同的是在虹膜表面发现许多色素性结节,与虹膜有蒂相连;房角处有内皮细胞膜的异常基底膜组织,“Cogan-Reese综合征”由此而来。1979年,M.Yanoff统一命名为“ICE综合征”。

ICE细胞
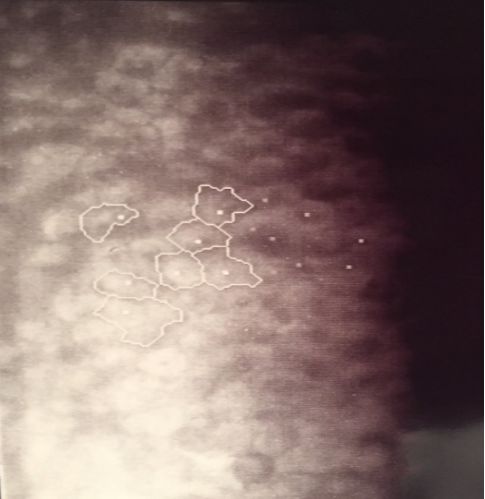
随着疾病的研究进展,发现角膜内皮缺陷是本病的基本病变。1985年,E.S.Sherrard观察到角膜形态学特征并将之命名为“ICE细胞”,其的特点是:①失去六边形结构;②内皮形态拉长,出现细胞内暗区-亮带相间的细胞结构
1
。
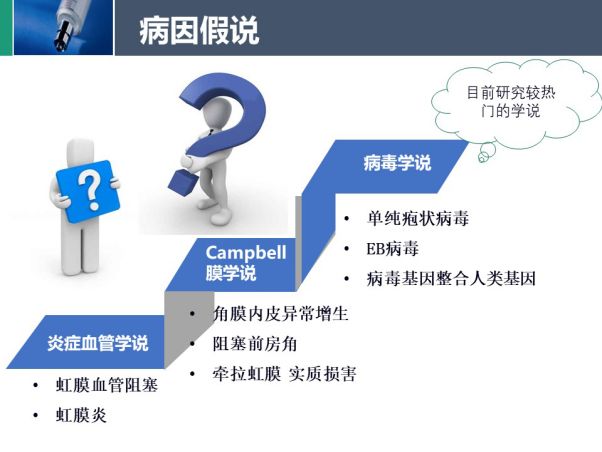
病因假说
目前ICE综合征的发病原因有争议,比较主流的几个学说包括
2,3,4
:
炎症血管学说
:角膜内皮细胞的修复活动,炎性增殖。过去的很多研究在ICE患者发现了虹膜炎、房角的炎症。Alvarado 团队于1994年首次提出病毒感染和ICE相关。
病毒学说:
病毒感染造成角膜内皮的损伤,角膜内皮的异常增殖。
Campbell学说:1978年,Campbell对82眼ICE行组织病理学检查,提出了膜学说,指出其基本病变始于角膜内皮异常,表现为角膜水肿,并发现在房角及虹膜表面有一单层内皮细胞及类后弹力层组织组成的膜,越过开放的虹膜角膜角,向虹膜面延续。房角细胞增生膜,覆盖小梁网,周边虹膜前粘连进而形成继发性青光眼。虹膜表面细胞膜收缩进而引起周边虹膜前粘连,瞳孔移位,色素膜外翻。
现在研究较多的假说为病毒学说,病例报告中报道过单纯疱状病毒感染和EB病毒感染,抗体形成, 多单侧发病,病毒基因整合到人类基因进行表达。
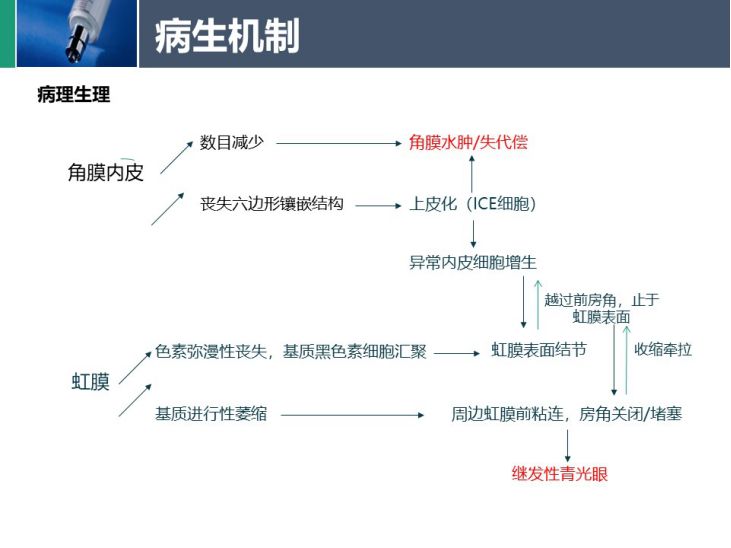
病理生理
三种不同类型ICE综合征共同的潜在机制是角膜内皮的异常,即上皮化,形成ICE细胞。显微镜检查发现,角膜内皮细胞的数量减少、呈现出多形性,并伴有明暗反转(细胞边界较亮、细胞表面较暗)。这些异常的内皮细胞还获得上皮细胞的特征,例如桥粒、胞质内细丝和微绒毛的存在。异常的内皮细胞可以作为膜在相邻结构上迁移,包括虹膜和小梁网,越过前房角,止于虹膜表面,还可形成虹膜表面结节。而且,异常的内皮细胞还被证明可以分泌异常的基底膜、类似于Descemet膜。这种膜的收缩导致相关的虹膜变化、虹膜粘连和房角关闭等,导致继发性青光眼。
流行病学
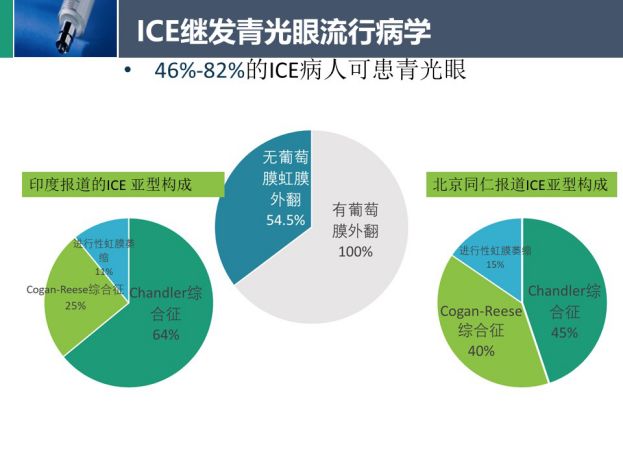
ICE导致房角关闭和眼压升高,约46%~82%的ICE患者可患青光眼,以闭角性青光眼多见
6
。塞尔维亚的一项研究
7
,报道了有葡萄膜外翻和没有葡萄膜外翻的ICE患者的继发青光眼患病率,分别为100%和54.5%。Chandran等人对203名印度ICE患者进行回顾性研究
8
发现继发青光眼患病率为73%,其中54%的虹膜进行性萎缩(PIA)、47%的Cogan Reese综合征和45%的Chandler综合征患者需要进一步手术治疗。Bo Feng等人在中国北京的研究
9
中,调查了58个ICE患者,发现继发性青光眼患病率达到98%,其中包括Chandler综合征(44.9%),Cogan-Reese综合征(39.7%)和PIA(15.5%)。
印度的研究表明PIA导致的难治性青光眼比CS和CRS更多,治疗也更困难。而在中国发病率更高的为Chandler综合征。
治疗方法
目前ICE的治疗方法主要包括药物治疗、手术控制眼压和角膜移植三个方面。药物治疗包括控制眼压(偏向应用抑制房水生成的药物,包括α受体激动剂、β受体抑制剂、碳酸酐酶抑制剂等,通常与缩瞳剂联用);缓解角膜水肿和维持角膜透明度(如高渗剂:高渗盐水、甘油、甘露醇等,配戴角膜软镜并配合抗炎治疗);抗病毒治疗。手术控制眼压的方法包括小梁切除术、引流阀植入术、睫状体光凝术。角膜移植包括全角膜移植、内皮角膜移植等。
小梁切除术联合抗代谢物对于Chandler综合征治疗效果最好,对Cogan-Reese综合征手术效果尚可,进行性虹膜萎缩最差。引流植入术相对于小梁切除联合抗代谢治疗在近期的成功率较低,在长期的成功率较高。
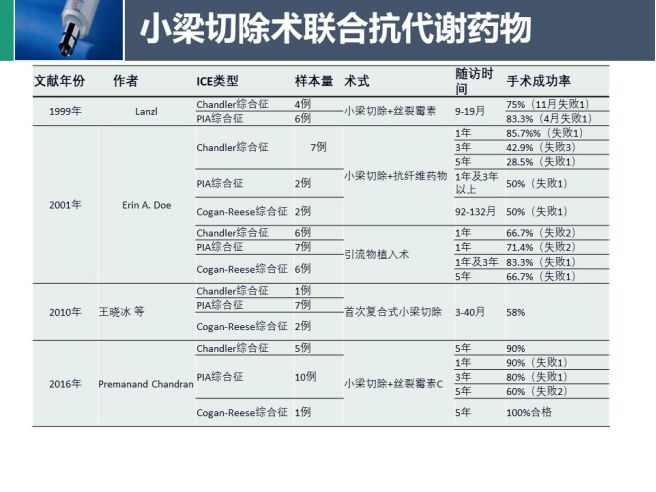
如同其他继发性青光眼手术一样,ICE综合征患者手术控制眼压也会存在手术失败的情况。对于滤过手术,其失败有关的因素有:内皮细胞持续增长阻塞滤过部位、结膜下和巩膜滤过通道纤维瘢痕化情况、ICE患者年龄(相对年轻)。与引流装置植入术失败有关的因素包括ICE膜情况和角膜失代偿情况;手术失败后如需要重新置管,建议:①延长管道,使管道固定在巩膜上 ②植入更深眼内,远离角膜内皮和虹膜。
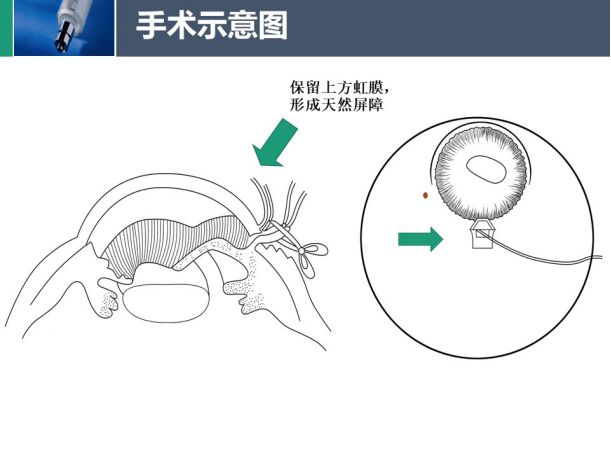
那么,是否存在一种较好的治疗办法呢?穿透性粘小管成形术是一种可以在保留虹膜角膜粘连的情况下非滤过泡依赖的手术方式,术后Schlemm管引流不发生瘢痕问题。但该方法是否提高了手术的成功率尚需要进一步研究。
男性,43岁,因“左眼虹视5年,视物不清4月”就诊。
现病史
:患者5年前因“左眼虹膜角膜内皮综合征”行左眼睫状体光凝术等治疗。4月前无明显诱因出现左眼明显视物不清,自行使用降压药后未见好转。
既往史
:否认高血压、糖尿病病史,否认药物过敏史,否认传染病史。
眼科检查
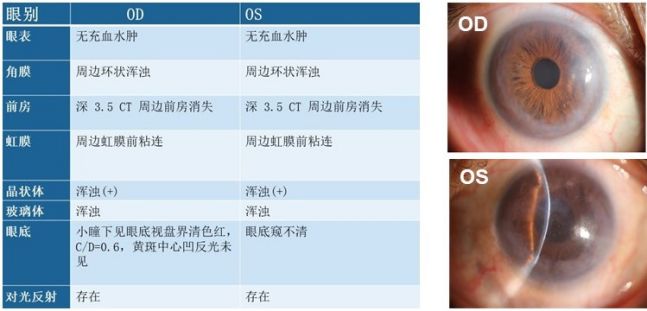
:VA:OD 1.0、OS HM/30cm,BCVA:OD 1.0、OS HM/30cm。NCT:OD 6.5 mmHg、OS: 31.8 mmHg。
辅助检查:
角膜内皮镜
:OD 2403个/mm²、密度下降,OS 角膜严重水肿、无法检查。角膜内皮细胞形态异常,失去六边形结构。
UBM
:前房深度:OD 2.13mm,OS 因角膜严重水肿未测。双眼房角结构异常。
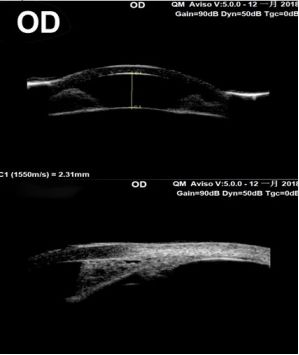
前节OCT
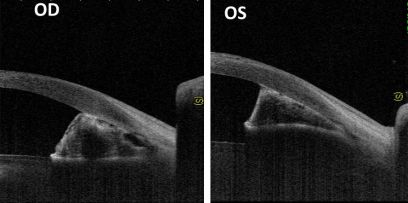
眼底检查
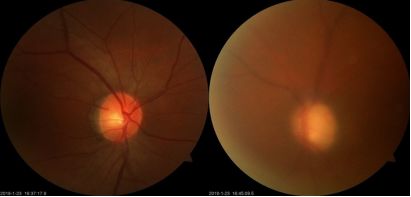
视野检查
:
右眼MD:0.7dB VFI:100%
左眼MD:-31.26dB,VFI:2%。
初步诊断
:双眼虹膜角膜内皮综合征、双眼年龄相关性白内障
治疗经过
:左眼穿透性Schlemm氏管扩张成形术、术中未使用抗纤维化药物
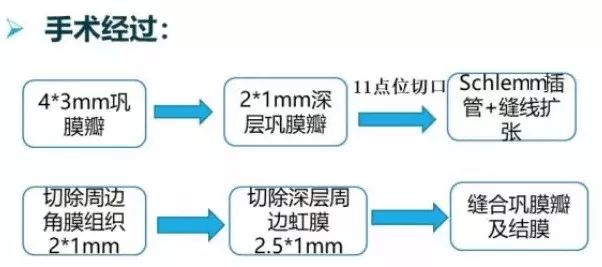
术后情况
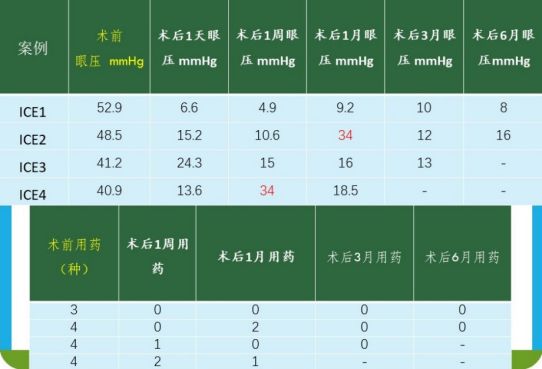
目前梁教授已成功为4例ICE综合征患者实施了穿透性粘小管成形术,并在征集ICE综合征病例。
4例 ICE综合征继发性青光眼中的治疗效果
穿透性粘小管成形术
:已获得美国发明专利授权
梁教授认为,穿透性粘小管成形术可能是治疗ICE综合征的一种有效的内引流手术方法。它不扰动已经发生虹膜前粘连的虹膜而进行虹膜后基质切除,既可沟通后房与巩膜池,又形成了天然屏障,可能阻碍异常增殖的内皮细胞堵塞滤过通道的内口。
参考文献
1.Gracner T, Trpin S, Sarenac T, Pahor D. [Diagnostic methods in the clinical evaluation of iridocorneal endothelial syndrome]. Ophthalmologe 2016;113:1074-1077.
2.Archives of Ophthalmology, 1994, 112(12):1601.
3.The Iridocorneal Endothelial Syndrome, Survey of Ophthalmology (2018), doi: 10.1016/j.survophthal.2018.01.001
4.Li F, Liu Y, Sun Y, et al. Medical Hypotheses, 2018, 110:50-52.
5.Denis P. [Iridocorneal endothelial syndrome and glaucoma][J]. Journal Francais Dophtalmologie, 2007, 30(2):189.
6.H. C. Laganowski, M. G. K. Muir, and R. A. Hitchings, “Glaucoma and the iridocorneal endothelial syndrome.














