今天是2017年8月8日
农历六月十七
医麦客:点亮遗传性失明患者的世界
http://v.qq.com/x/page/e0535m70po5.html
基因治疗RPE65突变IRD
视频来源 vimeo.com
2017年8月8日/医麦客 eMedClub/--
近日,Spark Therapeutic公司已向欧洲药监局(EMA)提交使用LUXTURNA(voretigene neparvovec)治疗双等位基因RPE65突变导致的遗传性视网膜病变(IRD)视力丧失的营销授权申请(MAA)。
此项申请是第一个向EMA提出的首款针对眼科遗传病的基因疗法。
而且就在上个月,
美国FDA已经接受了LUXTURNA(voretigene neparvovec)基因疗法的生物制剂许可(BLA)申请,并授予它优先审评资格。如果这一疗法获批,它将是首个用于IRD的药物治疗,同时也是美国首个用于遗传病的基因治疗。

Spark Therapeutic(图片来源 ois.net)
此次的营销授权申请(MAA)
基于
4
1名具有RPE65突变导致的遗传性视网膜病变(IRD)的患者的三个临床试验的数据,其中包括用于遗传疾病的基因治疗的第一个随机对照的III期临床试验。
这项III期临床试验的具体结果发表在了著名期刊《The Lancet》上。试验共招募了31位双等位基因RPE65突变导致的IRD患者,
其中21位在治疗组,10位在对照组,主要研究终点是比较两组在1年间的多亮度移动性测试(MLMT)分数变化,
以评估在特定光线下的视力功能。
研究结果显示,
治疗组和对照组患者在1年间的MLMT分数变化具有明显统计学差异,其中治疗组为1.8,对照组为0.2
(差异为1.6,95% CI 0.72-2.41;p=0.0013)。
65%的治疗组患者通过了最低亮度等级的MLMT测试,表明这组患者取得了显著的治疗进展,但对照组并无患者通过该测试。
除此之外,治疗组的患者在两个次要终点中也与对照组存在显著差异,包括全场光敏阈值(FST)测试(p=0.0004)和第一次注射眼睛的移动性测试分数变化(p=0.001)。并且,值得注意的是,
试验中未发生严重不良事件以及严重免疫事件。
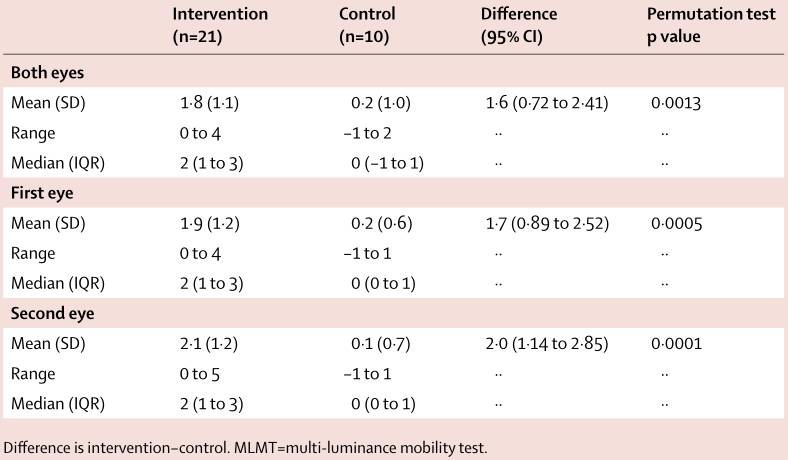
治疗组和对照组患者在1年间的MLMT分数变化(图片来源 The Lancet)
而一旦EMA验证了这些申请材料,审查期就将开始。而
LUXTURNA(varetigene neparvovec)已经获得了FDA颁发的突破性疗法认定,以及FDA和欧洲药物管理局(EMA)颁发的孤儿药资格。FDA也将在2018年1月12日对LUXTURNA的生物制剂上市许可予以裁定,咨询委员会预计将召开会议讨论这款基因疗法的风险与获益。
IRD(遗传性视网膜疾病)是一种由220多种不同基因之一就可引起的一系列罕见致盲病症。双等位基因RPE65突变的IRD患者会由于儿童期或早期成年期的光敏感性降低以及不自主的前后眼球震颤运动,经常会出现夜盲症。随着疾病的进展,
患者的视网膜感光细胞(色素细胞)会逐渐失去功能并坏死,最终导致视觉功能的完全丧失。而且目前并没有针对该疾病获批的药物可供患者选择。





