(图片来源:参考文献[2])
因此,人们需要开发相应的的策略对抗体进一步优化,以减少这种“on-target, off-tissue”的现象。而近年发展起来的Probody技术[2],则有望满足这样的需求。该技术的专利归属于CytomX,一家坐落在南旧金山的生物技术公司,他们所专注的方向就是利用肿瘤部位的微环境来提高抗体药物对肿瘤部位的选择性。

(图片来源:CytomX公司官网)
Probody技术的核心思想其实是“prodrug”(“前药”),即一类在初始状态下不发挥功能,只有经过机体代谢转化为活性形式或到达特定部位才能发挥治疗作用的药物。“prodrug”的概念已经经过多年发展和广泛落实,比如可待因在经过细胞色素P450家族的CYP2D6的作用下转化为具有阵痛、止咳效果的吗啡;或者如ADC(antibody-drug conjugate)药物,当linker断裂之后,小分子从溶酶体泡中被释放出来发挥细胞毒作用。Probody技术可以说是这一概念的又一次运用。
CytomX将应用Probody技术的抗体药物称为Probody therapeutic,其构造如下图:
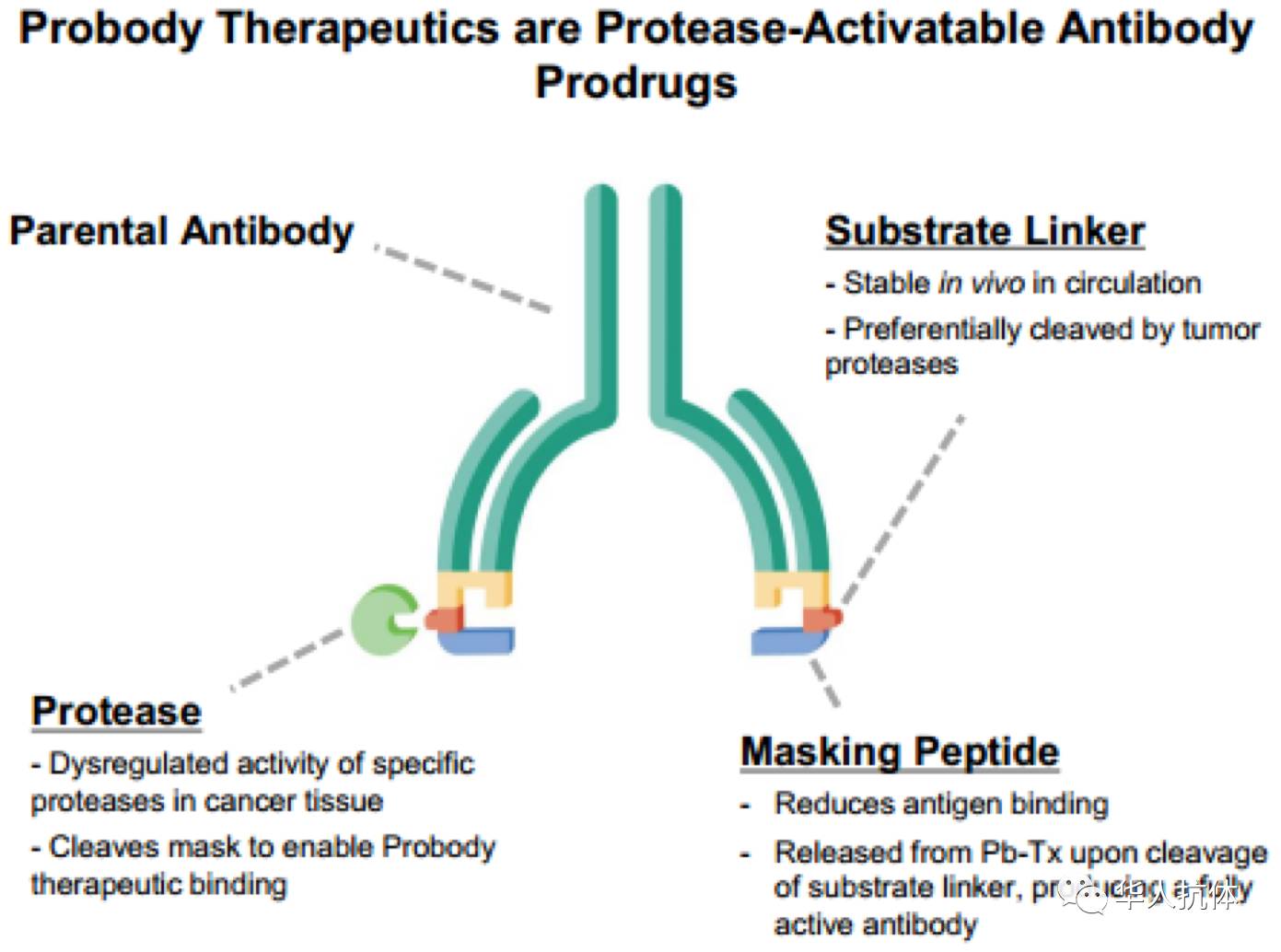
(图片来源:CytomX公司官网)
这一类抗体药物是在原有的普通抗体分子的基础上,在轻链的N末端再融合表达一个masking peptide、一个柔性的linker和一个蛋白酶底物序列。表达出来的抗体其抗原结合区域被masking peptide遮蔽,无法识别和结合抗原;只有当抗体进入特定的蛋白酶高表达的环境时,蛋白酶特异性切割底物序列导致masking peptide被移除,暴露抗体的结合位点,抗体才能发挥正常的功能。而底物序列所对应的蛋白酶是在特定的肿瘤部位高表达,因此这一策略有助于抗体更加特异性地结合肿瘤细胞表面的靶点蛋白。
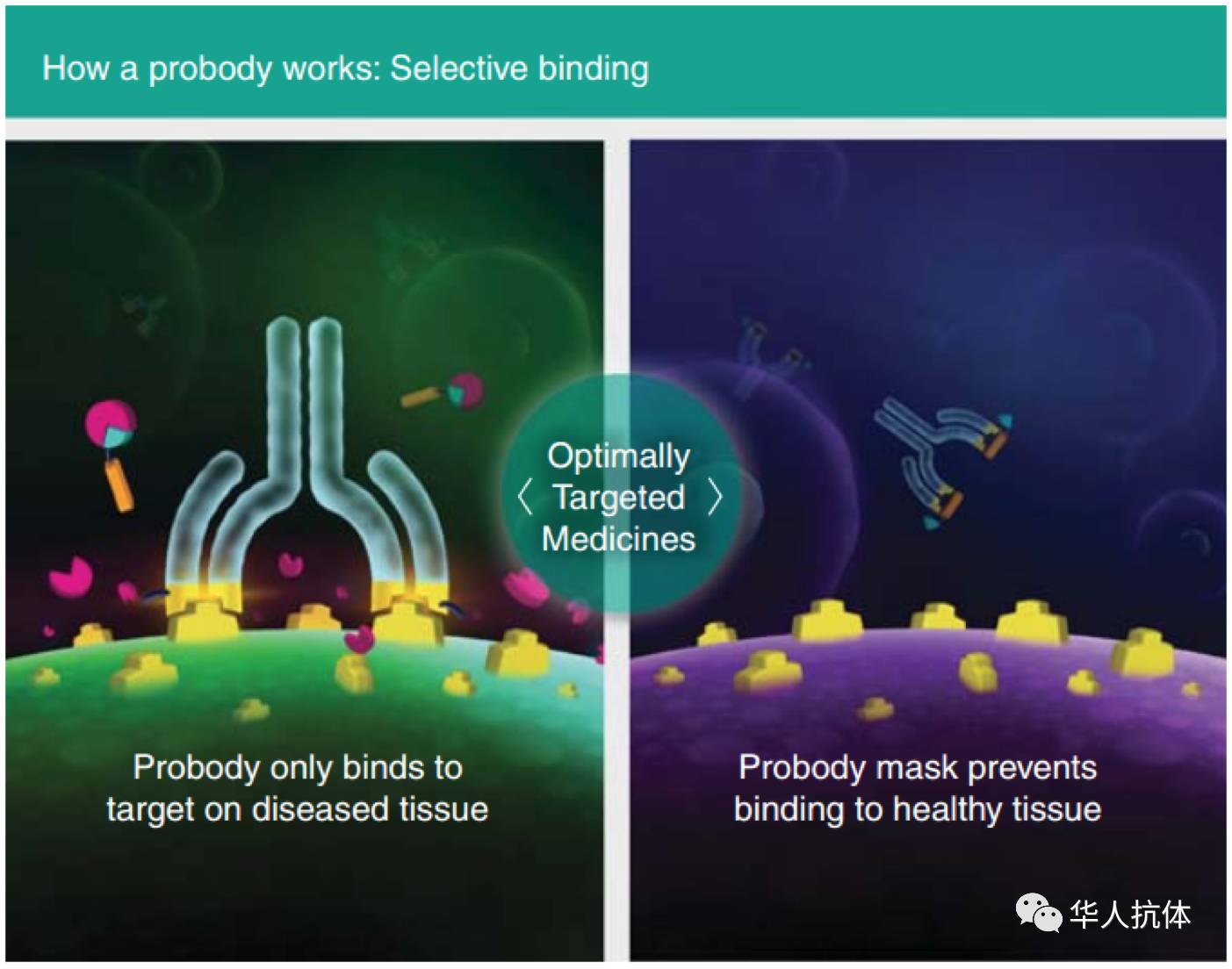
(图片来源:参考文献[2])
很明显,这项技术的关键在于linker和masking peptide的选择。
Linker的选择
Linker的选择是基于蛋白酶的选择,为符合这个技术平台的要求,他们对于蛋白酶的选择是基于以下几条原则[3]:
-
在多种肿瘤部位高表达并且是以活化的形式存在
-
位于细胞表面或以分泌的形式存在
-
能够从Probody therapeutic上移除masking peptide
-
在正常的健康组织或者血液中活性很低
蛋白酶在机体中广泛表达,通过有调控地降解细胞外基质,参与细胞增殖、迁移、器官生长和重塑。而在癌症中,很多蛋白酶在肿瘤部位的表达量上升,如尿激酶型纤溶酶原激活剂(uPA)、膜型丝氨酸蛋白酶(MT-SP1)、内肽酶等,它们的高表达是肿瘤环境的一个重要特征[4]。因此,可以利用CLiPS技术[5]从序列随机的6-AA(6个氨基酸的长度)多肽库中筛选出被特定蛋白酶识别和切割的底物肽段,用于Probody therapeutic的构建。
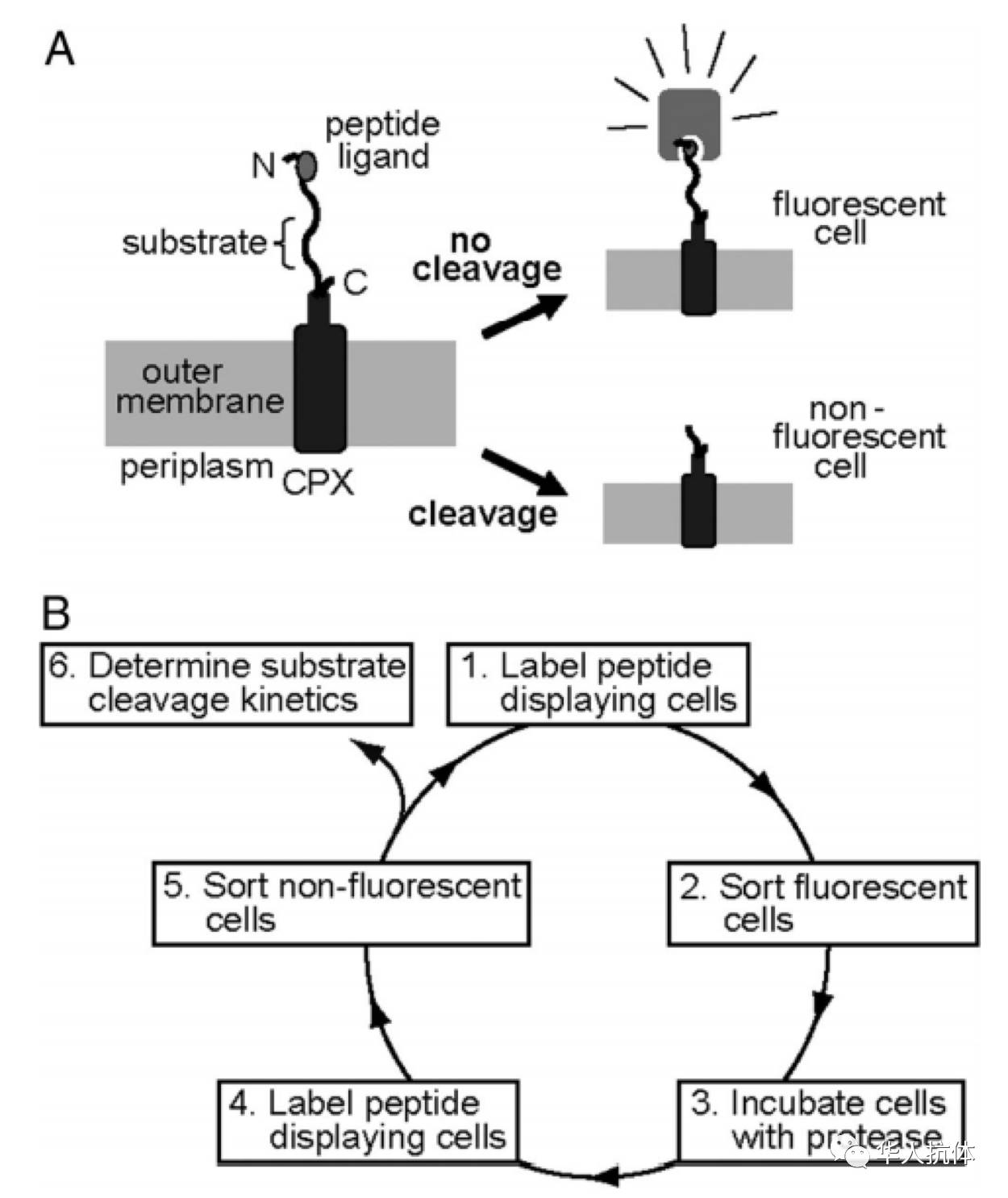
(图片来源:
参考文献[5]
)
当然,不同类型的肿瘤,相对应的高表达的蛋白酶的种类不尽相同。对于特定肿瘤组织中的蛋白酶的种类和活力的检测,CytomX开发了一套基于对probody therapeutic的活化作用的体外检测方法,并申请了专利:HK1210831(A1)。当确定特定的肿瘤部位高表达某种或某些蛋白酶之后,就可以选用相应的底物序列去构建Probody therapeutic。
Masking peptide的选择
有不止一份专利申请书讲述了masking peptide的选择过程,如CytomX的专利TW201704265 (A)等,方法大致分为3步:1.构建一个长度合适的随机多肽库(比如45个碱基,翻译成15个氨基酸),载体为细菌的表达载体,可将多肽库表达在细菌表面;2.将要修饰的抗体标记荧光,利用流式分选技术多轮筛选能够被抗体结合的多肽;3.筛选出的肽段构建到Probody therapeutic中,利用结合实验检测肽段对抗体的掩蔽效率,并可以通过截短、突变等方法进行掩蔽效率的优化。
Probody的前期研发过程简析(以抗EGFR的probody therapeutic为例)
CytomX公司的专利US2017196996(A1)和文献[6]记载了抗EGFR的probody therapeutic的早期开发过程。这里以文献[6]上发表的数据为例。
初始的单克隆抗体选用的是cetuximab。Linker和Masking peptide的筛选过程如前文所述。文献报道[6]最终所用的序列如下。

(信息来源:
参考文献[6]
)
构建得到的probody therapeutic(PB1)用蛋白酶进行体外切割,毛细管电泳实验的鉴定结果显示底物序能够被相应的蛋白酶所切割(下图B)。ELISA实验显示,PB1对抗原的结合能力减弱,而masking peptide被移除的PB1(activated pb1)则恢复了结合能力(下图C),证明masking peptide对抗体的抗原结合区域有很好的掩蔽效果,且该掩蔽效果能够被蛋白酶的酶切所恢复;H292细胞系的增殖实验证明,PB1对细胞增殖的抑制能力被屏蔽,而masking peptide的移除则恢复了抗体的功能(下图D)
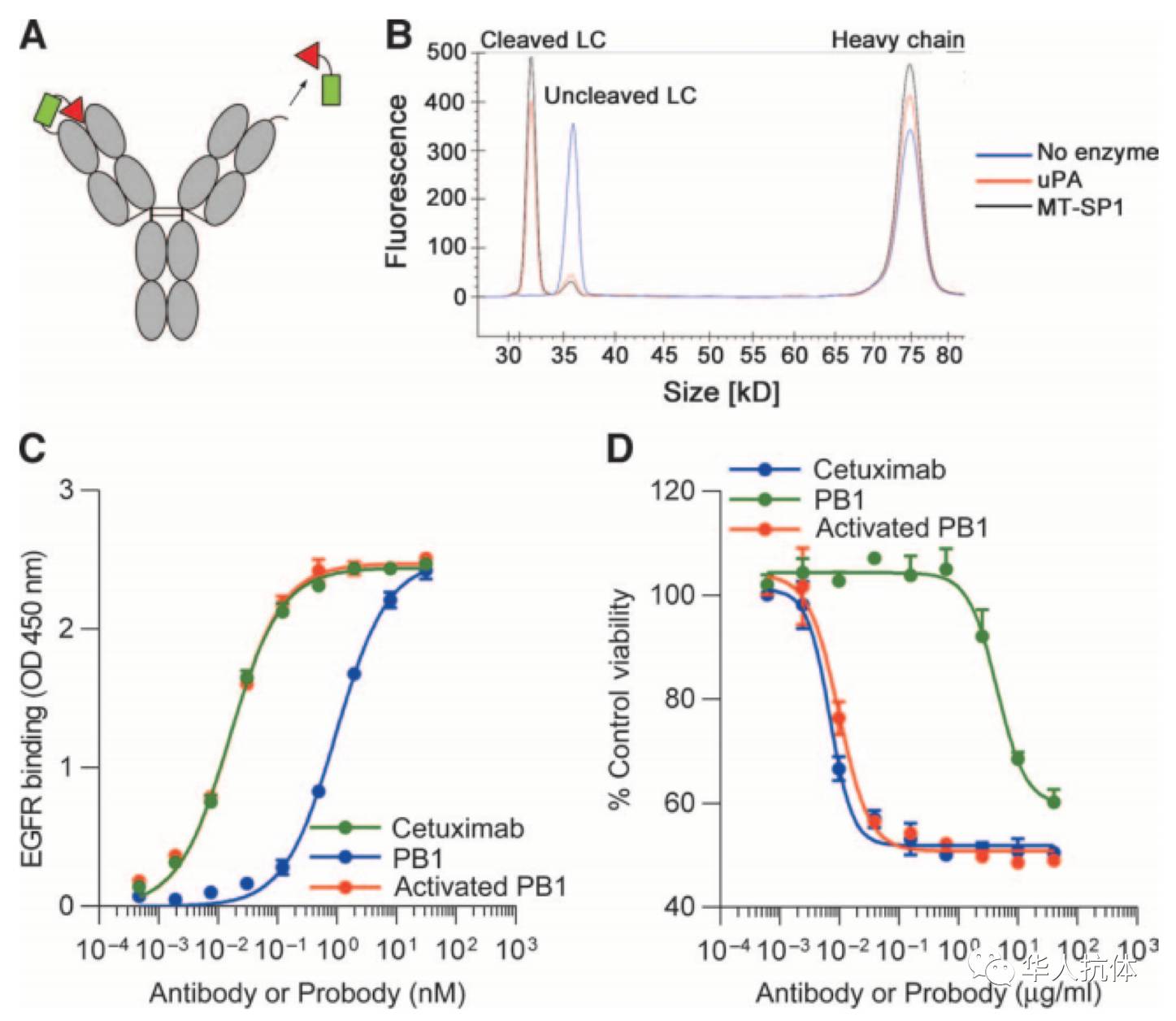
(图片来源:
参考文献[6]
)
下图显示,利用H292细胞系移植瘤模型来源的组织切片做免疫组化实验,结果显示:PB1能够能够结合组织部位表达的EGFR;而当masking peptide与抗体之间适用不能被蛋白酶切割的linker相连时(PB-NSUB),抗体的结合EGFR的能力则不能恢复(下图A)。这说明PB1中的linker能被组织部位的蛋白酶切割。利用蛋白酶抑制剂的实验(下图B)也能证明这一点。
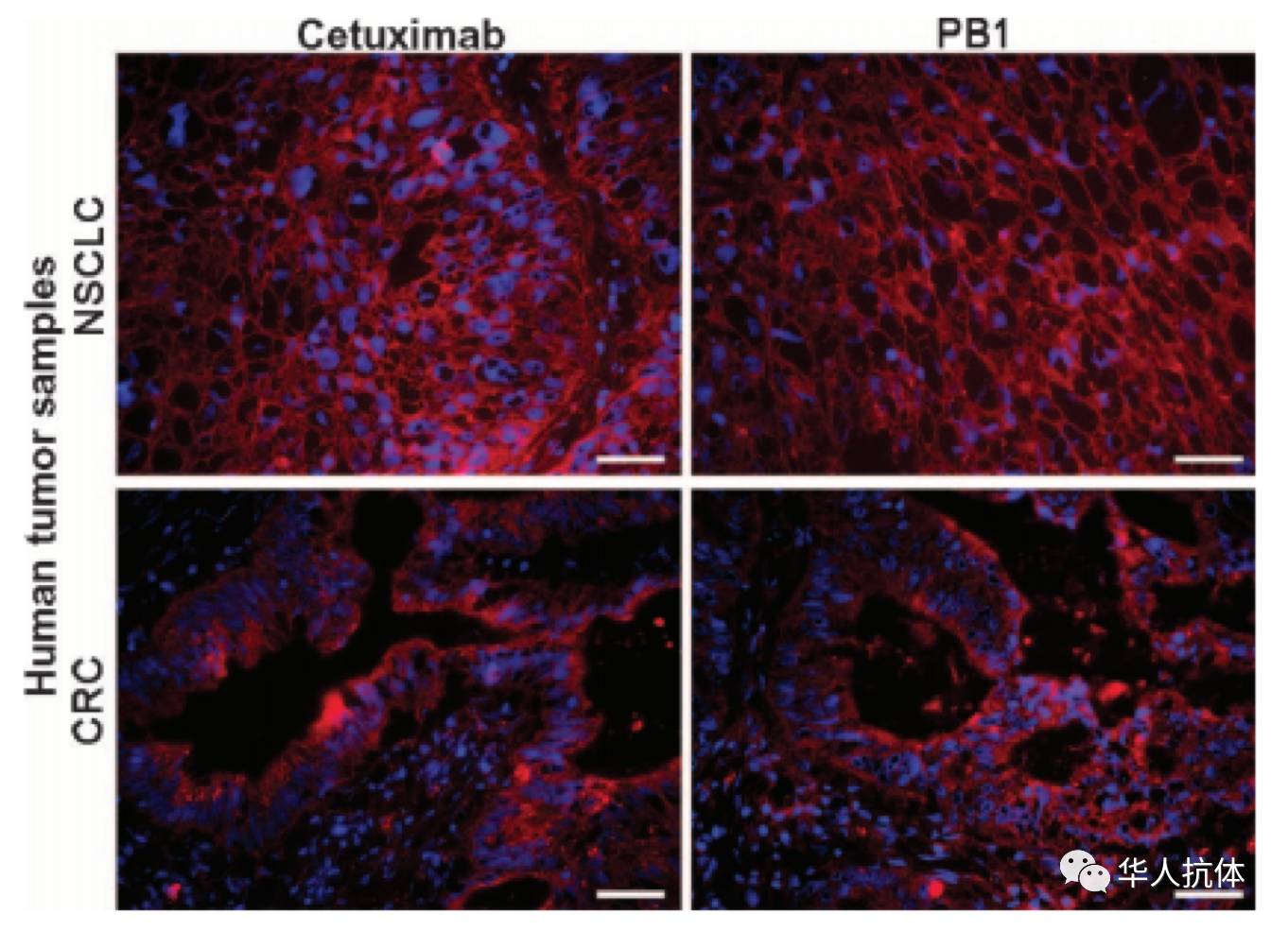
(图片来源:
参考文献[6]
)
下图为利用抗体对动物活体内的H292细胞系移植瘤进行成像,结果说明了PB1在体内能够通过蛋白酶切割linker去除masking peptide,从而恢复对抗原的识别和结合能力。

(图片来源:
参考文献[6]
)
下图为国内实验的结果,证明PB1在体内能够通过蛋白酶切割linker去除masking peptide,从而恢复对癌细胞的抑制能力。
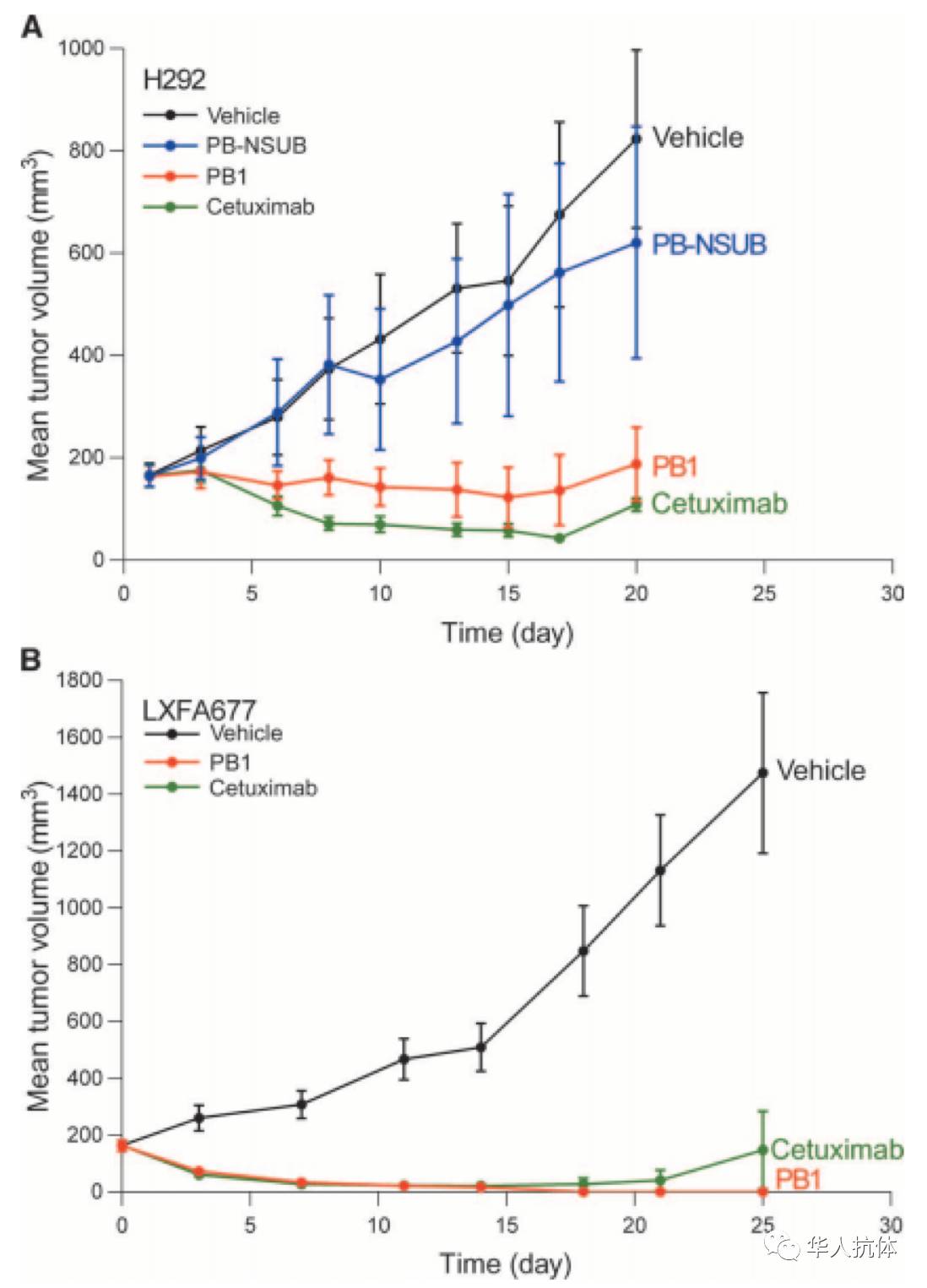
(图片来源:
参考文献[6]
)
PB1的体内功能得到小鼠移植瘤模型的基本验证后,再在食蟹猴体内对其安全性进行检测。下表数据显示,在同等剂量下使用PB1并未造成cetuximab的用药所产生的皮肤毒性;只有在更高的剂量下PB1才会产生较弱的皮肤毒性。
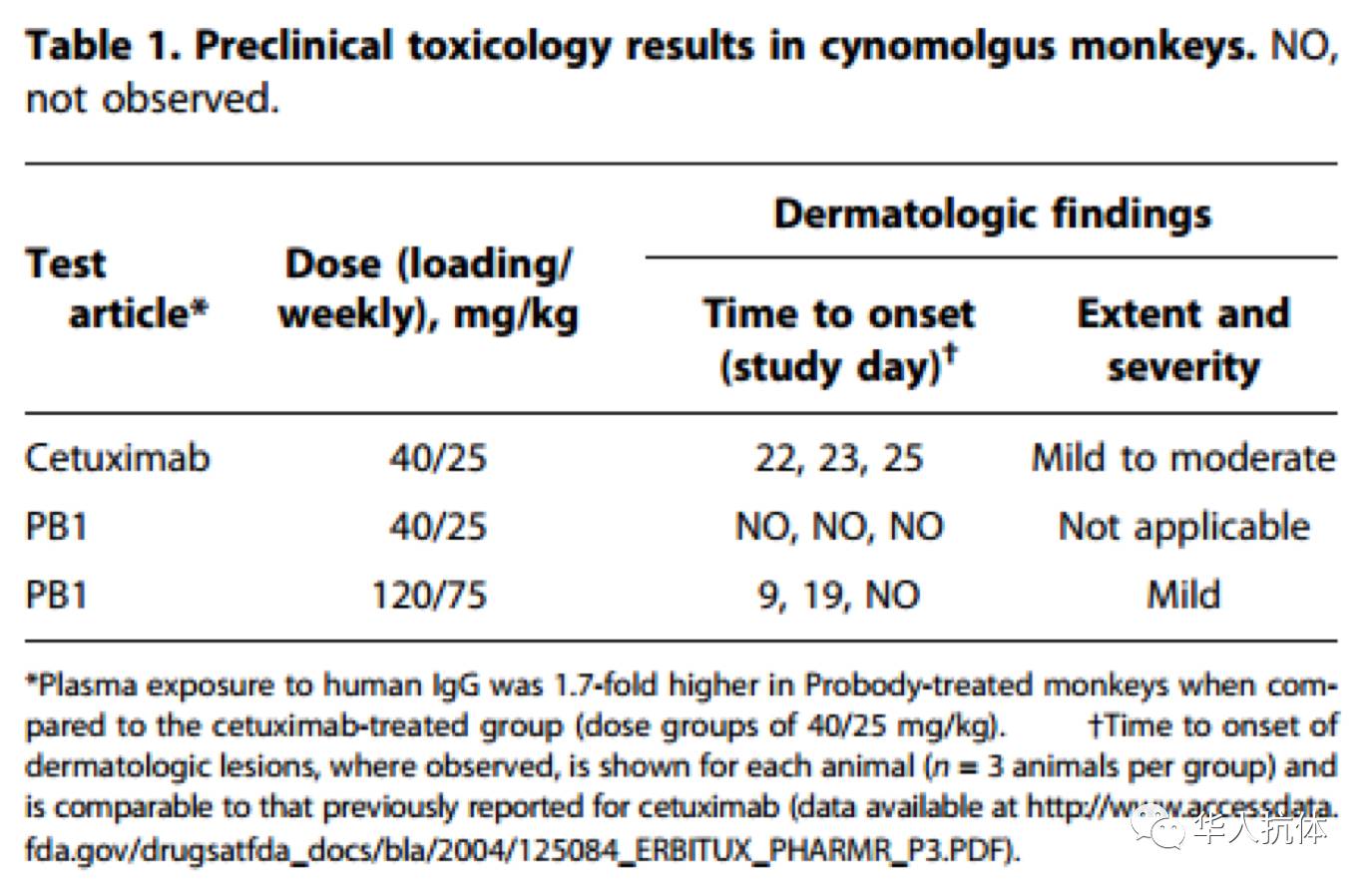
(图片来源:
参考文献[6]
)
下表的数据显示,在食蟹猴体内,同等剂量的PB1相对于cetuximab有更好的药代动力学特征。
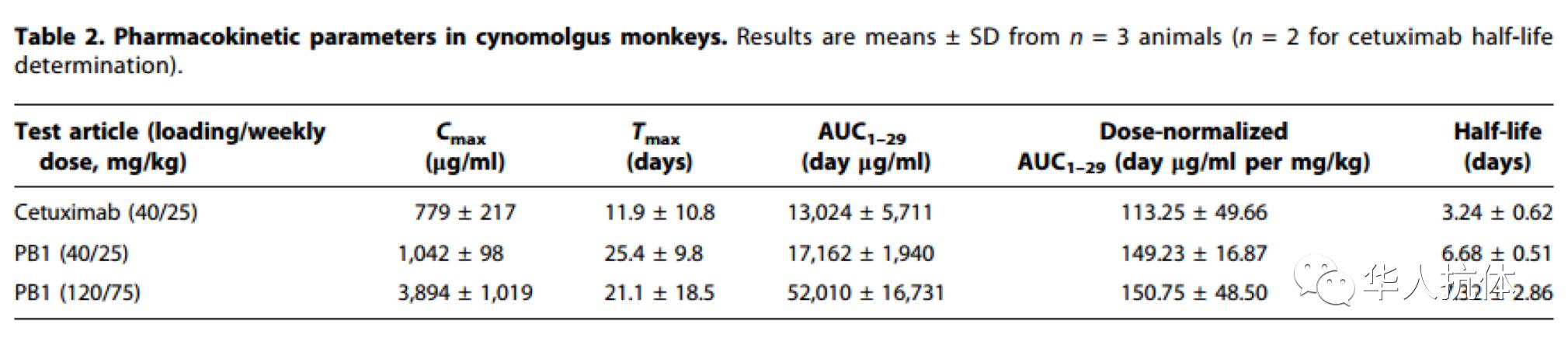
(图片来源:
参考文献[6]
)
文章的最后一个figure显示,PB1能够被人的非小细胞肺癌和结直肠癌组织切片中的蛋白酶活化从而结合切片中表达的EGFR。

(图片来源:
参考文献[6]
)
从以上数据可以看出,利用Probody技术开发出的PB1在维持原本的cetuximab抗肿瘤功能的同时,毒副作用有所降低。这一结果作为前期的验证工作,使人们有信心将其运用到临床。
基于Probody技术的产品研发情况——CytomX
由于Probody技术是CytomX的专利技术,因此该技术相关的抗体药物研发基本集中在这家公司。据CytomX所称,他们的pipeline的选择有3种策略[3]:
-
针对已经经过临床验证的抗体药物靶点开发新的药物,以期通过该技术扩大治疗窗口
-
利用该技术的优势尝试针对新的难以成药的靶点开发药物
-
与领先的制药企业合作,扩大该技术的应用
目前该公司已公开部分细节的pipeline如下:
|
项目
|
靶点
|
药物形式
|
研发阶段
|
合作方
|
|
CTLA-4 Probody Tx
|
CTLA-4
|
Probody therapeutic
|
IND
|
BMS
|
|
CX-072
|
PD-L1
|
Probody therapeutic
|
临床I/II期
|
无
|
|
CX-188
|
PD-1
|
Probody therapeutic
|
IND
|
无
|
|
CTX-033
|
Jagged
|
Probody therapeutic
|
早期
|
无
|
|
ITGA3 PDC
|
ITGA3
|
Probody therapeutic
|
早期
|
无
|
|
CX-2029
|
CD71
|
Probody-drug conjugate
|
IND
|
AbbVie
|
|
CX-2009
|
CD166
|
Probody-drug conjugate
|
临床I/II期
|
ImmunoGen
|
|
PDCs
|
-
|
Probody-drug conjugate
|
早期
|
Pfizer
|
|
T-cell engaging Bispecifics
|
EGFR, CD3
|
Prpbody bispecifics
|
早期
|
Amgen
|
|
-
|
-
|
ProCAR-NK cell therapies
|
早期
|
MD Anderson
|
其中有多个项目是从外部引进或通过合作开发的方式进行。如CX-2009项目是CytomX从ImmunoGen获得ADC药物的授权,结合自身的技术进行开发,CX-2009完全归CytomX所有; CytomX与Amgen合作开发的EGFR X CD3双特异性抗体的项目中,CytomX负责前期研发,Amgen负责后期开发和商业化。可以看出,这一技术已获得多个大型制药公司的青睐。
其中,已进入临床研究阶段的项目有两个:CX-2009和CX-072。
CX-2009正在进行I/II期阶段的临床试验(NCT03149549),用于检测CX-2009单药在携带有转移或原位进展的、不可切除的肿瘤的成年患者体内的安全性、耐受性、药代动力学、药效动力学和抗肿瘤效果,选择的癌症类型包括乳腺癌、非小细胞肺癌、前列腺癌等7个。















