作者 l
放翁是水货
编辑
l
细胞房间
Regeneron和Sanofi重构肿瘤免疫领域新药研发项目
1月7日,美国,Regeneron和Sanofi今日联合宣布双方已经达成一项全新的基于肿瘤免疫新药研发的合作,旨在拓展未来肿瘤免疫新疗法,提升公司在该领域的竞争力。两家公司早在2015年就抗肿瘤新药研发达成一系列合作,根据新修订的合作协议显示,目前处于临床研发阶段的两个双特异性抗体开发工作将持续进行,协议允许Regeneron保留其他候选药物的所有权利,同时
Sanofi
将提供更大的灵活性政策以推进其早期肿瘤免疫研发管线的构建。在此过程中,
Sanofi
将向Regeneron支付4.62亿美元,涵盖已有药物的研发相关费用,Regeneron将投入7000万美元用于进一步开发用于多发性骨髓瘤的BCMA/CD3双特异性抗体,投入5000万美元以进一步开发针对粘蛋白-16阳性癌症的MUC16/CD3双特异性抗体。在药物开发的后期阶段,
Sanofi
将主导两个双特异性抗体的开发和商业化,并为其提供全面的资金支持,
Sanofi
和Regeneron将平等分享产品的全球利润。
Janssen向EMA递交了STELARA®(ustekinumab)治疗结肠炎的申请
1月7日,比利时,Janssen制药公司今天宣布向EMA提交新的用药申请,寻求批准STELARA®(ustekinumab)用于治疗中度至重度活动性溃疡性结肠炎(UC)的成人患者。Ustekinumab是一种针对IL-12和IL-23细胞因子的人源化单克隆抗体,此次的申请是基于一项新的III期临床试验数据,该研究评估ustekinumab治疗成人中度至重度活动性UC的疗效和安全性。最近的数据表明单次静脉注射ustekinumab治疗可以使患者的病情得到有效缓解,一定程度缓解了其对于其他疗法无应答的艰难现状。
Stemline Therapeutics向EMA递交了ELZONRIS的上市申请
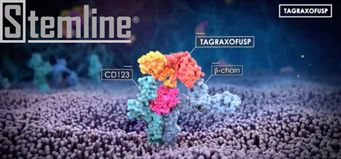
1月7日,美国,Stemline Therapeutics今天宣布已向EMA提交ELZONRIS(tagraxofusp)的上市申请, 寻求将该药用于浆细胞样树突状细胞肿瘤(BPDCN)的治疗。 2018年12月21日,ELZONRIS被FDA批准用于两岁及以上成人和儿童患者的BPDCN治疗,该药是第一个获准用于BPDCN的治疗药物,也是首个获得批准的CD123靶向治疗药物。
BPDCN是一种侵袭性血液系统恶性肿瘤,BPDCN通常存在于骨髓或皮肤中,随着疾病的进展癌细胞还会向淋巴结和内脏转移,CD123、CD4和CD56的免疫表型诊断三联体是BPDCN确诊的有效方法。CD123在多种恶性肿瘤中表达,包括BPDCN、AML、某些骨髓增生性肿瘤(MPN)、骨髓增生异常综合征(MDS)、慢性粒细胞白血病(CML)、B细胞急性淋巴细胞白血病(B-ALL)、毛细胞白血病和霍奇金氏病等。ELZONRIS(
tagraxofusp
)是靶向白细胞介素13受体-α(CD123)的新型靶向药物,前期的关键II期临床研究已经有效证实tagraxofusp对于BPDCN领域的治疗是一次前所未有的飞跃.
Checkpoint公司进一步推进新药CK-301的队列扩展研究
1月7日,美国,Checkpoint Therapeutics今天宣布正在开展的有关CK-301的多中心临床试验已经进入到队列扩展研究阶段。目前该项研究新增了三类患者,分别为MSI-H子宫内膜癌、MSS子宫内膜癌,MSI-H或错配修复缺陷的结肠直肠癌。每个受试组患者每两周接受固定剂量800mg的 CK-301治疗,主要终点是客观反应率(ORR),次要终点包括持续应答时间(DOR),无进展生存期和总生存期。目前CK-301的多中心试验初期已经在选择性复发或转移性癌症的初治患者中评估了CK-301递增剂量的安全性和耐受性,现阶段将开展多剂量扩增队列研究。初步数据表明CK-301在规定剂量下安全且耐受良好的,治疗相关不良事件与市售PD-1/PD-L1抗体一致。
Merus公司将于今年2季度推进双特异性抗体MCLA-145的临床研究
1月7日,美国,Merus今天宣布FDA已经受理了抗PD-L1/CD137双特异性抗体MCLA-145治疗实体瘤的新药研发申请。已有的临床前研究表明,MCLA-145具有更为明显的优势,相比于普通CD137激动剂副作用更低,同时还为对于现有免疫治疗剂无应答的患者提供了一个新选择,Merus公司计划在2019年第二季度启动MCLA-145的临床试验。
2016年12月Merus与Incyte达成合作共同开发MCLA-145,除此以外目前两家公司的合作的候选产品还包括来自Merus Biclonics®技术平台的11种双特异性和单特异性抗体。
Amgen降低Repatha(evolocumab)售价以提高患者用药可及性
1月7日,美国,Amgen今天宣布,为了兑现对伴有心脏病和中风风险的高胆固醇患者提供创新生物医疗服务的承诺,所有Repatha®(evolocumab)及先关设备均降价60%销售,其直接目的是减少患者的自付费用,缓解患者的用药负担。根据美国健康学会的估计,每40秒就会有一名因心脏病发作或中风导致诱发心血管疾病的患者产生,这一直是一项重大的公共卫生问题。根据公司数据显示,截至目前已经有80%的患者因为降价而获益,此外更多患者现在可以在零售药房购买该药,大大提升了患者购药的可及性。
Repatha®(evolocumab)是一种人源化单克隆抗体,可抑制Kexin样前转化酶枯草杆菌蛋白酶9(PCSK9)。 Repatha与PCSK9结合并抑制其与低密度脂蛋白受体结合,阻止PCSK9介导的LDLR降解并允许LDLR再循环回肝细胞表面。
三生制药和三星制药达成合作推进bevacizumab等多种仿制药在中国落地
1月7日,中国,三生制药近日与三星制药达成合作,共同推进多种生物仿制药候选物在中国(不包括香港、澳门、台湾)的开发和商业化,其中包括bevacizumab仿制药SB8。根据协议,三星将负责产品的制造和供应,并与三生制药共同推进在中国的临床开发、监管注册和商业化。三星制药将从三生制药获得预付款和产品供应收入,并有资格获得预先指定的临床和监管里程碑付款。
小编点评:
在中国贝伐单抗生物仿制药候选物的适应症集中于转移性结肠癌和非小细胞肺癌,这一领域的市场潜力广阔,但是竞争压力同样巨大。
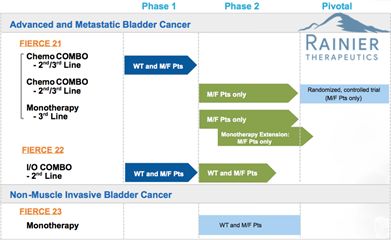
膀胱癌候选靶向药物vofatamab获得FDA快速通道认定
1月7日,美国,Rainier Therapeutics今天宣布其在研药物vofatamab已获得FDA颁发的快速通道认定。该药目前是唯一一种特异性靶向成纤维细胞生长因子受体3(FGFR3)的抗体,计划用于FGFR3突变阳性晚期或转移性尿路上皮细胞癌(膀胱癌)的治疗。Rainier Therapeutics正在进行vofatamab治疗转移性膀胱癌中的1b期和2期临床研究(Fierce 21和Fierce 22研究)。Fierce 21试验着重评估vofatamab与多西紫杉醇联合用药治疗膀胱癌的安全性和有效性。Fierce22试验着重评估vofatamab与pembrolizumab联合使用,以确定安全性,耐受性和疗效。
Crizanlizumab对于镰状细胞病发症的预防治疗起到积极作用
1月8日,瑞士,诺华公司今天宣布FDA已经授予crizanlizumab用于预防治疗镰状细胞病(SCD)中的血管闭塞危象(VOC)突破性疗法称号。根据II期临床SUSTAIN试验的阳性结果,对于有或没有羟基脲治疗的患者,与安慰剂相比,crizanlizumab使因VOC就诊的概率降低了45.3%,该研究还表明,在治疗期间,crizanlizumab组患者不发生VOC的比例显着增加。
镰状细胞病是一种遗传性血红蛋白分子功能紊乱的血液病,红细胞呈镰刀状。镰状细胞僵硬、变形性差、不易通过毛细血管而使毛细血管内血流减慢,当多个血细胞相互粘连并粘附到血管上时会发生VOC,引起组织缺氧和微血栓,导致不同部位的剧烈疼痛。镰状细胞在毛细血管内遭受机械性损伤,容易破坏导致溶血。患者的症状常有两个表型,一方面表现为慢性溶血性贫血,另一方面由于毛细血管微血栓而引起疼痛危象。
Crizanlizumab是一种人源化抗P-选择素单克隆抗体,用于预防镰状细胞病(SCD)患者的血管闭塞性危象。 Crizanlizumab与血小板和血管内皮细胞表面的P-选择素分子结合,可抑制内皮细胞、血小板、红细胞、镰状红细胞和白细胞之间的相互作用,阻止这些细胞与P-选择蛋白结合。
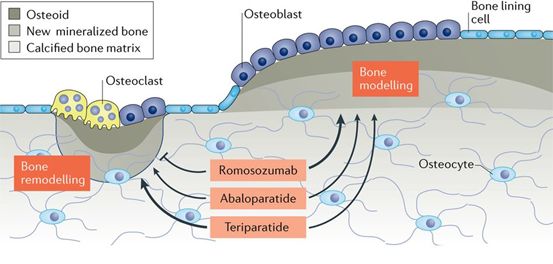
EVENITY™ (romosozumab)在日本获批上市用于骨松的治疗
1月8日,日本,Amgen和UCB公司今天宣布,日本卫生当局已批准EVENITY(romosozumab)的上市许可,可用于骨折高风险患者的骨质疏松症治疗。 先前患有骨质疏松性骨折的患者,如果未确诊并且未经适当治疗,再次诱发骨折的可能性增加至两倍,EVENITY可以增加骨密度(BMD)并降低骨折风险。
小编点评:
在日本,骨质疏松性骨折是患者失去日常护理能力的重要原因,随着日本老年人口的增加,及时有效预防骨折发生变得尤为迫切。这是EVENITY在全球范围内首次获批上市,FDA和EMA目前正在审查EVENITY的上市申请。
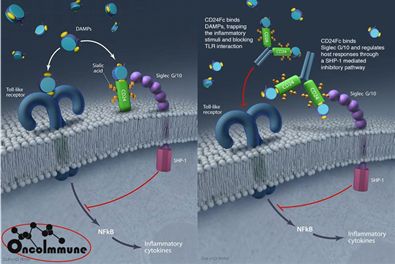
OncoImmune公司已经完成抗炎症新药CD24Fc的IIa期临床试验
1月10日,美国,OncoImmune公司今天宣布已经完成了CD24Fc的IIa期临床试验。这是一项多中心前瞻性随机研究,旨在确定在急性GVHD(移植物抗宿主病)发作的预防治疗中,CD24Fc能够给予的最大耐受剂量。该项研究已于2018年12月正式完成,数据显示CD24Fc安全且耐受性良好。此外,与安慰剂和历史对照相比,CD24Fc的预防疗效具有显著改善,患者的1年总生存期更好,严重粘膜炎的剂量依赖性也同步降低。
CD24Fc,这是一种靶向CD24-Siglec途径的新型重组融合蛋白,已在多发性硬化和类风湿性关节炎的GVHD动物模型中证实有效,并且在健康人类受试者的I期试验中具有安全性。模式识别受体在识别病原体或受损细胞成分后会触发先天性免疫反应,Siglecs是一类独特的模式识别受体,可以负调节NFkB的活性,抑制TNF-α、IL-1β和IL-6等介导的细胞炎症。
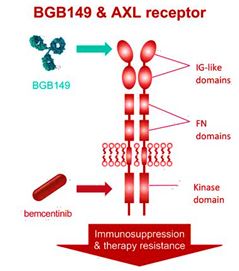
BerGenBio公司的抗AXL单克隆抗体已正式进入临床开发阶段
1月10日,挪威,BerGenBio公司今天宣布其在研的治疗性抗AXL单克隆抗体BGB149的1期临床研究已经完成第一位受试者的给药。BGB149是目前第一个进入临床开发的能够功能性阻断AXL活性的完全人源化单克隆抗体,临床前研究已证实其作用机制和功效。此次的期临床试验将招募多达36名受试者,在进行单剂量给药后以评估BGB149的安全性、耐受性和药代动力学特性。
AXL激酶是细胞膜受体,在癌症的发生发展中,AXL激酶可以抑制身体对肿瘤的免疫反应,同时该蛋白也是目前众多患者治疗失败的重要原因。因此AXL抑制剂在肿瘤联合治疗中具有潜在的高价值,可以解决更多的临床需求,蕴藏着较大的市场潜力。
欢迎加入小编团队成为小编一员















