摘要:重组人生长激素(rhGH)治疗的安全性问题包括对癌症风险的影响,对血糖稳态的影响以及可能形成内源性或外源性GH的抗体。Omnitrope®(生物仿制药rhGH)与参考药物(GENOTROPIN®)相比,有着同等的质量,安全性和效力,并于2006年经欧洲药品管理局批准上市。可能存在的与生物仿制药rhGH相关的其他问题还包括基于外推法给出的适应症的安全性,以及从其他rhGH治疗方法改变为生物仿制药rhGH治疗时的影响。大量的数据可充分说明生物仿制药rhGH的安全性,这些数据来自临床开发研究阶段和批准上市后十年间的记录。截至2016年6月,生物仿制药rhGH已有106,941,419患者天(292,790患者年)的记录。根据可用数据,生物仿制药rhGH在治疗中没有出现意外或独特的不良事件。与参考药物或其他rhGH产品相比,生物仿制药rhGH没有增加癌症风险,没有出现不良血糖平衡和免疫原性反应。 生物仿制药rhGH的免疫原性与参考药物和其他rhGH产品相似。 医生应该放心,rhGH产品在用于批准的适应症和推荐剂量时具有良好的安全记录,生物仿制药rhGH的安全性与其他rhGH产品的安全性保持一致。
重组人生长激素(rhGH)在临床上已使用了三十多年。在此期间,rhGH在儿童和成人中的安全性得受到了相当大的关注。最近对儿童和成人的rhGH评估得出结论,当用于治疗批准的适应症时并且符合推荐剂量时,rhGH仍旧有着良好的安全记录,同时指出需要对接受这些疗法的人进行持续监测。另一项研究最近评估了瑞典病人的预期死亡人数(n = 3,847),这些病人在儿童期用rhGH治疗过先天性单纯生长激素(GH)缺乏症,先天性身材矮小,或胎龄较小(SGA).与一般的瑞典人口相比,在调整出生特征后,在儿童期rhGH治疗组中观察/预期死亡率的比例没有增加。
重组人生长激素(rhGH)治疗的安全性问题包括对癌症风险的影响,对血糖稳态的影响以及可能形成内源性或外源性GH的抗体。可能存在与Omnitrope®(生物仿制rhGH; Sandoz,Kundl,Austria)及其生物仿制地位相关的其他担心,包括基于外推法给出的适应症安全性和从其他rhGH治疗改变为生物仿制药rhGH治疗的影响。本文回顾了生物仿制药rhGH在临床使用的10年间所获得的安全经验。截至2015年,全球已有42300名患者接受了生物仿制药rhGH治疗;截至2016年6月,本产品收集了106,941,419例患者天(292,790例患者年)的记录。医生应该放心,生物仿制rhGH的安全性与其他rhGH产品保持一致。
生物仿制药rhGH的III期临床开发方案包括三项关键性研究,共有210名儿童生长不足继发于生长激素缺陷(GHD;表1)。AQ研究是一项多中心,随机,对照,非盲的III期研究,由三部分组成,在同一有GHD(n=89)的儿童队列中连续进行。在整个84个月的治疗中,生物仿制药rhGH的安全性正如预期,与以前的参考药物和其他rhGH制剂有着同样的安全性。 大多数报告的不良事件(AEs)强度轻微。 药物不良反应(ADRs)每个患者每年至少发生0.05个事件,包括糖基化血红蛋白(HbA1c)增加,头痛,和注射部位血肿。只有一个严重的不良反应报道; 这是一个先前存在的脊柱侧凸恶化的病例,在研究期间需要多次住院治疗。
Lyo研究是一个多中心无对照的III期研究,使用5mg/mL生物仿制药rhGH的冻干制剂治疗GHD儿童(n = 51)。儿童接受治疗长达48个月。生物仿制药rhGH的安全性正如预期,与以前的参考药物和其他rhGH制剂有着同样的安全性。超过5%患者中出现AEs,包括嗜酸粒细胞增多症(12%),注射部位反应(10%),甲状腺功能减退(8%),和脊柱侧凸(6%)。 大多数AEs强度轻微; 三种(挫伤,血液碱性磷酸酶增加,HbA1c增加)被评为中度强度。没有病人因为AE而退出治疗研究,没有药物相关的严重AE。
第三个III期研究是一项非盲研究,是在西班牙用生物仿制药rhGH的3.3 mg/mL液态制剂治疗患GHD的儿童(n=70)时,评估该药长期治疗(长达5年)的安全性和有效性。大多数报告的AEs(401/426; 94%)被评估轻微强度;其中22人被评为中度,一名(牙痛)严重。10位患者中出现了药物相关的AEs(17项); 15/17被评估为轻度强度。药物相关的AE包括近视(1),呕吐(2)胃肠炎(1),病毒性咽炎(1),注射部位疼痛(2),抗体检测异常(3),高血糖症(1),肌腱炎(1),头痛(2),偏头痛(2)和皮炎(1)。没有患者因AE而退出研究治疗,没与有药物相关的严重AEs发生。在研究后期,那些仍在生长的患者被要求继续治疗(如通常的临床实践),并持续监测长达5年。任何参与了额外治疗和随访的患者中,没有出现与治疗相关的AEs的报道。没有任何一个患者由于AE停止这部分研究。
在法国也进行了51例GHD患者的IIIb期研究(2011年11月,Sandoz数据)。没有严重的AEs发生,没有必要的特殊的伴随治疗,也不存在AE导致退出研究。本研究没有出现意外的不良事件。报告了两例严重的AEs(阑尾切除术和便秘),也没有被认为与研究治疗有关。
表1. Omnitrope®关键的Ⅲ期研究
研究 | AQ研究 | Lyo研究 | 西班牙研究 |
设计 | 随机,对照,非盲研究(波兰,匈牙利) | 非盲,无对照多中心研究(波兰,匈牙利) | 非盲,无对照多中心研究(西班牙) |
对象 | 患GHD的青春期前儿童,且未用rhGH治疗过 | 患GHD的青春期前儿童,且未用rhGH治疗过 | 患GHD的青春期前儿童,且未用rhGH治疗过 |
研究的医药产品 | 5mg/ml的冻干Omnitrope®,3.3mg/mL的液态Omnitrope®,参考药物 | 5mg/ml的冻干Omnitrope® | 3.3mg/mL的液态Omnitrope® |
剂量 | 皮下注射0.03 mg/kg | 皮下注射0.03 mg/kg | 皮下注射0.03 mg/kg |
持续时间 | 84个月 | 48个月 | 60个月(平均44个月) |
受试者数量 | 89 | 51 | 70 |
缩写:GHD,生长激素缺乏症;rhGH,重组人生长激素;SC,皮下
许多生物仿制药rhGH的批准后研究正在进行中,用于以外推法给出的适应症,这些都是有用的数据源。使用Omnitrope®(PATRO)儿童治疗的患者研究是一个持续的,长期的上市后监督计划。PATRO儿童的主要目标是评估生物仿制药rhGH的长期安全性,尤其rhGH治疗时导致糖尿病的潜在风险,恶性肿瘤的风险,以及儿童用rhGH导致Prader-Willi综合征(PWS)的潜在风险。所有的AEs在每次访问时都记录在rhGH的完整疗程中。空腹血糖,2小时口服葡萄糖耐受测试,胰岛素水平,HbA1c,和抗GH抗体被要求按照常规的临床实践记录。
截至2016年7月,已有5,007名患者在PATRO儿童登记,生物仿制药rhGH的平均治疗持续时间32.4个月。大多数患者患有GHD; 还有很多病人患有SGA,特纳综合征(TS),和PWS。 基线特征如表2所示。
表2. 截至2016年7月PATRO ChildrenⅡ研究中病人的基线特征
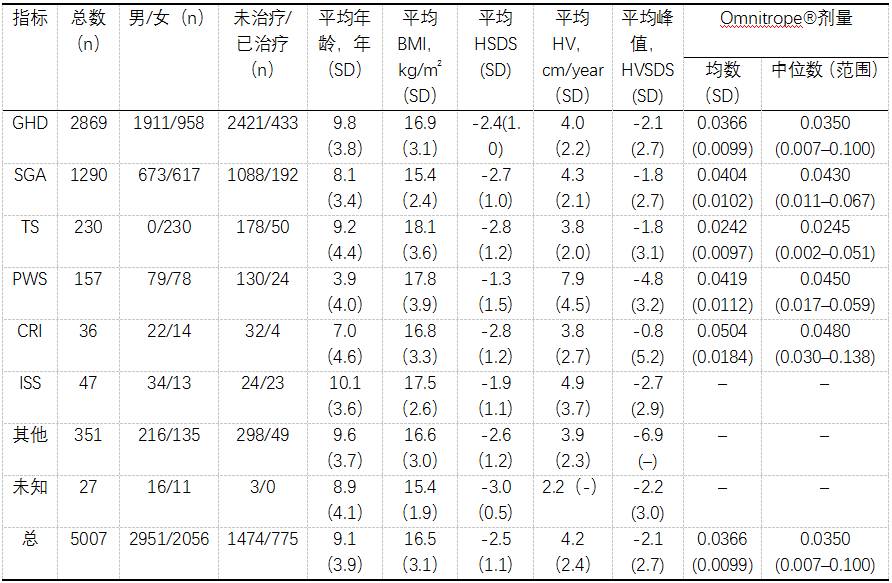
注:58例患者的治疗前信息不可用。缩写词:BMI,身体质量指数;CRI, 慢性肾功能不全; GHD,生长激素缺陷;HSDS,身高标偏差;HV,生长速度;HVSDS,HV标准差;ISS,特发性身材矮小;PATRO,用Omnitrope治疗的患者; PwS,Prader willi综合症;SD,标准差;SGA,孕龄小;TS,特纳综合症
总体而言,有1,924例患者(38.4%)出现了AEs,其中大部分是轻度至中度强度(表3)。很少有患者(3.5%)由于AE而退出(表4)。126例患者(2.5%)中断了Omnitrope®治疗,43例患者的剂量减少(0.9%)。 总共,有284名患者(5.7%)报告了与药物有关的AEs,其中头痛最常见(75例,1.5%)(表3)。共有来自67例患者的126个样品检测了抗hGH抗体。在治疗初期只出现了一个阳性的抗hGH抗体滴度患者,这个病人的所有后续检测结果均为阴性。到目前为止,已经有12名患者在经过2年的生物仿制药rhGH治疗后,接受了抗hGH抗体的测试;这些病人中没有报道阳性抗hGH抗体滴度。此外,没有rhGH相关的恶性肿瘤或任何其他安全问题的报道。
表3. 截至2016年7月PATRO ChildrenⅡ研究中AEs概括
| 受试者数量 (%) N=5,007 |
AE总数 | 1,924 (38.4) |
药物研究相关 |
|
未被怀疑 | 1,836 (36.7) |
怀疑 | 284 (5.7) |
强度 |
|
轻微 | 1,481 (29.6) |
中度 | 861 (17.2) |
重度 | 186 (3.7) |
缺失 | 326 (6.5) |
改为Omnitrope® 治疗 |
|
未变化 | 1,790 (35.7) |
增加 | 66 (1.3) |
减少 | 43 (0.9) |
中断 | 126 (2.5) |
永久退出 | 56 (1.1) |
缺失 | 93 (1.9) |
严重不良反应 |
|
未发生 | 1,832 (36.6) |
发生 | 323 (6.5) |
治疗相关的AEs(多于10人) |
|
头痛 | 75 (1.5) |
注射部位血肿
| 19 (0.4) |
关节痛 | 19 (0.4) |
注射部位疼痛 | 18 (0.4) |
甲状腺功能减退 | 13 (0.3) |
四肢疼痛 | 10 (0.2 |
缩写:AE,不良事件;PATRO,使用Omnitrope治疗的患者;MedDRA,ICH国际医学用语词典
表4. 截至截至2016年7月在PATRO ChildrenⅡ中治疗中止的原因
患者达到最终身高、骨龄成熟 | 488 (29.8) |
生长速度降低 (Hv ,1 cm/year) | 6 (0.4) |
接近最终身高 | 85 (5.2) |
患者满意目前身高 | 85 (5.2) |
患者不想继续注射 | 176 (10.7) |
患者不符合规定 | 51 (3.1) |
无应答 | 78 (4.8) |
不良事件 | 57 (3.5) |
改为其他GH产品 | 113 (6.9) |
失访 | 199 (12.1) |
其他原因 | 276 (16.8) |
未知 | 10 (0.6) |
总 | 1,640 (100) |
缩写:GH,生长激素,Hv,生长速度;PATRO,用Omnitrope治疗的病人
另外还有一个前瞻性的,非盲,无对照,多中心IV期研究以评估Omnitrope®在短期出生的SGA儿童中的安全性和有效性。这是迄今为止在SGA患者中对rhGH进行的最大的前瞻性临床研究。共有278名儿童入学,接受研究用药; 249人完成了为期2年的治疗。在第一个2年没有儿童出现糖尿病;没有空腹血糖或2小时口服葡萄糖耐量测试值超过预定限制(分别是大于126或200mg /dL)。治疗种有211个儿童(76.2%)出现了AEs;其中大部分是轻度到中度的强度(99.3%),且与研究治疗无关(97.6%)。17例(6.1%)患者出现了二十四种与药物有关的AEs(甲状腺功能减退,n=7;头痛,n=3;空腹血浆葡萄糖受损,n =3;IGF-I /IGFBP-3增加,n=2;促甲状腺激素增加,n=1;穿刺部位血肿,n=1;脊柱侧弯;n=1;上呼吸道感染,n=1;支气管炎,n=1;葡萄糖耐量降低,n=1; 咽炎,n=1;病毒感染,n=1; 猩红热,n=1)。所有人在严重程度上都被认为是轻微的,除了一例头痛,而且没有一种需要永久停用药物。发生在22位患者中的严重AEs,只有一个(严重头痛)疑似与研究治疗相关。在第一个为期2年的治疗中没有恶性肿瘤或死亡报告。
PATRO成人是一个持续观察的,多中心,开放,生物仿制药rhGH的纵向研究,在欧洲的医院和专门的内分泌科诊所进行。主要目的是评估生物仿制药rhGH在成人常规临床治疗中的安全性和效力。截至2016年3月,共有1043例患者参加了研究; 562人(54%)曾接受过GH治疗。迄今为止,597例(54%)患者中已有2,025例AEs报告,其中317例(187人中)被视为严重。72例患者中有166例AEs怀疑与药物相关。其中包括19例神经系统疾病,19例肌肉骨骼/结缔组织疾病,17例一般疾病/给药部位异常,两个调查(IGF水平增加)。14例患者的22个严重AEs被记录为可能与研究治疗相关,其中一例发生糖尿病。在159例停止治疗的患者中,39例是因为AE而退出。
由于健康计划和/或病人的保险要求,或药典的改变,医生经常要改变对他们的病人所使用的rhGH。有人建议,将病人从一种类型的rhGH转变为另一种,可能会对病人的护理产生不良影响。有几项研究评估了从其他rhGH治疗转变为生物仿制rhGH的影响。一个三期临床数据的分析评估了生物仿制药rhGH治疗儿童的效果和安全性,一些儿童持续接受用冷冻干燥的粉末溶液或即用型溶液的生物仿制药rhGH治疗,另一些儿童接受参考药物rhGH9个月的治疗后改变为生物仿制药rhGH治疗。在所有群体中,几乎没有孩子经历过不良反应(ADRs);无论患者是否改变了治疗产品或保持相同的治疗,更多的ADRs出现在第一次为期9月的治疗期。免疫原性在各组分析中都不常见。从参考药物rhGH改变为生物仿制药rhGH之后,没有相关的抗GH抗体的风险增加。另一项研究报告了来自瑞典的数据,儿童由其他rhGH改为生物仿制药rhGH治疗。改为生物仿制药rhGH治疗之后没有出现严重或意想不到的ADRs的报告。
免疫原性是所有生物药物的潜在问题。导致对重组人类蛋白的免疫耐受能力中断的机制尚不完全清楚,但患者和产品相关的因素被认为是有关联的。相比其他给药途径,通过皮下途径给予大量治疗性蛋白质(其结果是治疗性蛋白质如rhGH通过淋巴系统进入循环)更有可能刺激免疫反应。对生物疗法的免疫反应的发展不一定会有任何临床结果。然而,偶尔可能会出现临床后果;如果生成抗体中和生物药物和/或内源性蛋白质的活性,可能发生效力丧失或更严重的临床效应。与生物仿制药rhGH结合的抗体的能力很低,对治疗的反应也没有效果。建议在任何一个原因不明的缺乏反应的病人中检测GH抗体。生物仿制药rhGH的抗体形成发生率与参考药物相似。
在AQ研究中,一些产生抗rhGH抗体的患者接受了非商业冻干形式的生物仿制药rhGH,其包括一种未检测到含量增加的宿主细胞蛋白。一旦转变为改进的商业制剂,患者可检测的抗体比例在3个月后下降,并在研究过程中持续下降;抗rhGH抗体的存在对患者生长没有任何影响(图1)。同样地,安全性在检测到抗体和未检测到抗体的患者中是可以比较的。在过去的9个月里,有45名患者接受了参考药物rhGH的治疗,有一名患者产生了抗rhGH抗体。剩余的四十四名患者转用生物仿制药rhGH液体制剂,其中三人产生了较低的抗rhGH抗体滴度;在最后一次访问(84个月)时,没有一个患者的抗体水平可以检测到。生物仿制药rhGH的免疫原性在其他批准前研究中也令人放心。Lyo研究和法国IIIb期研究中的参与者在24个月的治疗中没有出现抗rhGH抗体。在西班牙III期的研究中,在60个月的时间里使用生物仿制药rhGH治疗的70个病人中,有2例(2.9%)形成了抗rhGH抗体;在所有情况下,抗体的发生是短暂的。
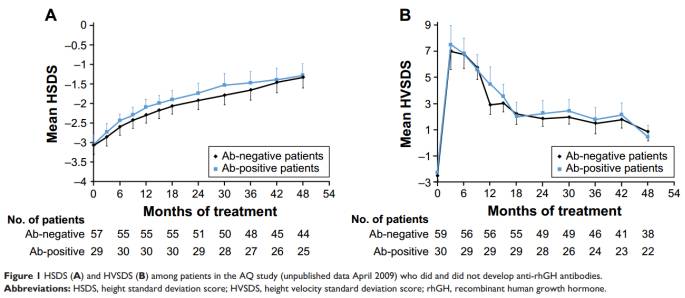
在IV期SGA研究中,第一年有7名患者(2.7%)的抗rhGH抗体水平高于临界值,第二年有3年患者(1.2%)。阳性测试结果是短暂的,只有2个(0.8%)的患者在两次单独的访问其抗体超过临界值。
在生物仿制药rhGH临床开发项目中,对混合抗体测试数据进行了分析。对492例患者的4,645项检测数据进行了分析,这些患者参加了三期III期研究(包括AQ研究),在法国进行的IIIb期研究,以及SGA儿童的IV期研究。总的来说,只有6例(1.2%)患者在两次单独访问时的抗体滴度高于临界值,掩盖了生物仿制药rhGH低免疫原性的潜力。这些研究中没有患者由于抗体滴度增加而停止治疗。
有大量的数据集可以充分了解生物仿制药rhGH的安全性,这些数据来自其临床开发研究和批准后10年记录。根据可用数据,生物仿制药rhGH在治疗中没有出现意外或独特的不良事件。与参考药物或其他rhGH产品相比,生物仿制药rhGH没有增加癌症风险,没有出现不良血糖平衡和免疫原性反应。此外,生物仿制药rhGH与参考药物和其他rhGH产品有着同等的免疫原性。
外推是生物仿制概念的重要元素,也是欧洲药物管理局批准这些药物的框架的一部分; 只要在不同的适应症中其作用方式相同,它允许批准与参考药物相同适应症的生物仿制药,而不需要对每个单独条件进行临床研究。因此,批准后的研究提供外推的适应症的安全性和有效性数据是很重要的。同样的,这些研究并没有发现与生物仿制药rhGH有任何意外或独特的安全问题,并且没有显示出任何与特殊疾病相关的AEs风险,如TS(脊柱侧凸,糖尿病,股骨头骨骺滑脱),PWS(脊柱侧凸,阻塞性睡眠呼吸暂停),以及出生SGA(糖尿病)的矮小。医生可以放心,生物仿制药rhGH与其他rhGH产品有着同样的安全性。
文献来源:
Borrás Pérez MV, Kriström B, Romer T, et,al. Ten years of clinical experience with biosimilar human growth hormone: a review of safety data.Drug Des Devel Ther. 2017 May 16;11:1497-1503.
识别微信二维码,添加生物制品圈小编,符合条件者即可加入抗体微信群!
请注明:姓名+研究方向!


版权为生物制品圈所有。欢迎个人转发分享。其他任何媒体、网站如需转载或引用本网版权所有内容须获得授权且在醒目位置处注明“转自:生物制品圈”。












