在病变部位精确激活聚合物纳米颗粒是获得良好的治疗效果关键。然而,传统的内源性刺激响应聚合物纳米颗粒很少触发刺激聚合物降解和随后的功能。近日,
中国科学技术大学
刘世勇教授、
胡祥龙教授
描述了含有苯基硼酸酯和二茂铁作为重复的主链单元的氧化反应性聚(二茂铁)两亲性体。
在肿瘤细胞内被过氧化氢触发后,苯基硼酸酯键断裂,聚(二茂铁)单元被降解,产生游离的二茂铁和明显的氢氧化物离子。释放的氢氧根离子可以立即提高聚(二茂铁)聚集体内的pH值,而pH值的上调则进一步促进了苯基硼酸酯主链的降解速率;因此,加速降解可以释放更多额外的氢氧根离子来改善pH,从而实现聚(二茂铁)聚集体的正自放大级联降解,同时伴随着氧化应激促进和有效的货物释放。当H
2
O
2
触发时,聚(二茂铁)聚集体在12小时内可降解90%,而无二茂铁对照纳米颗粒在12天内仅降解30%。栓系在亲水冠中的马来酰亚胺部分可以捕获血液白蛋白,形成富含白蛋白的蛋白冠,并显著改善肿瘤积累。
氧化反应性聚(二茂铁)两亲体可以在体内外有效抑制肿瘤。这项工作为自放大聚合物降解和同时发生的氧化应激提供了一个概念验证范式,这在积极调节的精确医学中很有前景。
相关研究成果以“Self-Amplified Cascade Degradation and Oxidative Stress Via
Rational pH Regulation of Oxidation-Responsive Poly(ferrocene) Aggregates”为题于2023年8月1日发表在《
Journal of the American Chemical Society
》。

在本研究中,在DBTL的催化下,由二羟基苯基硼酯单体和二茂基二异氰酸铁单体共聚,然后终止反应,制备了氧化反应聚(二茂铁)两亲体FcPB
n
。水溶液的自组装提供了合成的FcPB
n
纳米颗粒。进一步用马来酰亚胺基团功能化的聚(乙二醇)(PEG)终止FcPB
n
,得到FcPB
n
-MI。静脉注射后,FcPB
n
-MI纳米颗粒表面的马来酰亚胺组与血清白蛋白共价结合,形成血液中富含白蛋白的蛋白冠,显著改善肿瘤靶向传递(图1)。
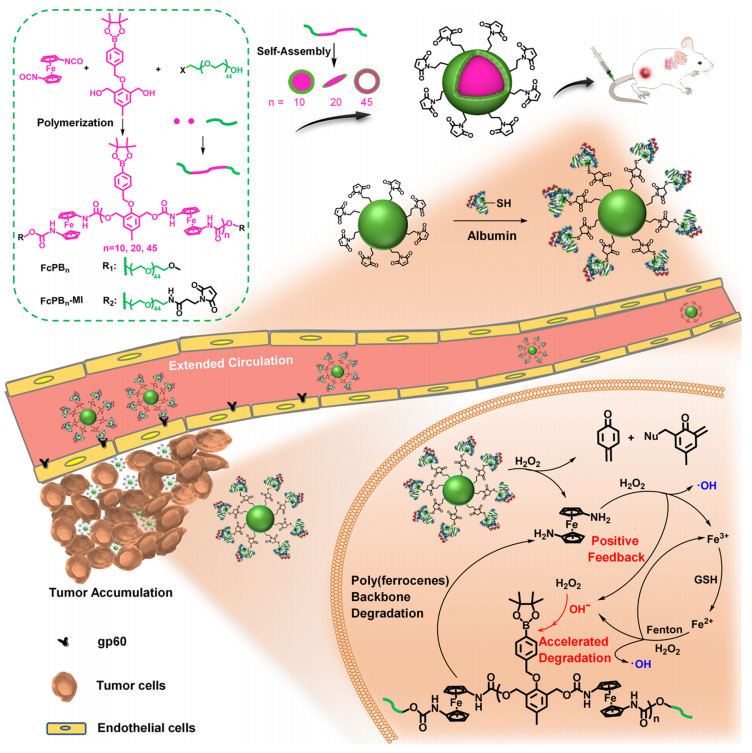
图1 聚(二茂铁)两亲体的制备和水自组装成不同的纳米聚集体示意图
【
聚(二茂铁)二亲体的制备和H
2
O
2
触发降解
】
选择小分子模型4-(4,4,5,5-四甲基-1,3,2-二氧硼兰-2-烷基)苄基(4-甲基2-氧-2H铬-7-烷基)氨基甲酸酯(BAC)来检测苯基硼酸酯的反应性(图2a)。BAC中苯硼酸酯被裂解后,释放的片段分子在光激发下可以产生荧光香豆素。当pH值调整到7.4时,香豆素的荧光强度在仅孵育10 min后增强了11倍(图2b、c)。以甲苯二异氰酸酯(TDI)和乙二醇(EG)作为对照,取代二茂二异氰酸铁和二羟基苯基硼酯,合成无二茂铁和苯基硼酯的对照样品TDIPB
10
和FcEG
10
(图2d)。透射电镜分析表明,聚(二茂铁)的聚合程度可以显著影响FcPB
n
的自组装形态。它们的自组装纳米结构分别被观察到为FcPB
10
、FcPB
20
和FcPB
45
的
纳米级球体、棒状体和囊泡
(图2e)。DLS分析显示,FcPB
10
纳米颗粒的半径从25nm降低到小于3 nm,相对光散射强度比天然FcPB
10
纳米颗粒降低了近30倍(图2f)。FcPB
10
的主峰面积在12 h时几乎消失,进一步说明
FcPB
n
的降解程度相当完整
(图2g)。TDIPB
10
的主峰面积在H
2
O
2
(1 mM)孵育12天后下降了30%(图2h),这也可以从剩余聚合物的校准中观察到(图2i)。总之,
H
2
O
2
响应的聚(二茂铁)两亲性体易于制备,具有良好的降解能力
。
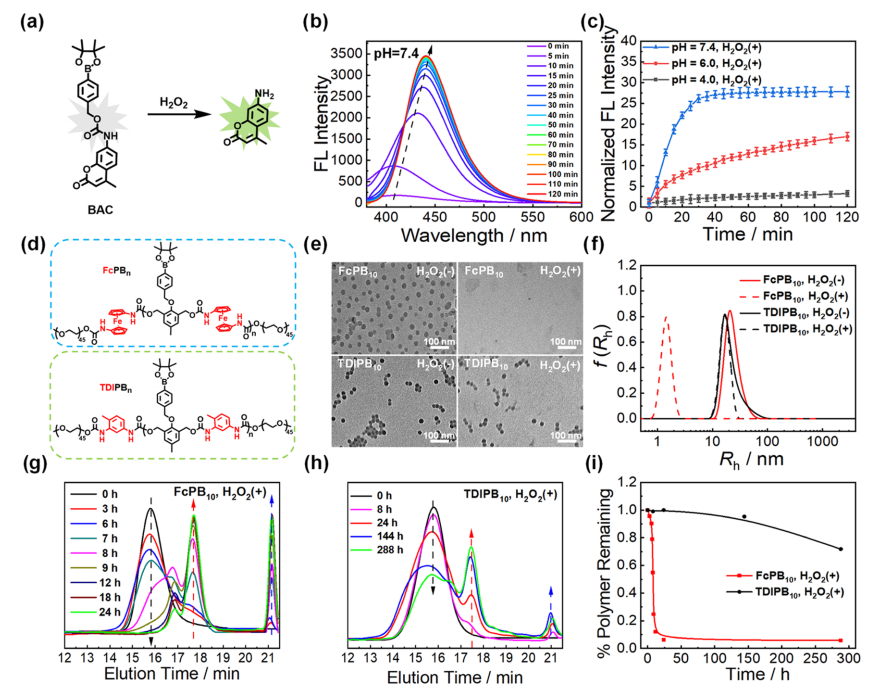
图2 聚(二茂铁)二亲体的制备和H
2
O
2
触发降解
【
H
2
O
2
触发降解并调节pH自放大级联降解和氧化应激
】
如图3a所示,FcPB
10
纳米颗粒的降解伴随着二茂铁的释放,它可以与H
2
O
2
反应生成铁/亚铁离子,并伴随着羟基自由基和羟基离子的转化。在1 mMH
2
O
2
的触发条件下,FcPB
10
、FcPB
20
和FcPB
45
都能在12 h内实现高效、快速的降解(图3b)。具体来说,LC-MS光谱显示了对羟基苯甲醇和2,6-Bis(羟甲基)-对甲酚的形成(图3c),表明
在水中降解产物
(图3a)。当FcPB
10
、FcPB
20
和FcPB
45
与H
2
O
2
共孵育8h,观察到水培养基的pH值也分别增加了0.7、0.75和0.8(图3d)。与FcPB
10
对应的典型峰的消失,证实了
在pH值为8.2的条件下,FcPB
10
纳米颗粒在3h内完全降解
(图3e)。而与H
2
O
2
共培养288 h,只有大约30%的降解发生(图3)。用2,2′-联吡啶(bipy)显色反应检测FcPB
10
纳米颗粒与H
2
O
2
混合物中的游离铁离子。在铁(II)离子的存在下,会形成红色的[Fe(bipy)3]
2+
配合物(图3g)。24 h内可以清楚地观察到,在H
2
O
2
和FcPB
10
存在下,2,2’-联吡啶溶液的颜色从无色变为红色(图3h)。接着还研究了H
2
O
2
对FcPB
10
的氧化反应性降解的浓度效应(图3i);APF被用作羟基自由基的特异性荧光探针(图3j)。
荧光强度与H
2
O
2
含量呈正相关
(图3k)。
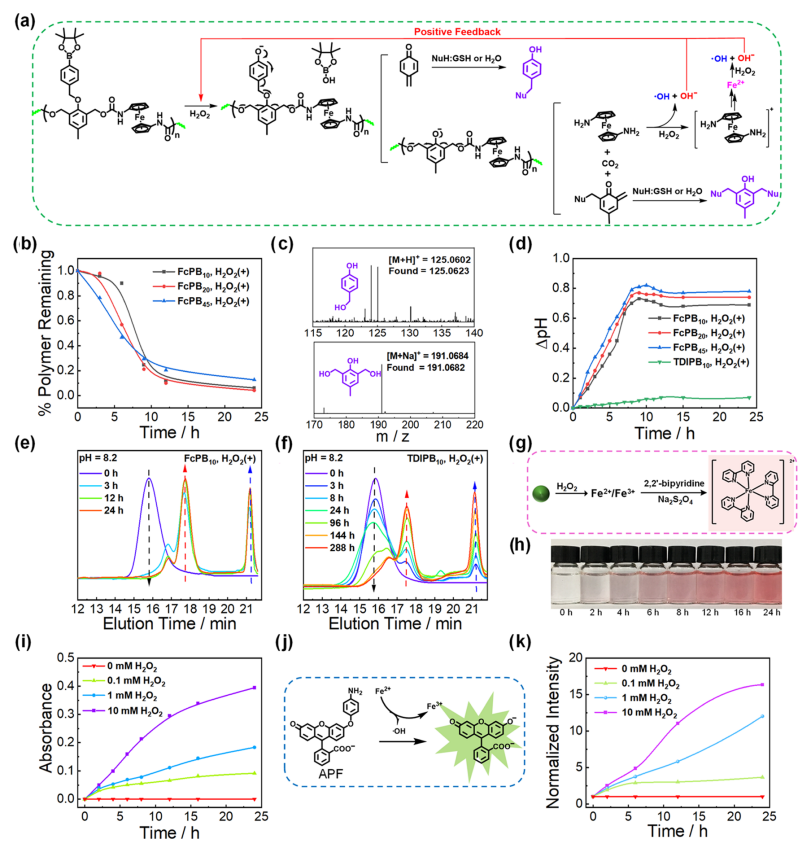
图3 H
2
O
2
触发降解并调节pH自放大级联降解和氧化应激
【聚(二茂铁)聚集体的自放大货物释放】
暴露于0.1 mMH
2
O
2
模拟肿瘤细胞的胞质过氧化氢水平后,负载尼罗河红的TDIPB
10
纳米颗粒的荧光强度在24小时后降低了20%(图4a),而对于负载尼罗河红的FcPB
10
纳米颗粒,在轻微的H
2
O
2
的存在下,荧光强度降低了85%(图4b、c)。因此,自我扩增的降解也可以促进多(二茂铁)聚集体内的物理负载药物的释放(图4d)。总的来说,
FcPB
10
纳米颗粒对生物相关浓度的H
2
O
2
(100μM)非常敏感,通过自扩增降解来快速释放货物
。
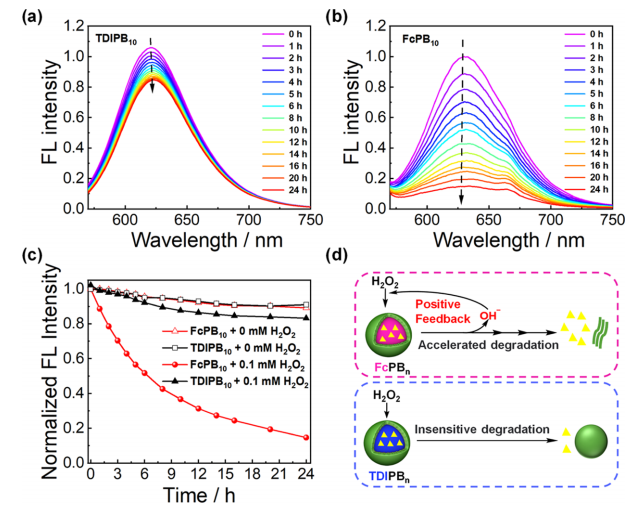
图4 聚(二茂铁)聚集体的自放大货物释放
【聚(二茂铁)聚物的选择性细胞毒性和肿瘤靶向作用】
作为无MI对照,FcPB
10
-ICG和FcPB
10
在质量比为1:4时的物理共组装很容易形成MI-free FcPB
10
-ICG/FcPB
10
纳米颗粒,作为无MI纳米颗粒,没有血白蛋白捕获能力(图5a)。FcPB
10
-MI
0.8
-ICG
0.2
和FcPB
10
-ICG/FcPB
10
纳米颗粒对4T1细胞的半抑制浓度值分别为11.1和15.7μM,而NIH3T3细胞对FcPB
10
-MI
0.8
-ICG
0.2
纳米颗粒的毒性可以忽略不计,且TDIPB
10
和FcEG
10
对4T1细胞均有不明显的毒性(图5b)。通过共聚焦激光扫描显微镜(CLSM)成像,进一步评估了聚(二茂铁)聚物的细胞摄取行为(图5c)。无苯硼酸无酯的FcEG
10
的羟基自由基含量为30%(图5d、e),这可能是由于H
2
O
2
的聚合物降解和聚集体中氨基二茂铁的有限接触。FcPB
10
- MI
0.8
-ICG
0.2
处理后,肿瘤细胞内巯基组分的数量明显低于其他各组(图5f)。
接下来使用MI栓系的FcPB
10
-MI
0.8
-ICG
0.2
和无MI的FcPB
10
- ICG/FcPB
10
纳米颗粒来研究蛋白冠的原位形成(图6a)。白蛋白吸附在FcPB
10
-MI
0.8
-ICG
0.2
上的摩尔百分比为45.5%,显著高于不含MI的FcPB
10
- ICG/FcPB
10
纳米颗粒(15.8%)(图6b)。FcPB
10
-MI
0.8
-ICG
0.2
和FcPB
10
- ICG/FcPB
10
纳米颗粒的半衰期指数分别为22.3和14.4h(图6c)。通过对携带皮下移植4T1肿瘤的BALB/c小鼠的荧光成像来监测这两种纳米颗粒的体内生物分布(图6d)。然后,采集肿瘤和主要器官进行离体成像(图6e)。FcPB
10
-MI
0.8
-ICG
0.2
组的肿瘤荧光强度明显强于FcPB
10
- ICG/FcPB
10
组(图6f)。将荷瘤小鼠随机分为4组G1:PBS;G2:TDIPB
10
、G3:FcPB
10
-ICG/FcPB
10
和G4:FcPB
10
-MI
0.8
-ICG
0.2,
记录肿瘤体积和体重(图6g−i)。
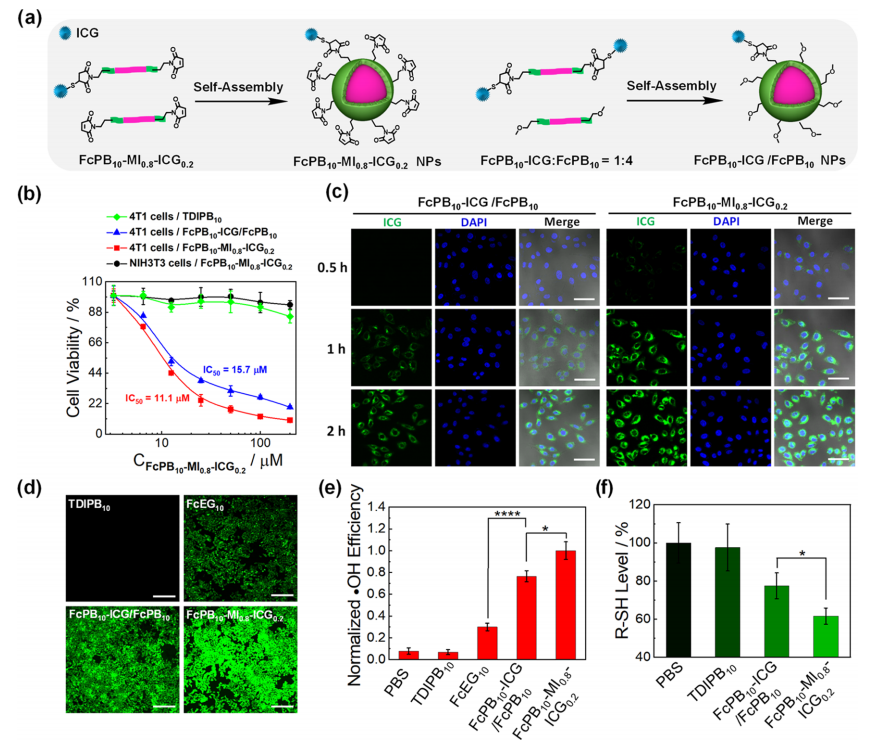
图5 聚(二茂铁)聚物的选择性细胞毒性















