本文转自小张聊科研
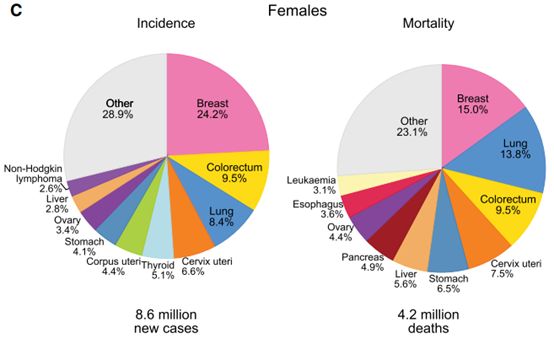
乳腺癌是当前影响女性生命健康最重要的一种癌症,根据神刊CA杂志发布的2018年癌症统计报告,在过去的一年中,新增的女性癌症患者大约有860万,其中有24.2%为乳腺癌;因为癌症死亡的女性有420万,其中乳腺癌患者占据15%。由此可见,乳腺癌是众多癌症中新增病例最多,死亡率最高的癌症。
虽然乳腺癌已经严重威胁到女性的生命健康,但是目前能有效治疗乳腺癌的药物并不多,其中最主要的原因是缺乏靶点以及病人异质性导致的治疗抵抗。
根据乳腺癌细胞表面三种重要分子(分别为雌激素受体ER、孕激素受体PR和人表皮生长因子受体2 HER2)的表达情况,可以大致将乳腺癌分为3大类,分别为雌激素受体阳性(ER+)乳腺癌、人表皮生长因子受体2阳性(HER2+)乳腺癌和三阴性乳腺癌。

今天笔者分享的这篇Nature文章是一项在乳腺癌治疗领域取得重大突破的研究,然而,就是这样一项让人兴奋不已的研究成果却是来源于一场意外,下面我们一起来见证这场美丽的意外吧。
这篇文章于2019年4月17日发表在Nature杂志上,通讯作者是哈佛大学医学院的Senthil K. Muthuswamy教授和丹娜-法伯癌症研究所的Myles Brown教授。
在这篇文章中,作者发现
ER+的乳腺癌中LLGL2能通过提高亮氨酸摄取来缓解营养压力
。

研究背景:
ER+乳腺癌占据女性乳腺癌患者总数的65%-75%,具有较高的发病率,目前针对这种癌症的主要治疗手段是内分泌治疗,其主要的策略就是靶向ER的抑制剂或者是能够与雌激素竞争性结合ER的激素类似物。
临床上应用较多的药物是他莫昔芬,它就是一种雌激素类似物,但是很多乳腺癌患者对他莫昔芬不敏感,其中的机制目前还不清楚,如何提高他莫昔芬的敏感性也一直是研究的重点和难点。
LLGL2是果蝇中LGL蛋白的类似物,在果蝇中它作为一种肿瘤抑制因子,能够抑制肿瘤生长,但是在哺乳动物中LLGL2是否影响肿瘤的发生发展目前还不清楚,本文就对这个问题进行探究。
研究结果:
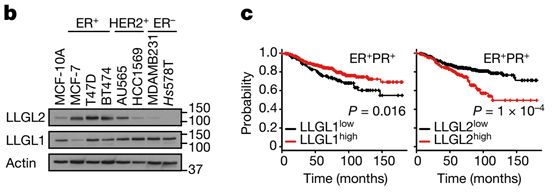
为了探究LLGL2对乳腺癌发生的影响,作者检测了不同类型乳腺癌细胞中LLGL2的表达,发现在ER+乳腺啊癌中,LLGL2高表达,并且通过KM plot生存分析也揭示高表达LLGL2的病人,其生存率降低,这暗示LLGL2促进乳腺癌发生。
为了确定这个结果,作者在
乳腺癌细胞中敲低LLGL2,发现在正常培养基中,细胞的增殖无明显变化(
想想此时,作者估计已经泪奔
)
。
但是在一次偶然的实验中,作者忘了在培养基中加入血清(
我也曾经忘了加血清,悲剧的是我没有收到意外结果,却收到了导师的臭骂
),却意外的发现
在血清饥饿的情况下
,乳腺癌发生受到明显抑制,这暗示血清对LLGL2功能的发挥至关重要。
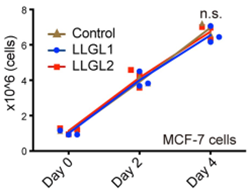
正常培养基
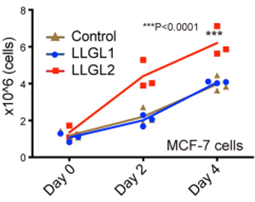
血清饥饿培养基
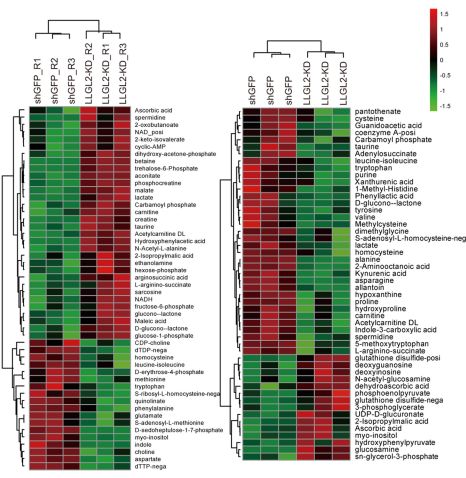
接下来作者探究血清中究竟何种因子调控LLGL2对肿瘤细胞生长的促进作用。通过
代谢组学的分析
,作者发现血清中的亮氨酸在其中起着至关重要的作用,LLGL2能够促进细胞对亮氨酸的摄取,从而提高肿瘤的生长。
接下来作者探究LLGL2促进亮氨酸摄取的机制,
由于LLGL2并没有氨基酸转运能力,这表明这个过程可能需要其他蛋白的介导。
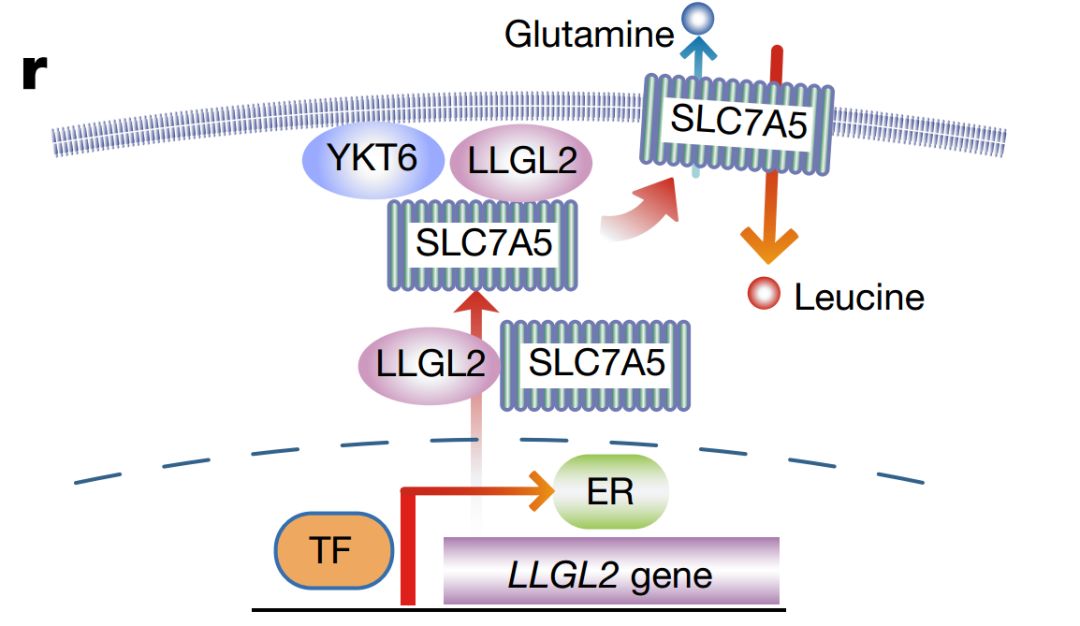
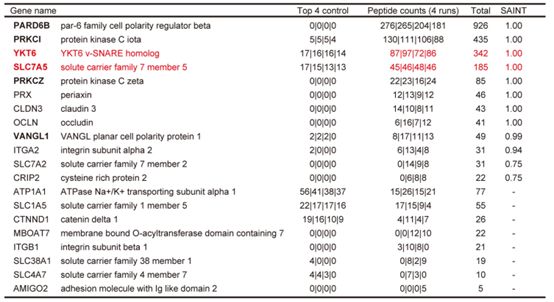
通过质谱检测,作者发现LLGL2能与SLC7A5和YKT6结合形成三聚体,从而将SLC7A5锚定在细胞膜上,后者作为一种氨基酸转运体,能介导亮氨酸的转运。
在文章的开始,研究表明ER+乳腺癌细胞中LLGL2蛋白表达量较高,
那其中的机制是什么呢?
为了回答这个问题,
作者使用雌激素刺激细胞,发现
雌激素
能够促进LLGL2表达,并且这一过程依赖于血清饥饿。
接下来作者通过chip-seq实验揭示了
雌激素受体
ER促进LLGL2表达的机制,在LLGL2基因的第二个内含子上含有ER结合位点,
ER与该位点结合后促进LLGL2的转录表达
。
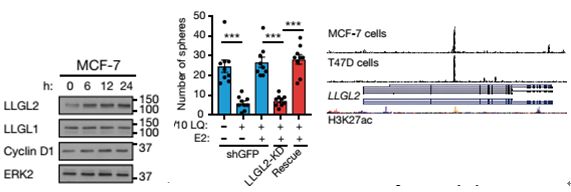
接下来作者探究
这条信号通路对他莫昔芬治疗抵抗的影响
,通过WB检测,作者发现在他莫昔芬抵抗的细胞中,SLC7A5的表达量上调,敲低SLC7A5或者LLGL2后,细胞对他莫昔芬的抵抗作用消失。
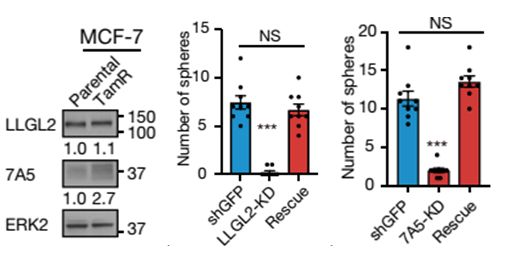
总结这篇文章,作者意外的发现:
在血清饥饿的情况下,雌激素能够与LLGL2基因的第二个内含子结合,促进LLGL2表达,后者在YKT6的协助下促进SLC7A5的膜定位,促进SLC7A5的亮氨酸的摄取,进而提高肿瘤生长,因此,SLC7A5和LLGL2可以作为ER+乳腺癌的治疗靶点。